敲低和过表达LDHB对HeLa细胞生长的影响
金科华, 刘复兴(湖北科技学院基础医学院生物化学教研室, 咸宁 43700; 湖北科技学院基本医学院病理学教研室)
敲低和过表达LDHB对HeLa细胞生长的影响
金科华1, 刘复兴2(1湖北科技学院基础医学院生物化学教研室, 咸宁437100;2湖北科技学院基本医学院病理学教研室)
摘要:目的研究敲低和过表达LDHB(lactate dehydrogenase B)对HeLa细胞生长的影响。方法根据慢病毒质粒pLn (pLL3.7-neo) 特点,设计三对分别靶向LDHB cDNA 48,201,443位核苷酸序列的shRNA(short hairpin RNA)引物,退火后与pLn重组。同时,将LDHB cDNA与慢病毒质粒pIp(pBOBI-IRES-puro)重组,获得的重组质粒与慢病毒包装质粒共转染293T细胞,将获得的病毒上清感染HeLa细胞,Western blot鉴定LDHB的敲低和过表达对LDHB蛋白水平的影响,并观察其对HeLa细胞生长的影响。结果靶向LDHB第48位核苷酸的shRNA显著敲低LDHB(P<0.01),443位次之,201位无敲低作用。shRNA序列对HeLa细胞生长的抑制作用与其敲低效果成正相关。转染pIp-LDHB显著升高LDHB在HeLa细胞中的表达水平(P<0.01),但不影响其生长。结论敲低LDHB抑制HeLa细胞生长,下调LDHB的表达可能有助于宫颈癌的治疗。
关键词:乳酸脱氢酶B;敲低;过表达;HeLa细胞
近年来,陆续发现乳酸脱氢酶B(lactate dehydrogenase B,LDHB)的异常表达与肿瘤的发生、发展和不良预后密切相关。von Eyben等[1],康一娟[2],张惟[3]分别发现睾丸癌、子宫内膜异位癌和膀胱移行细胞癌中LDHB高表达。Ishikawa等[4]研究表明生殖细胞瘤中因LDHA(lactate dehydrogenase A)的高度甲基化,导致LDHB高度表达,而Leiblich等[5]发现前列腺癌细胞中LDHB启动子高度甲基化,导致其表达沉默。Liao等[6]发现LDHB低表达与膀胱尿路上皮癌的发展密切相关。骆平等[7]和McCleland等[8]发现敲低LDHB可以抑制肝癌细胞和三阴性乳腺癌细胞的生长,而Cui等[9]发现抑制LDHB可诱导胰腺癌的糖酵解表型并促进其生长。
可见,LDHB对肿瘤细胞生长的作用具有特异性。本文采用过表达和shRNA干预LDHB的表达,观察其对HeLa细胞生长的影响,以期发现LDHB对HeLa生长的作用,为宫颈癌的基因治疗奠定基础。
1材料与方法
1.1菌株、质粒、cDNA与细胞株
大肠埃希菌DH5α、TOP10,质粒pIp(pBOBI-IRES-puro)、pLn(pLL3.7-neo)分别由李博安教授、吴乔教授馈赠,慢病毒包装质粒(MDL、VSGV、REV)及LDHB cDNA为韩家淮教授馈赠。人胚肾293T细胞、HeLa细胞为本教研室保存。
1.2主要试剂
PrimeSTAR DNA聚合酶、Solution Ⅰ、小牛肠碱性磷酸酶(CIAP)为TaKaRa产品。胶回收试剂盒、PCR纯化试剂盒为OMEGA产品;快速限制性核酸内切酶为Thermo公司产品。胎牛血清(FBS)为PPA公司产品,DMEM培养基为Invitrogen公司产品。Polybrene为Sigma产品。 RIPA(强)裂解液,BCA法蛋白定量试剂盒为碧云天公司产品。抗人LDHB、LDHA、β-actin单克隆抗体分别为Epitomics、Cell signaling和Sigma公司产品,辣根过氧化物酶标记的羊抗兔(或鼠)IgG抗体(二抗)购自北京中杉金桥公司。增强型化学发光液(ECL)、Fugene转染试剂购自Promega公司。
1.3构建LDHB干扰表达载体
1.3.1LDHB干扰引物的设计根据LDHB cDNA序列及质粒pLn说明书,利用Lifetechnology公司的iRNA在线设计软件,设计靶向LDHB cDNA第48、201、443位核苷酸序列的 shRNA(short hairpin RNA)引物。正向引物:48 s:5′-TGGCAACAGTTCCAAACAATTTCAAGAGAATTGTTTGGAACTGTTGCCTTTTTTC-3′;201s: 5′-TGCATGGGAGCTTATTTCTTTTCAAGAGAAAGAAATAAGCTCCCATG-
CTTTTTTC-3′;443s: 5′-TCCTGGAAACTAAGTGGATTTTCAAGAGAAATCCACTTAGTTTCCAGGTTTTT-
TC-3′。反向引物:48a: 5′-TCGAGAAAAAAGGCAA
CAGTTCCAAACAATTCTCTTGAAATTGTTTGGAACT-
GTTGCCA-3′;201a: 5′-CGAGAAAAAAGCATGGGAGCTTATTTCTTTCTCTTGAAAAGAAATAAGCTCCC-
ATGCA-3′; 443a: 5′-TCGAGAAAAAACCTGGAAACTAAGTGGATTTCTCTTGAAAATCCACTTAG-
TTTCCAGGA-3′。下划线处为发夹的loop区。正、反向引物的5′端进行磷酸化修饰。引物退火后-20 ℃保存,备用。
1.3.2 退火产物与pLn连接、转化取pLn质粒28 μl(2 μg),HpaⅠ、XbaⅠ各3 μl,10×FD buffer 6 μl,水20 μl,混匀,37 ℃酶切1 h。胶回收双酶切的pLn,并对其去磷酸化:pLn 45 μl,CIAP 2 μl,10×CIAP buffer 6 μl,水7 μl,混匀,37 ℃反应1 h。用PCR纯化试剂盒纯化去磷酸化的pLn。将4 μl pLn、1 μl退火产物及5 μl Solution Ⅰ混匀,16 ℃连接3 h。连接产物热激法转化TOP10感受态细胞,于含100 μg/ml羧苄青霉素的LB平板筛选抗性菌落。
1.3.3鉴定重组干扰质粒将单菌落接种于10 ml含100 μg/ml羧苄青霉素的LB中,37 ℃,250 r/min,培养10 h。抽提质粒,进行酶切鉴定:pLn-LDHB shRNA 16 μl,HpaⅠ、XbaⅠ 各1 μl,10×FD green buffer 2 μl,混匀,37 ℃酶切2 h。酶切产物进行琼脂糖凝胶电泳检测。对酶切鉴定的阳性质粒进行测序。
1.4构建LDHB过表达载体
1.4.1PCR扩增LDHB根据LDHB cDNA序列及质粒pIp多克隆位点,设计正向引物LDHBs: CGATCTAGAATGGCAACTCTTAAGGAAAAACTC;反应引物LDHBa: AGTGGATCCTCACAGGTCTTTTAGGTCCTTCTG。下划线序列分别为XbaⅠ、BamHⅠ位点。PCR体系:LDHBs(10 μmol/L)4 μl,LDHBa(10 μmol/L)4 μl,5×HS Buffer 40 μl,dNTP Mixture(各2.5 mmol/L)16 μl,H2O 132 μl,PrimeSTAR DNA聚合酶 2 μl,LDHB cDNA 2 μl,混匀,分成4等份。PCR参数:98 ℃,10 s;65 ℃,10 s;72 ℃,1 min。30个循环,最后72 ℃延伸10 min。扩增产物行胶回收纯化。
1.4.2PCR产物与pIp连接、转化取pIp质粒16 μl(1 μg),XbaⅠ、BamH Ⅰ各1 μl,10×FD Green buffer 2 μl。混匀,37 ℃酶切2 h。胶回收双酶切的pIp。另取PCR产物20 μl,XbaⅠ、BamHⅠ 各2 μl,10×FD Green buffer 4 μl,水12 μl。混匀,37 ℃酶切1 h。PCR纯化试剂盒纯化酶切产物。将pIp 1 μl、酶切后纯化的PCR产物4 μl及SolutionⅠ 5 μl混匀,16 ℃连接1 h。按1.3.2转化连接产物、筛选抗性菌落。
1.4.3鉴定重组过表达质粒按1.3.3的方法抽提质粒、酶切和测序鉴定重组质粒pIp-LDHB。
1.5慢病毒的包装与感染
将293T细胞按1.5×106个/皿接种于直径6 cm的培养皿,加入3 ml培养基(DMEM+10% FBS),培养过夜。将重组干扰质粒(或过表达质粒)3 μg、MDL 1.5 μg、VSVG 0.9 μg、REV 0.6 μg混合,加入0.4 ml OPTI-MEM培养基,并加入18 μl Fugene HD,混匀,室温静置15 min。更新293T细胞培养基,逐滴加入质粒转染混合物,轻晃混匀。24 h后更新培养基,收集转染后48 h的培养基,置-80 ℃保存。
将HeLa细胞按6×105个/孔接种于6孔板,加入1.5 ml培养基(同上),培养过夜。将-80 ℃保存的含慢病毒的培养基恢复至室温,加入终浓度10 μg/ml的polybrene,混匀。弃HeLa细胞培养基,PBS洗涤一次,加入1.5 ml上述病毒液,平行感染两孔HeLa细胞(一孔用于Western blot检测,另一孔用于筛选稳转细胞),轻晃混匀,培养8 h,更新培养基,继续培养24 h,观察HeLa细胞形态变化,并拍照记录。
1.6Western blot检测 LDHB干扰或过表达效果
弃检测孔培养基,PBS洗涤3次,加入RIPA裂解液 200 μl,冰浴裂解5 min,收集裂解的细胞,超声10 s,4 ℃ 13 000 r/min离心10 min。取上清,测定蛋白浓度,用RIPA裂解液将其调整至等浓度,加入4×loading buffer,混匀,100 ℃ 加热10 min。取15 μl样品进行SDS-PAGE。电泳完毕,将蛋白转移至PVDF膜;5% BSA室温封闭1 h;分别加3 ml 1∶20 000稀释的抗LDHB抗体、1∶5 000稀释抗β-actin抗体、1∶5 000稀释的抗LDHA抗体,于4 ℃将相应的PVDF膜孵育过夜;回收一抗,TBST洗膜3次,每次5 min;加20 ml 1∶5 000稀释的二抗,室温孵育1 h;回收二抗,TBST洗膜3次,每次5 min;加1 ml ECL覆盖PVDF膜,用BIO-RAD ChemiDOC XRS+成像系统拍照。
上述1.5-1.6的实验,均重复三次。
2结果
2.1重组干扰质粒的鉴定
重组LDHB干扰质粒和空质粒pLn经XbaⅠ+XhoⅠ 酶切后,均于250-500 bp之间出现小片段,且重组质粒酶切产生的小片段比空质粒大,与预期相符(图1)。可见LDHB干扰引物退火片段成功插入pLn中。测序结果表明插入片段序列均与理论一致。
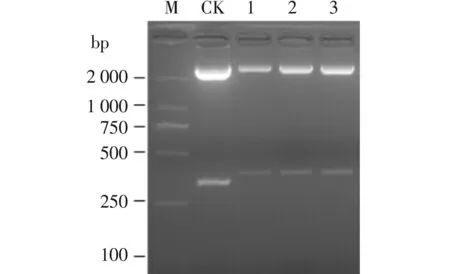
M.DNA marker;CK.pLn Xba Ⅰ+XhoⅠ酶切产物;1.pLn-LDHB sh48 Xba Ⅰ+Xho Ⅰ酶切产物; 2.pLn-LDHB 201 Xba Ⅰ+XhoⅠ酶切产物; 3.pLn-LDHB 443 XbaⅠ+XhoⅠ酶切产物图1 重组干扰质粒的酶切鉴定Figure 1 Identification of recombinant interfering plasmids by digestion
2.2LDHB cDNA PCR扩增
LDHB cDNA PCR产物略大于1 000 bp,与LDHB cDNA分子量(1 005 bp)相符,而空白对照未见扩增条带(图2)。
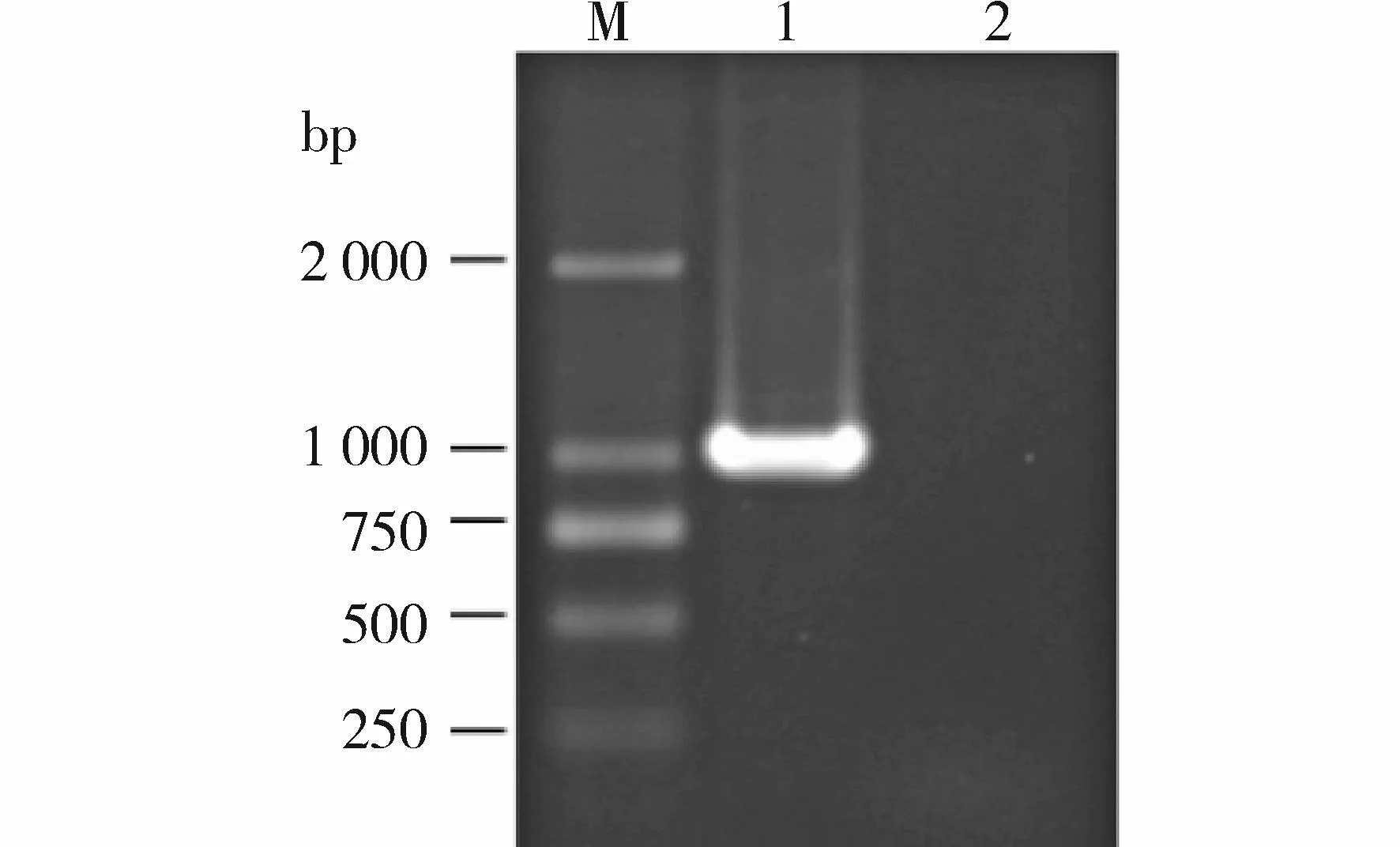
M.DNA marker;1.LDHB PCR 产物;2.空白对照图2 琼脂糖凝胶电泳检测LDHB cDNA PCR产物Figure 2 PCR product of LDHB cDNA by agarose gel electrophoresis
2.3重组过表达质粒的鉴定
有两个重组子质粒酶切后产生略大于1 000 bp的条带(6、7泳道),与LDHB cDNA分子量(1 005 bp)相符,而空载体无此条带(见图3),可见PCR产物插入pIp中。测序结果表明插入片段与LDHB cDNA序列一致。

M.DNA marker;1.pLn Xba Ⅰ+Xho Ⅰ酶切产物;2-9.重组子Xba Ⅰ+Xho Ⅰ酶切产物图3 重组过表达质粒的酶切鉴定 Figure 3 Identification of recombinant overexpression plasmids by digestion
2.4LDHB干扰及过表达效果检测
Western blot结果提示:48 shRNA显著干扰LDHB的表达(P<0.01),443 shRNA干扰作用较弱,201 shRNA、pLn、pLn-scramble均无干扰作用,且上述5个质粒对LDHA均无干扰作用(见图4A);pIp-LDHB显著升高HeLa细胞LDHB的表达水平(P<0.01),而pIp对LDHB的表达无明显影响(见图4B)。
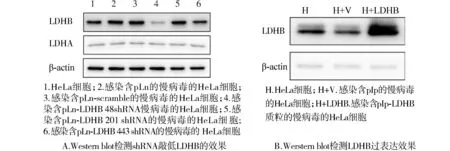
图4 Western blot检测LDHB敲低或过表达48 h后的蛋白水平Figure 4 Protein levels of LDHB in HeLa cells at 48 h after knocking down or overexpression by Western blot
2.5干预LDHB表达对HeLa细胞生长的影响
48 shRNA干扰LDHB表达的HeLa细胞生长变慢,密度变小,漂浮细胞多;443 shRNA有类似效果,但较弱。pLn、scramble序列及201 shRNA对HeLa 细胞的生长无明显影响(见图5)。可见,干扰LDHB抑制HeLa细胞的生长。
感染含pIp或pIp-LDHB质粒的慢病毒的HeLa细胞与HeLa母细胞生长密度和形态无明显差异(见图6)。可见,过表达LDHB对HeLa细胞的生长无影响。

A.HeLa 细胞;B.感染含pLn的慢病毒的HeLa细胞; C.感染含pLn-scramble的慢病毒的HeLa细胞; D.感染含pLn-48shRNA的慢病毒的HeLa细胞;E.感染含pLn-201shRNA的慢病毒的HeLa细胞; F.感染含pLn-443shRNA的慢病毒的HeLa细胞图5 敲低LDHB抑制HeLa细胞生长 (×10)Figure 5 Knocking down LDHB inhibited the growth of HeLa cells (×10)
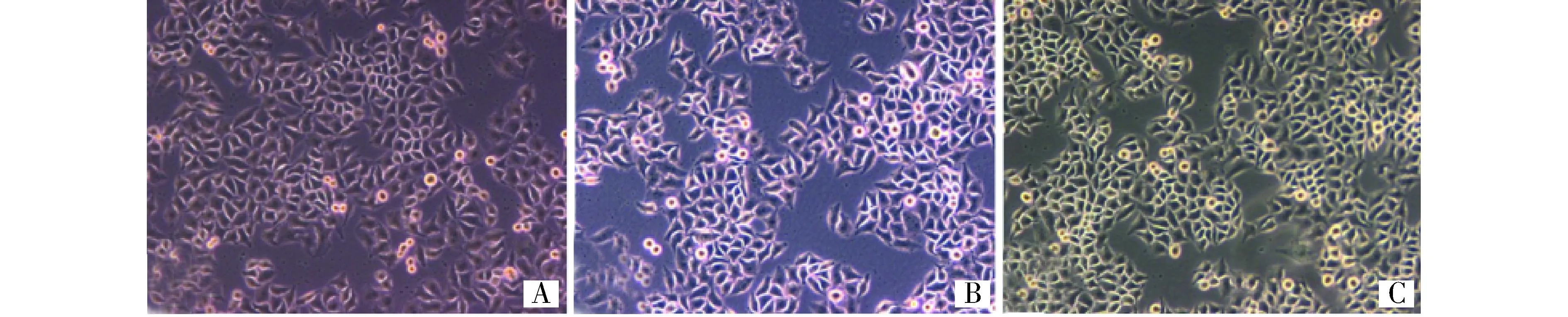
A.HeLa 细胞;B.感染含pIp的慢病毒的HeLa细胞; C.感染含质粒pIp-LDHB的慢病毒的HeLa细胞图6 过表达LDHB不影响HeLa细胞生长 (×10)Figure 6 Overexpressing LDHB had no effect on the growth of HeLa cells (×10)
3讨论
正常细胞主要依靠氧化磷酸化产生ATP,而多数肿瘤细胞,即使氧气充足,也主要由糖酵解提供ATP。同时,糖酵解中间产物为肿瘤细胞快速增殖提供生物合成前体[10]。LDH是糖酵解的重要酶之一,催化丙酮酸和乳酸之间的相互转化。LDH是由LDHA和LDHB两种亚基构成的四聚体,共有5种同工酶(LDH1-5),单亚基和四聚体均具有酶活性。LDHA主要催化丙酮酸还原为乳酸,而LDHB主要催化乳酸氧化为丙酮酸[11]。
理论上,LDHA表达水平不变时,干扰LDHB表达会导致LDH的同工酶LDH1、LDH2的减少,LDH5、LDH4相对增多,减少乳酸向丙酮酸的转化,增加其逆反应,加速糖酵解,促进糖酵解表型的肿瘤细胞生长。肿瘤细胞内产生的乳酸如不及时排出胞外,会导致pH降低,引起细胞酸化中毒,抑制其生长。为防止细胞酸化,肿瘤细胞间形成代谢共生体:糖酵解表型的肿瘤细胞高表达MCT4(monocarboxylate transporter 4),将乳酸排出胞外[12];氧化磷酸化表型的肿瘤细胞高表达MCT1(monocarboxylate transporter 1),摄入糖酵解表型的肿瘤细胞外排的乳酸[13],将其氧化为丙酮酸,经由三羧酸循环氧化,产生ATP。干扰LDHB是否加速了乳酸产生,而未增加MCT4和MCT1的表达,导致胞内乳酸堆积、细胞酸化,从而抑制HeLa细胞生长,须进一步研究。LDHB是一种多功能蛋白,除催化乳酸与丙酮酸的相互转化外,还能转运至细胞核,调节相关基因的表达[14]。干扰LDHB的表达是否削弱LDHB的非糖酵解功能,通过其他途径抑制HeLa细胞生长,值得深入研究。
LDHB与LDHA的cDNA序列有较高同源性[15],但本研究结果提示LDHB的shRNA序列并未干扰LDHA的表达。故干扰LDHB对HeLa细胞生长的抑制作用与LDHA无关。
过表达是研究基因功能的常用技术,但细胞内过表达的蛋白是否具有相应的生物学活性鲜有文献报道。过表达LDHB并未影响HeLa细胞生长,是否因LDHB缺乏翻译后加工修饰,致其无活性,从而对HeLa细胞生长无影响,需要进一步研究。
本文结果表明敲低LDHB的表达抑制HeLa细胞的生长,可见下调LDHB的表达可能有助于宫颈癌的治疗。
参考文献:
[1]von Eyben FE,Skude G,Tropé C,etal.Lactate dehydrogenase isoenzyme 1(LDH-1) in athymic mice with xenografts of a human testicular germ cell tumor[J].Mol Gen Genet,1982,186(3):427-431.
[2]康一娟.LDHB在子宫内膜异位症的表达及其意义的相关性研究[D].武汉:华中科技大学,2013.
[3]张惟.膀胱移行细胞癌组织中乳酸脱氢酶B亚基蛋白表达变化及意义[J].山东医药,2013,53(2):82-83.
[4]Ishikawa J,Taniguchi T,Higashi H,etal.High lactate dehydrogenase isoenzyme 1 in a patient with malignant germ cell tumor is attributable to aberrant methylation of the LDHA gene[J].Clin Chem,2004,50(10):1826-1828.
[5]Leiblich A,Cross SS,Catto JW,etal.Lactate dehydrogenase-B is silenced by promoter hypermethylation in human prostate cancer[J].Oncogene,2006,25(20):2953-2960.
[6]Liao AC,Li CF,Shen KH,etal.Loss of lactate dehydrogenase B subunit expression is correlated with tumour progression and independently predicts inferior disease-specific survival in urinary bladder urothelial carcinoma[J].Pathology,2011,43(7):707-712.
[7]骆平,查小军,汪宏.mTOR和LDHB在肝细胞癌组织中的表达及意义[J].安徽医学,2012,33(8):965-969.
[8]McCleland ML,Adler AS,Shang Y,etal.An integrated genomic screen identifies LDHB as an essential gene for triple-negative breast cancer[J].Cancer Res,2012,72(22):5812-5823.
[9]Cui J,Quan M,Jiang W,etal.Suppressed expression of LDHB promotes pancreatic cancer progression via inducing glycolytic phenotype[J].Med Oncol,2015,32(5):143.
[10]Warburg O.On respiratory impairment in cancer cells[J].Science,1956,124(3215):269-270.
[11]Porporato PE,Dhup S,Dadhich RK,etal.Anticancer targets in the glycolytic metabolism of tumors: a comprehensive review[J].Front Pharmacol,2011,2:1-18.
[12]Dimmer KS,Friedrich B,Lang F,etal.The low-affinity monocarboxylate transporter MCT4 is adapted to the export of lactate in highly glycolytic cells[J].Biochem J,2000,350(1):219-227.
[13]Sonveaux P,Vegran F,Schroeder T,etal.Targeting lactate-fueled respiration selectively kills hypoxic tumor cells in mice[J].J Clin Invest,2008,118(12):3930-3942.
[14]Zheng L,Roeder RG,Luo Y.S phase activation of the histone H2B promoter by OCA-S,a coactivator complex that contains GAPDH as a key component[J].Cell,2003,114(2):255-266.
[15]Sakai I,Sharief FS,Pan YC,etal.The cDNA and protein sequences of human lactate dehydrogenase B[J].Biochem J,1987,248(3):933-936.
Effects of knocking down and overexpression of LDHB on the growth of HeLa cells
JIN Kehua1,LIU Fuxing2
(1DepartmentofBiochemistry,BasicMedicalCollogeofHubeiScienceandTechnologyUniversity,Xianning437100,China;2DepartmentofPathology,BasicMedicalCollegeofHubeiScienceandTechnologyUniversity)
Abstract:ObjectiveTo explore the effects of knocking down and overexpression of LDHB on the growth of HeLa cells.MethodsThree pairs of interfering primers, respectively targeting 48, 201, 443 locus of LDHB cDNA sequences, were synthesized according to the instructions of lentivirus vector pLn(pLL3.7-neo). The cDNA of LDHB was recombined with overexpression plasmid pIp (pBOBI-IRES-puro). Recombinant plasmids pIp-LDHB or pLn-LDHB shRNAs were cotransfected with lentivirus package plasmids to 293T cells. After 48 h, the medium of 293T was harvested and applied to infect HeLa cells. The effects of interference and overexpression on the protein levels of LDHB were detected by Western blot, and the effects on the HeLa cell growth were observed simultaneously.ResultsThe protein levels of LDHB were significantly, weakly, little knocked down by shRNA 48(P<0.01), shRNA 443, shRNA 201, respectively. The protein level of LDHB was elevated significantly after transfected with pIp-LDHB(P<0.01). The inhibition effects of LDHB shRNAs on the growth of HeLa cells were in line with their interfering effects.However, the overexpression of LDHB had no influence on HeLa cell growth.ConclusionKnocking down LDHB could inhibit the growth of Hela cells, and the down-regulation of LDHB expression may contribute to the treatment of cervical cancer.
Key words:lactate dehydrogenase B;knocking down;overexpression;HeLa cells
[收稿日期:2015-08-02]
作者简介:金科华,男,1978-12生,硕士,讲师,E-mail:wenyuanxueyuan@126.com.
中图分类号:R329
文献标志码:A
文章编号:1007-6611(2016)01-0041-05
DOI:10.13753/j.issn.1007-6611.2016.01.010
基金项目:湖北科技学院校级科研基金资助项目(ky2014074)

