微小RNA- 21在胰岛素抵抗和糖尿病伴发非酒精性脂肪肝发病中的作用
赵晓云,邵 凯
山东大学 齐鲁医院(青岛)检验医学中心,山东青岛 266000
·论著·
微小RNA- 21在胰岛素抵抗和糖尿病伴发非酒精性脂肪肝发病中的作用
赵晓云,邵凯
山东大学齐鲁医院(青岛)检验医学中心,山东青岛 266000
摘要:目的应用高脂喂养分别诱导胰岛素抵抗(IR)和糖尿病(DM)伴发非酒精性脂肪肝(NAFLD)小鼠模型,探讨肝脏微小RNA- 21(miR- 21)表达改变在NAFLD发病中的作用。方法实验分3组:对照组、IR组和DM组;记录小鼠体质量,腹腔糖耐量实验确定糖代谢异常,行肝脏病理切片检查,检测空腹血糖、血清胰岛素、血脂、肿瘤坏死因子α含量的变化,检测肝脏miR- 21表达和肝脏过氧化物酶体增殖物激活受体亚型(PPAR-γ、PPAR-α)和脂肪型脂肪酸结合蛋白(aP2)基因和蛋白表达改变。结果IR组体质量、血清胰岛素水平和稳态模型胰岛素抵抗指数较对照组明显上升(P<0.01,P<0.05),DM组空腹血糖浓度上升,而血清胰岛素水平明显下降(P<0.05),其他指标较对照组差异无统计学意义(P>0.05);IR组血清胰岛素水平较对照组增加而DM组明显降低 (P<0.01,P<0.05);IR组和DM组葡萄糖曲线下面积较对照组显著增加(P<0.01)。IR组和DM组血清肿瘤坏死因子-α水平呈明显上升趋势(P<0.05,P<0.01)。IR组和DM组伴随着NAFLD加重,肝脏组织miR- 21表达水平进一步下调(P<0.05),与IR组PPAR-α、aP2和PPAR-γ基因表达上调呈负相关(r值分别为-0.696、-0.664和-0.766,P<0.05),与DM组PPAR-α和PPAR-γ基因表达上调也呈负相关(r值分别为-0.676和-0.550,P<0.05);蛋白表达改变仅IR组PPAR-γ和aP2较对照组明显上调(P<0.05,P<0.01)。结论IR和DM伴发NAFLD时肝组织均出现miR- 21表达降低,可能通过调节PPAR-α和PPAR-γ的基因表达参与NAFLD发病。
关键词:非酒精性脂肪肝;微小RNA- 21;胰岛素抵抗;糖尿病;过氧化物酶体增殖物激活受体亚型
ActaAcadMedSin,2016,38(2):144-149
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是一种临床病理综合征,表现为肝脏内过多的脂肪堆积。NAFLD发展从脂肪变性到脂肪肝炎和肝硬化,已证实代谢综合征相关如肥胖、2型糖尿病(diabetic mellitus,DM)和血脂异常为其主要危险因素。NAFLD不仅提高肝脏相关疾病的发病率或死亡率,也能增加冠状动脉心脏病及其他心血管并发症的风险[1- 2]。二次打击假说可以部分解释非酒精性肝损伤、脂肪变性和脂肪肝炎的发病过程,但NAFLD的发病机制尚未阐明。研究显示NAFLD发病与多元代谢紊乱有关,伴有高三酰甘油血症是其重要特点[3- 4]。过氧化物酶体增殖物激活受体(peroxisome proliferater-activated receptor,PPAR)亚型及其靶基因参与了脂质分解代谢的多个方面[5]。小分子核糖核酸对代谢途径、细胞应激、免疫防御和炎症反应发挥重要的调控作用。有研究显示NAFLD发病伴有肝脏微小RNA(microRNA,miR)- 21的表达改变[6- 9],但近期临床检测NAFLD患者血清miR- 21水平与对照组差异无统计学意义,与之前研究结论[10- 11]相反。本研究应用高脂饲料分别诱导胰岛素抵抗(insulin resistance,IR)和2型DM小鼠模型,通过检测肝脏miR- 21的表达变化,探讨其在IR和DM伴发NAFLD发病中的作用。
材料和方法
实验动物及分组8周龄雄性C57/BL6小鼠36只(购于北京维通利华实验动物技术有限公司),维持室温25℃、相对湿度60%,自由进水进食适应性喂养1周后,用随机数字表法随机分为3组:对照组、IR组和DM组,每组12只。各组动物以不同饲料喂养8周:对照组直接饲以低脂饲料(10%脂肪、35%蔗糖);IR组用高脂饲料喂养(60%脂肪、7%蔗糖);DM组高脂喂养4周后按50 mg/kg体质量一次性腹腔注射链脲佐菌素(购于美国Sigma公司,使用前溶于pH 4.5的柠檬酸缓冲液),继续高脂喂养4周。所有饲料均购于美国Research Diets,Inc.(RDI) 公司,产品货号分别为D12450B和D12492。观察小鼠进食情况和日常状态,每周测量体质量,每2周测空腹血糖。
IR和DM组小鼠模型确定各组实验小鼠喂养8周,禁食12 h后尾尖采血,用快速血糖测定仪(美国,强生)测定空腹血糖含量;进行腹腔葡萄糖耐量实验确定IR模型成功,给小鼠2.5 g/kg剂量腹腔注射50%葡萄糖,分别测定30、60和90 min血糖值;计算葡萄糖曲线下面积。血清空腹胰岛素(serum free insulin,FINS)应用罗氏电化学发光法测定,试剂采用罗氏配套试剂。按公式计算稳态模型胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=(空腹血糖× FINS)/22.5;以空腹血糖高于7.0 mmol/L纳入DM组。
生化指标的测定实验第8周后,小鼠禁食12 h后断颈处死,腹主动脉采血,离心(转子半径9.5 cm,4℃,3 000 r/min,10 min)。取血清在罗氏701全自动生化分析仪上检测FINS、三酰甘油和总胆固醇,使用罗氏配套试剂。ELISA法测定血清中肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)含量,试剂盒购于美国R&D公司。
肝脏组织病理检查将取出的新鲜肝组织用4%多聚甲醛固定,石蜡包埋切片,HE染色,光镜下观察肝脏组织形态并拍照。
miRNA和PPAR-γ等基因表达应用miRNA提取试剂盒(美国ABI 公司)提取肝脏组织miRNA,应用miR- 21特异反转录和扩增引物(均在美国ABI 公司合成)进行实验;miR- 21反转录序列5’-CTAAT-GAAGCACTGGUCACUAAUUAUAAGUUTGTCTTCGGTG-TGGAGGTAGAAAATTATA- 3’,定量PCR引物序列5’-TCAGTGCATGACAGA- 3’。使用Trizol一步法提取各组小鼠肝脏组织总RNA,逆转录合成cDNA,PPAR-γ、脂肪型脂肪酸结合蛋白2(adipocyte fatty acid binding protein 2,aP2)、PPAR-γ和GADPH的qPCR引物由上海生工生物工程技术公司合成(表1)。于ABI 公司Prism 7000荧光定量PCR仪进行扩增,反应条件:95℃ 10 min,1个循环;95℃ 15 s,60℃ 30 s,72℃ 30 s,40个循环,于72℃ 延伸10 min。扩增结束后,以限制点的循环数计算目的基因的相对表达量。
PPAR-α等蛋白表达用Western blot检测肝脏组织PPAR-α、aP2和PPAR-γ蛋白表达,取肝脏组织30 μg样本蛋白行12%SDS-聚丙烯酰胺凝胶电泳分离,水浴式恒压80V电转膜,一抗为兔抗鼠PPAR-α、aP2和PPAR-γ多克隆抗体(1∶1 000),二抗为辣根过氧化酶标记的羊抗兔IgG(1∶1 000),压片后进行放射自显影,显影定影底片,扫描保存。
统计学处理采用SPSS 11.5统计软件对数据进行分析,符合正态分布的计量资料用均数±标准差表示。正态分布变量多组间比较应用方差分析,组间差异采用t检验,不同指标间采用直线相关分析,P<0.05为差异有统计学意义。
结果
小鼠体质量及糖耐量变化4周时IR组和DM组小鼠较对照组体质量明显增加(P<0.05);IR组5~8周 体质量继续增加(P<0.01),DM组虽然继续进食高脂饲料,但体质量与对照组比较差异无统计学意义(P>0.05)(图1A)。4周时IR组和DM组空腹血糖与对照组比较差异无统计学意义(P>0.05);8周时DM组空腹血糖明显高于IR组和对照组(P<0.05)(图1B);IR组FINS和HOMA-IR较对照组明显升高(P<0.05),而DM组FINS明显降低(P<0.05)(表2);IR组和DM组葡萄糖曲线下面积 (34.73+3.11和52.43+3.87)均较对照组(22.19+3.76)明显上升(P<0.01)。
小鼠生化指标及肝脏质量IR组小鼠三酰甘油和总胆固醇较对照组明显上升(P<0.05),DM组较对照组差异无统计学意义(P>0.05);IR组和DM组血清TNF-α较对照组明显增高(P<0.05,P<0.01)。IR组和DM组肝脏组织占体质量比例较对照组明显降低(P<0.05,P<0.01)(表2)。
肝脏病理改变光镜检查对照组小鼠肝脏,汇管区中央静脉区界限清楚,未见肝细胞脂变(图2A);IR组小鼠可见不同程度弥漫性肝细胞脂肪变性,胞浆内充满大小不等脂肪空泡,以中央静脉周围明显,肝细胞肿胀,无炎症、坏死(图2B);DM组小鼠均出现较严重的弥漫性肝细胞脂肪变性,以中央静脉周围最为明显,极度肿胀呈圆形,体积较正常明显增加,胞浆内充满大量脂肪空泡,其中出现3例小叶内炎症和2例汇管区炎症,炎症细胞浸润以单核细胞、淋巴细胞为主,并有少量中性粒细胞浸润(图2C)。

表 1 PPAR-α、aP2 和 PPAR-γ定量PCR引物
PPAR:过氧化物酶体增殖物激活受体;aP2:脂肪型脂肪酸结合蛋白2
PPAR:peroxisome proliferater-activated receptor;aP2:adipocyte fatty acid binding protein 2
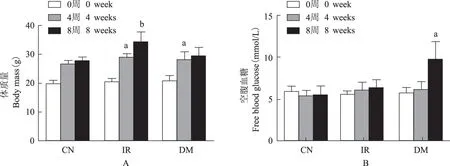
CN:对照组;IR:胰岛素抵抗组;DM:糖尿病组;与对照组比较,aP<0.05,bP<0.01
CN:control group;IR:insulin resistance group;DM:diabetes mellitus group;aP<0.05,bP<0.01 compared with control group
图 13组小鼠体质量(A)和空腹血糖(B)的比较
Fig 1Comparison of body mass (A)and free blood glucose (B)of mice among three groups

表 2 3组小鼠生化指标和肝脏占体质量比例的比较(x-±s)
CN:对照组;IR:胰岛素抵抗组;DM:糖尿病组;与对照组比较,aP<0.05,bP<0.01
CN:control group;IR:insulin resistance group;DM:diabetes mellitus group;aP<0.05,bP<0.01 compared with control group
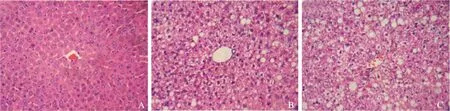
A.对照组;B.胰岛素抵抗组;C.糖尿病组
A. control group;B. insulin resistance group;C.diabetes mellitus group
图 23组小鼠肝脏病理改变(×400)
Fig 2Changes of hepatic pathology among three groups(×400)
miR- 21和PPAR-α等基因和蛋白表达变化IR组和DM组小鼠肝脏组织miR- 21表达水平较对照组明显下调(P<0.05)。IR组肝脏组织PPAR-α、aP2和PPAR-γ基因表达明显上调(P<0.01),与miR- 21表达呈负相关(r值分别为-0.696、-0.664和-0.766,P<0.05);PPAR-γ和aP2蛋白表达明显上调(P<0.05,P<0.01),而PPAR-α蛋白表达与对照组比较差异无统计学意义(P>0.05)。DM组肝脏组织PPAR-α和PPAR-γ基因表达明显上调(P<0.01),与miR- 21表达呈负相关(r值分别为-0.676和-0.550,P<0.05);而PPAR-α、aP2和PPAR-γ蛋白表达与对照组比较差异均无统计学意义(P>0.05)(图3)。

miR-21:微小RNA;Mr:相对分子质量;与对照组比较,aP<0.05,bP<0.01
miR-21:microRAN;Mr:relative molecular mass;aP<0.05,bP<0.01 compared with control group
A. 基因表达;B. 蛋白表达;C.蛋白电泳图
A. genetic expression;B. protein expression;C. protein electrophoretogram
图 3各组肝组织miR- 21和PPAR亚型基因和蛋白表达
Fig 3Expressions of miR- 21and PPAR subtype gene and protein in liver
讨论
高脂喂养小鼠4周后体质量均明显增加,IR组第8周体质量增加67.16%,远高于对照组的39.0%,DM组较对照组体质量无增加;病理学观察DM组肝细胞脂肪变性严重程度较IR组明显增加;DM组和IR组肝脏组织占体质量比例较对照组显著降低;以上结果均提示在8周造模时间内DM伴发NAFLD较IR严重。NAFLD的发病基础是肝细胞内三酰甘油聚集,有研究表明NAFLD患者总胆固醇和三酰甘油含量均明显增加,高密度脂蛋白胆固醇降低,尤其是三酰甘油水平增加者达49.24%,远高于胆固醇含量升高者17.93%[3- 4],提示NAFLD发病与血清中三酰甘油水平上升有直接关系。本研究IR组小鼠血清三酰甘油和总胆固醇均明显上升,是高脂诱导NAFLD发病的必然结果;本研究观察到DM较IR组伴发更严重的NAFLD,TNF-α水平明显增加,肝脏病理中一半病例有肝组织炎症细胞浸润,也符合肝脏脂肪变性伴发肝小叶炎症反应的特点。
有研究证实miR- 21表达改变与NAFLD相关。由Li等[6]研究显示肥胖伴NAFLD小鼠肝脏miR- 21表达下调,而直接注射链脲佐菌素复制1型DM时尽管血糖显著上升,不伴有NAFLD时,肝脏miR- 21表达无改变。Ahn等[10]观察高脂喂养老鼠的肝脏和用硬脂酸干预的Hepa1- 6细胞中miR- 21的表达均减少,miR- 21 表达改变明显阻止了硬脂酸诱导的细胞内脂质积累。有研究调查NAFLD体内和体外模型的miR- 21表达变化,结果显示在NAFLD患者的血清miR- 21水平减低;HepG2细胞培养基中加入软脂酸和油酸,模仿游离脂肪酸毒性、脂肪变性疾病的发生时细胞培养环境,数据显示在NAFLD的体外模型miR- 21也减少,与其体内实验结果一致[11]。Yamada等[12]检测92例NAFLD患者血清微小RNA的表达显示:miR- 21 水平较健康对照组升高,按照性别分析结果揭示:男性患者血清miR-21水平上升,而女性无差异;也有结果相反的报道,检测34例NAFLD患者血清miR- 21水平无改变[13]。小分子核糖核酸是一类新发现的监管RNA信使,可绑定核糖核酸3’端区域发挥沉默RNA作用。miR- 21参与NAFLD发病的具体机制尚不清楚。
PPAR-α和PPAR-γ及其靶基因参与NAFLD脂代谢紊乱[5,10],NAFLD小鼠模型给予PPAR-α激动剂可以减少肝脏脂肪变性[7]。研究显示给HuH7细胞超表达和抑制miR- 21或miR- 27b 发现,PPAR-α蛋白质含量增加,但不影响PPAR-α的mRNA水平。荧光素酶分析显示miR- 21的靶点是PPAR-α的3’端地区。在人类肝脏,PPAR-α蛋白质与mRNA表达不直接相关,但与miR- 21水平呈负相关性,表明miR- 21对PPAR-α产生重大影响,其中不能排除miR- 27b的贡献[14]。本研究显示IR伴发NAFLD的肝组织miR- 21表达明显下调,与PPAR-α、aP2和PPAR-γ基因表达上调呈负相关;DM伴发更严重NAFLD时肝组织中miR- 21表达进一步下调,与PPAR-α和PPAR-γ基因表达上调呈负相关;证实在NAFLD的肝组织中miR- 21对PPAR-γ基因表达也有调节作用,丰富了NAFLD的发病机制。另有报道miRNA依赖性的影响PPAR-α下游基因的表达,miR- 21通过控制其下游目标脂肪酸结合蛋白7参与肝脏脂肪变性[10]。也有报道miR- 21监管三酰甘油和胆固醇的代谢,可通过抑制三羟基三甲基辅酶A还原酶的表达实现[11]。可见miR- 21通过调节脂代谢的多个环节,参与NAFLD的发病。
核转录因子κB是炎性细胞因子调节的核转录因子,研究证实,核转录因子-κB上调miR- 21前体转录,在肝脏再生的早期阶段miR- 21表达上调;miR- 21的靶目标Peli1 可能提供一个负面反馈循环调节核转录因子-κB信号[15]。本研究显示IR或DM伴发NAFLD时,miR- 21表达改变与TNF-α呈负相关,推测NAFLD发病时miR- 21表达与参与调节TNF-α的生成,有待于进一步研究证实。有研究尝试给肥胖鼠应用抗miR- 21治疗,研究显示安全有效,心脏功能不受影响,也无肝毒性;此外,miR- 21抑制脂肪细胞变小,血清三酰甘油水平显著降低,可以有效减轻肥胖鼠体质量[16]。
综上,IR和DM小鼠诱导NAFLD均出现miR- 21表达降低,可能通过调节PPAR亚型表达参与NAFLD发病。miR- 21是一个有用的诊断和治疗NAFLD的生物标志物,未来可以进行更大样本的临床研究加以确定。
参考文献
[1]Ballestri S,Lonardo A,Bonapace S,et al. Risk of cardiovascular,cardiac and arrhythmic complications in patients with non-alcoholic fatty liver disease[J].World J Gastroenterol,2014,20(7):1724- 1745.
[2]Oni ET,Agatston AS,Blaha MJ,et al. A systematic review:burden and severity of subclinical cardiovascular disease among those with nonalcoholic fatty liver;should we care?[J].Atherosclerosis,2013,230(2):258- 267.
[3]赵晓云,陈伟华,路永刚,等. 河北省33843机关职员非酒精性脂肪肝患病率及其危险因素[J]. 中国老年学杂志,2013,33(20):5079- 5081.
[4]范建高,朱军,李新建,等.上海市成人非酒精性脂肪肝患病率及其危险因素流行病学调查[J].中华肝脏病杂志,2005,13(2):83- 88.
[5]Kohjima M,Enjoji M,Higuchi N,et al. Re-evaluation of fatty acid metabolism-related gene expression in nonalcoholic fatty liver disease[J]. Int J Mol Med,2007,20(3):351- 358.
[6]Li S,Chen X,Zhang H,et al. Differential expression of microRNAs in mouse liver under aberrant energy metabolic status[J].J Lipid Res,2009,50(9):1756- 1765.
[7]Cheung O,Puri P,Eicken C,et al. Nonalcoholic steatohepatitis is associated with altered hepatic microRNA expre-ssion[J]. Hepatology,2008,48(6):1810- 1820.
[8]Jin X,Ye YF,Chen SH,et al. MicroRNA expression pattern in different stages of nonalcoholic fatty liver disease[J]. Dig Liver Dis,2009,41(4):289- 297.
[9]Pogribny IP,Starlard-Davenport A,Tryndyak VP,et al. Difference in expression of hepatic microRNAs miR-29c,miR- 34a,miR- 155,and miR- 200b is associated with strain-specifi susceptibility to dietary nonalcoholic steatohepatitis in mice[J]. Lab Invest,2010,90(10):1437- 1446.
[10]Ahn J,Lee H,Jung CH,et al. Lycopene inhibits hepatic steatosis via microRNA-21-induced downregulation of fatty acid-binding protein 7 in mice fed a high-fat diet[J]. Mol Nutr Food Res,2012,56(11):1665- 1674.
[11]Sun C,Huang F,Liu X,et al. miR- 21 regulates triglyceride and cholesterol metabolism in non-alcoholic fatty liver disease by targeting HMGCR[J].Int J Mol Med,2015,35(3):847- 853.
[12]Yamada H,Suzuki K,Ichino N,et al. Associations between circulating microRNAs (miR- 21,miR- 34a,miR- 122 and miR- 451) and non-alcoholic fatty liver[J].Clinica Chimica Acta,2013,424:99- 103.
[13]Cermelli S,Ruggieri A,Marrero JA,et al. Circulating microRNAs in patients with chronic hepatitis C and non-alcoholic fatty liver disease[J]. PLoS One,2011,6(8):1- 8.
[14]Kida K,Nakajima M,Mohri T,et al. PPARα is regulated by miR- 21 and miR- 27b in human liver[J]. Pharm Res,2011,28(10):2467- 2476.
[15]Marquez RT,Wendlandt E,Galle CS,et al. MicroRNA- 21 is upregulated during the proliferative phase of liver regeneration,targets Pellino- 1,and inhibits NF-kappaB signaling[J].Am J Physiol Gastrointest Liver Physiol,2010,298(4):G535-G541.
[16]Seeger T,Fischer A,Muhly-Reinholz M,et al. Long-term inhibition of miR- 21 leads to reduction of obesity in db/db mice[J].Obesity,2014,22(11):2352- 2360.
Roles of MicroRNA- 21 in the Pathogenesis of Insulin Resistance and Diabetic Mellitus-induced Non-alcoholic Fatty Liver Disease
ZHAO Xiao-yun,SHAO Kai
Laboratory Medicine Center of Qilu Hospital(Qingdao),Shandong University,Qingdao,Shandong 266000,China
ABSTRACT:ObjectiveTo investigate the roles of microRNA- 21 (miR- 21) in the pathogenesis of non-alcoholic fatty liver disease (NAFLD) with high-fat diet-induced insulin resistance (IR) and diabetes mellitus (DM) mice model. MethodsEight-week-old C57BL/6 mice were allocated into control group,IR group,and DM group. Body mass was recorded. Intraperitoneal glucose tolerance test was performed to determine any abnormal glucose metabolism. The liver pathological changes were detected by biopsy. Changes in free blood glucose,free serum insulin,blood fat and tumor necrosis factor α level were measured. Differences in miR- 21 expression and peroxidase proliferator-activated receptor subtypes (PPAR-γ and PPAR-α) and adipocyte fatty acid binding protein (aP2) in the liver were detected both at the mRNA and protein levels. ResultsAfter one 8-week high-fat diet,the body mass,free serum insulin,and homeostasis model IR index significantly increased in the IR group (P<0.01,P<0.05,compared with control group),while the free blood glucose increased and the free serum insulin decreased in DM group(P<0.05). Free serum insulin level were significantly increased in IR group (P<0.05). Serum tumor necrosis factor-α levels exhibited an upward trend in control group,IR group,and DM group (P<0.05,P<0.01). With exacerbation in NAFLD,liver miR- 21 expression level went further down in both IR and DM groups (P<0.05). The downregulated miR- 21 expression level showed negative correlation with upregulated PPAR-α,αP2,and PPAR-γ genetic expression (r=-0.696,r=-0.664,and r=-0.766,respectively;P<0.05) in IR group and with upregulated PPAR-α and PPAR-γ genetic expression in DM group (r=-0.676 and r=-0.550,respectively;P<0.05). In terms of the changes in protein expression level,only on the protein expressions of aP2 and PPAR-γ in IR group showed significant change (P<0.05,P<0.01,compared with control group). ConclusionsThe miR- 21 expression is downregulated in both IR and DM-induced NAFLD mice. It may be involved in the pathogenesis of NAFLD by regulating the expressions of PPAR subtypes.
Key words:non-alcoholic fatty liver disease;microRNA- 21;insulin resistance;diabetes mellitus;peroxisome proliferator-activated receptor subtypes
(收稿日期:2015- 05- 07)
Corresponding author:ZHAO Xiao-yunTel:0532- 66850879,E-mail:welcomedoctor@126.com
DOI:10.3881/j.issn.1000- 503X.2016.02.004
中图分类号:R587.1
文献标志码:A
文章编号:1000- 503X(2016)02- 0144- 06
通信作者:赵晓云电话:0532- 66850879,电子邮件:welcomedoctor@126.com

