人脐带间充质干细胞分泌白介素- 6对白血病细胞分化的影响
陈 芳,马凤霞,李 洋,徐方运,池 颖,卢士红,韩忠朝
中国医学科学院 北京协和医学院 血液学研究所 血液病医院实验血液学国家重点实验室,天津 300020
·论著·
人脐带间充质干细胞分泌白介素- 6对白血病细胞分化的影响
陈芳,马凤霞,李洋,徐方运,池颖,卢士红,韩忠朝
中国医学科学院北京协和医学院血液学研究所血液病医院实验血液学国家重点实验室,天津 300020
摘要:目的探讨脐带来源的间充质干细胞(UC-MSC)对白血病细胞分化的影响。方法体外建立UC-MSC与急性早幼粒细胞白血病细胞系NB4细胞共培养体系,通过细胞形态、硝基四唑氮蓝还原实验和细胞表面粒系分化标志CD11b的检测,评价肿瘤细胞的分化状态。结果UC-MSC在体外能够诱导NB4细胞向粒系分化成熟并和小剂量全反式维甲酸共同应用时存在诱导作用联合增强。白介素(IL)- 6Ra中和阻断IL- 6作用后可部分逆转UC-MSC的促分化作用,外源性IL- 6对NB4细胞发挥促粒系分化作用。结论UC-MSC通过分泌IL- 6可以诱导急性早幼粒细胞白血病细胞向粒系分化成熟,且和小剂量全反式维甲酸同时应用可以达到诱导分化作用联合增强。
关键词:间充质干细胞;急性早幼粒细胞白血病;NB4;分化;白介素- 6
ActaAcadMedSin,2016,38(2):164-168
由于间充质干细胞(mesenchymal stem cells,MSC)是人体微环境的重要组成部分,且在体外易于扩增培养,它潜在的应用价值近年来一直是研究的热点。研究表明MSC在组织损伤[1]、自身免疫病[2]、移植物抗宿主病[3]等疾病中的应用可以获得较好的效果。迄今为止,对于MSC在肿瘤性疾病中的作用却存在较大的争议。有学者研究了MSC对血液来源及非血液来源的肿瘤细胞增殖和凋亡的影响,结果仍是尚无定论[4- 5]。既往研究显示MSC在体内和体外都可以促进正常的造血干祖细胞向髓系细胞和淋巴系细胞分化[6- 7]。研究显示,MSC在体外能够促进HL- 60细胞分化,但作用机制不明[8]。HL- 60细胞来源于急性髓系白血病M2亚型,而临床上唯一进行诱导分化治疗的白血病为M3亚型,即急性早幼粒细胞白血病[9]。本研究采用人脐带来源的MSC(umbilical cord-derived mesenchymal stem cells,UC-MSC)和急性早幼粒细胞白血病细胞系NB4细胞探讨MSC对其分化的影响及其机制。
材料和方法
材料全反式维甲酸(all-trans retinoic acid,ATRA)、硝基四唑氮蓝(nitroblue tetrazolium,NBT)、佛波酯从Sigma-Aldrich公司购买;PE标记的CD11b和CD14抗体从BD公司购买;白介素(interleukin,IL)- 6Ra的中和抗体从R&D公司购买;重组人IL- 6从 Peprotech公司购买。
UC-MSC的分离培养及白血病细胞的培养UC-MSC知情同意后从妇产医院分娩附属组织脐带中获取,分离、体外扩增及鉴定同文献[10]。NB4细胞系为本实验室液氮冻存,复苏后用含有10%胎牛血清,双抗(青霉素100 IU/ml、链霉素100 μg/ml)的RPMI 1640培养基培养。共培养体系在6孔板中建立,共分4个组:NB4单独培养组;NB4+UC-MSC组;NB4+10 nmol ATRA组;NB4+UC-MSC+10 nmol ATRA组。UC-MSC增殖达到80%融合状态时给予30 Gy剂量铯源照射,其后NB4细胞以105/ml浓度接种。
NB4细胞的分化状态鉴定通过细胞形态、NBT还原实验及细胞表面分化抗原CD11b和CD14的检测评价NB4细胞的分化状态。甩片机(cytospin 4)将2×105个NB4细胞甩至载玻片上,瑞氏-吉姆萨染色,取2×105个HL- 60细胞于cytospin 4细胞离心涂片机(thermo)甩片,待玻片自然晾干后滴加瑞氏-吉姆萨染色20 min,流水冲洗1 min,在光学显微镜下观察细胞形态并照相;通过NBT还原实验对细胞内过氧化物生成情况进行评价,2×105个NB4细胞悬于0.5 ml PBS中,加入NBT溶液(1 mg/ml)和佛波酯(200 ng/ml)37℃作用60 min,取细胞悬液涂片,番红-O染色,随机计数200个细胞中含有蓝紫色斑的阳性细胞,计算阳性比例;培养48 h后,采用流式细胞术对膜表面分化标志CD11b 和 CD14进行定量,每个检测管细胞量大约5×105个,用PBS洗1次,加入荧光标记CD11b抗体或CD14及其同型对照抗体,置4℃标记45 min,PBS洗1次;上LSRⅡ流式细胞仪(美国BD公司)检测。
细胞周期分析NB4细胞以1×105/ml浓度培养于6孔板中,48 h后收集细胞。70%浓度冷乙醇固定24 h后加入50 μg/ml RNA酶 A 37℃孵育30 min,最后加入50 mg/ml碘化丙啶染色后,流式细胞术检测碘化丙啶荧光强度。利用MODFIT软件分析细胞周期。
Transwell实验在6孔板中进行,0.4 μm孔径的隔膜将培养孔分为上下两个小室,UC-MSC培养于下室,30 Gy照射UC-MSC后,上室加入5×105个NB4细胞。培养48 h后,收集肿瘤细胞,流式细胞术检测膜表面CD11b的阳性率。
ELISA检测IL- 6浓度收集无细胞培养上清-80℃保存。人IL- 6检测ELISA试剂盒从Neobioscience公司购买,按照试剂盒说明书步骤进行操作。
统计学处理采用SPSS 16.0软件进行统计学分析。每个实验重复3~5次,其中ELISA检测各研究组设两个平行孔(即复孔),其余实验均为单孔。以至少3次重复实验结果进行统计学分析。单因素方差(One-Way ANOVA)分析方法比较各实验组数据。P<0.05为差异具有统计学意义。
结果
UC-MSC促进NB4细胞向粒系分化成熟细胞培养72 h后,观察细胞形态改变并进行NBT还原实验,培养48 h检测CD11b和CD14的表达,结果显示NB4+UC-MSC组的肿瘤细胞出现分化迹象,NB4+UC-MSC+ATRA组的细胞呈现更加成熟的形态,杆状核细胞增多,甚至偶有分叶核粒细胞;NBT还原实验中,UC-MSC及ATRA分别可以产生少量阳性反应细胞,当二者同时作用时,NBT阳性反应的细胞明显增多(图1)。与对照组CD11b基础表达(4.35±2.29)%相比,UC-MSC上调NB4细胞表面CD11b表达至(30.70±1.97)%(P=0.001),两者同时应用上调CD11b阳性率为(65.50±9.02)%,显著高于ATRA单独应用组(38.03±8.67)% (P=0.001)。而CD14的阳性率一直低于3%,因此NB4细胞是向粒细胞分化,而不是向单核细胞分化。
UC-MSC促使NB4细胞周期出现G0/G1期阻滞细胞培养48 h后进行细胞周期检测分析显示,UC-MSC和ATRA分别使G0/G1期细胞所占比例增高,当两者同时应用时,G0/G1期细胞比例相对更为增高。在NB4细胞G0/G1细胞周期阻滞的同时,伴有S期细胞比例的降低,G2/M期细胞比例变化无明显趋势(图2)。
UC-MSC通过分泌可溶性因子发挥促进NB4细胞分化的作用为了明确UC-MSC是通过可溶性细胞因子还是细胞直接接触发挥作用的,进行Transwell实验,UC-MSC培养在下层小室,NB4细胞培养在上层小室。细胞共培养48 h后,NB4+UC-MSC直接接触组阳性率为(29.35±2.21)%,Transwell组阳性率为(26.35±6.57)% (P=0.614);NB4+UC-MSC+ATRA直接接触组阳性率为(67.18±10.77)%,Transwell组阳性率为(65.23±10.18)% (P=0.742)。Transwell组的UC-MSC可以有效上调CD11b的表达,与对照组比较差异无统计学意义。
UC-MSC通过分泌IL- 6诱导NB4细胞分化ELISA测定共培养上清中的粒系集落刺激因子(granulocyte-colony stimulating factor,G-CSF)、前列腺素E2(prostaglandin E2,PGE2)和IL- 6因子浓度均有显著升高。然而,使用 G-CSF 中和抗体或吲哚美辛阻断 PGE2 的合成,并不能减弱 CD11b 的表达。将50 μg/ml的IL- 6Ra中和抗体加入共培养体系阻断IL- 6与其受体结合,48 h后检测CD11b表达情况,结果显示IL- 6Ra中和抗体可以减弱CD11b的上调(图3A)。在培养体系中加入外源性重组人IL- 6 (50 ng/ml),48 h后再次检测CD11b阳性率,IL- 6明显上调分化抗原CD11b的表达 (图3B),并使NB4细胞形态学上出现分化特征(图3C)。由于共培养体系中IL- 6浓度上调,阻断IL- 6作用可以逆转分化抗原的表达,外源性IL- 6上调分化抗原的表达。

UC-MSC:脐带间充质干细胞;ATRA:全反式维甲酸
UC-MSC:umbilical cord-derived mesenchymal stem cells;ATRA:all-trans retinoic acid
A. 共培养72 h后瑞氏-吉姆萨染色;B. 共培养72 h后硝基四唑氮蓝还原实验
A. Wright-Giemsa staining after 72 hours of co-culture;B. nitrablue tetrazolium reduction test after 72 hours of co-culture
图 1UC-MSC与NB4细胞共培养后检测NB4细胞分化状态
Fig 1Evaluation of the differentiation status of NB4 cells after co-culture with UC-MSC
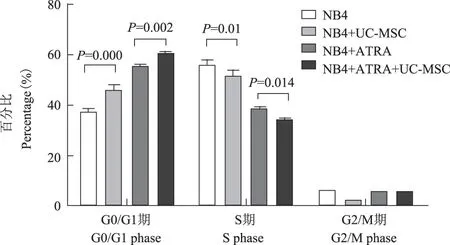
图 2UC-MSC与NB4细胞共培养后,细胞周期变化
Fig 2Cell cycle analysis of NB4 cells after co-culture with UC-MSC

IL- 6:白介素- 6
IL- 6:interleukin- 6
A. 共培养体系中加入IL- 6Ra,48 h后检测CD11b的表达;B. NB4细胞单独培养体系中加入外源性重组IL- 6,48 h后检测 CD11b表达;C. NB4细胞单独培养体系中加入外源性重组IL- 6,48 h后瑞氏-吉姆萨染色
A. CD11b detection when the IL- 6Ra was added to the co-culture system for 48 hours;B. CD11b analysis of NB4 cells when they were treated with exogenous recombinant IL- 6 for 48 hours;C. Wright-Giemsa staining of NB4 cells when they were treated with exogenous recombinant IL- 6 for 48 hours
图 3IL- 6介导UC-MSC诱导NB4细胞分化的作用
Fig 3Differentiation induction of NB4 cells by UC-MSC is mediated by IL- 6
讨论
研究显示间充质干细胞在多种疾病中具有治疗潜力和应用前景,尤其是组织损伤和免疫紊乱相关疾病。然而,其在恶性肿瘤中的作用存在很大争议,近年来的相关文献主要报道了MSC对肿瘤细胞增殖和凋亡的影响[4- 5],研究结果也不尽一致。
本研究显示脐带来源的间充质干细胞可以在体外诱导急性早幼粒细胞白血病细胞系NB4细胞向粒系终末分化,并且和小剂量的ATRA同时应用,作用联合增强。UC-MSC在诱导分化的同时,导致细胞出现G0/G1细胞周期阻滞现象,这是与ATRA的作用机制存在的共同点[11]。
本研究显示共培养体系中IL- 6浓度上调,阻断IL- 6作用可以逆转分化抗原的表达,外源性IL- 6上调分化抗原的表达,表明IL- 6介导UC-MSC对NB4细胞的诱导分化作用。IL- 6Ra中和抗体部分逆转了UC-MSC上调CD11b的效应,但并没有完全逆转。原因可能是IL- 6Ra中和抗体并不能完全阻断IL- 6的作用,也可能IL- 6不是发挥作用的唯一因子,也许还有其他的某些可溶性因子同时发挥作用。文献报道,G-CSF[12- 13]和PGE2[14]可以增强ATRA诱导的早幼粒白血病细胞的分化作用。本研究同时对这两种因子进行了检测并分析,结果显示G-CSF和PGE2并不参与介导UC-MSC的诱导分化作用。
综上,本研究显示UC-MSC可以诱导急性早幼粒白血病细胞向粒系终末分化,并且和小剂量的ATRA同时应用时,作用联合增强。本研究不仅从细胞分化的角度进一步阐明了MSC与肿瘤细胞的相互作用,并且为MSC的潜在应用价值提供了理论依据。
参考文献
[1]Kadiyala S,Young RG,Thiede MA,et al. Culture expanded canine mesenchymal stem cells possess osteochondrogenic potentialinvivoandinvitro[J]. Cell Transplant,1997,6(2):125- 134.
[2]Zappia E,Casazza S,Pedemonte E,et al. Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T-cell anergy[J]. Blood,2005,106(5):1755- 1761.
[3]Le Blanc K,Rasmusson I,Sundberg B,et al. Treatment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells[J]. Lancet,2004,363(9419):1439- 1441.
[4]Ramasamy R,Lam EW,Soeiro I,et al. Mesenchymal stem cells inhibit proliferation and apoptosis of tumor cells:impact oninvivotumor growth[J]. Leukemia,2007,21(2):304- 310.
[5]Yu JM,Jun ES,Bae YC,et al. Mesenchymal stem cells derived from human adipose tissues favor tumor cell growthinvivo[J]. Stem Cells Dev,2008,17(3):463- 473.
[6]Angelopoulou M,Novelli E,Grove JE,et al. Cotransplantation of human mesenchymal stem cells enhances human myelopoiesis and megakaryocytopoiesis in NOD/SCID mice[J]. Exp Hematol,2003,31(5):413- 420.
[7]Briquet A,Dubois S,Bekaert S,et al. Prolongedexvivoculture of human bone marrow mesenchymal stem cells influences their supportive activity toward NOD/SCID-repopulating cells and committed progenitor cells of B lymphoid and myeloid lineages[J]. Haematologica,2010,95(1):47- 56.
[8]吴昊,马凤霞,李建平,等. 人脐带间充质干细胞增强全反式维甲酸对HL- 60细胞的诱导分化作用[J]. 中国实验血液学杂志,2010,18(4):877- 881.
[9]Lanotte M,Martin-Thouvenin V,Najman S,et al. NB4,a maturation inducible cell line with t(15;17) marker isolated from a human acute promyelocytic leukemia (M3) [J]. Blood,1991,77(5):1080- 1086.
[10]Lu LL,Liu YJ,Yang SG,et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials [J]. Haematologica,2006,91(8):1017- 1026.
[11]Degos L,Wang ZY. All trans retinoic acid in acute promyelocytic leukemia[J]. Oncogene,2001,20(49):7140- 7145.
[12]Imaizumi M,Sato A,Koizumi Y,et al. Potentiated maturation with a high proliferating activity of acute promyelocytic leukemia inducedinvitroby granulocyte or granulocyte/macrophage colony-stimulating factors in combination with all-trans retinoic acid[J]. Leukemia,1994,8(8):1301- 1308.
[13]Maun NA,Gaines P,Khanna-Gupta A,et al. G-CSF signaling can differentiate promyelocytes expressing a defective retinoic acid receptor:evidence for divergent pathways regulating neutrophil differentiation[J]. Blood,2004,103(5):1693- 1701.
[14]Rocca B,Morosetti R,Habib A,et al. Cyclooxygenase- 1,but not- 2,is upregulated in NB4 leukemic cells and human primary promyelocytic blasts during differentiation[J]. Leukemia,2004,18(8):1373- 1379.
Human Umbilical Cord-derived Mesenchymal Stem Cells Secrete Interleukin- 6 to Influence Differentiation of Leukemic Cells
CHEN Fang,MA Feng-xia,LI Yang,XU Fang-yun,CHI Ying,LU Shi-hong,HAN Zhong-chao
State Key Laboratory of Experimental Hematology,Institute of Hematology and Hospital of Blood Diseases,CAMS and PUMC,Tianjin 300020,China
ABSTRACT:ObjectiveTo investigate the effect of human umbilical cord-derived mesenchymal stem cells (UC-MSC) on the differentiation of leukemic cells. MethodThe co-culture system of UC-MSC with acute promyelocytic leukemic cell line NB4 cells was constructed in vitro,and the differentiation status of the leukemic cells was assessed by cell morphology,nitroblue tetrazolium reduction test,and cell surface differentiation marker CD11b. ResultsUC-MSC induced the granulocytic differentiation of NB4 cells. When UC-MSC and a small dose of all-trans retinoic acid were applied together,the differentiation-inducing effect was enhanced in an additive manner. Interleukin (IL)- 6Ra neutralization attenuated differentiation and exogenous IL- 6-induced differentiation of leukemic cells. ConclusionUC-MSC can promotd granulocytic differentiation of acute promyelocytic leukemia cells by way of IL- 6 and presented additive effect when combined with a small dose of all-trans retinoic acid.
Key words:mesnchymal stem cells;acute promyelocytic leukemia;NB4;differentiation;interleukin- 6
(收稿日期:2015- 04- 23)
Corresponding author:HAN Zhong-chaoTel:022- 23909186,E-mail:hanzhongchao@hotmail.com
DOI:10.3881/j.issn.1000- 503X.2016.02.007
中图分类号:R557+.2
文献标志码:A
文章编号:1000- 503X(2016)02- 0164- 05
通信作者:韩忠朝电话:022- 23909186,电子邮件:hanzhongchao@hotmail.com
基金项目:国家重点基础研究发展计划(973计划)(2011CB964802)、国家自然科学基金 (81500098)和国家科技支撑计划 (2013BAI01B09) Supported by the National Basic Research Program of China (973 Program) (2011CB964802),National Natural Sciences Foundation of China (81500098),and National Key Technology R&D Program(2013BAI01B09)

