制备、纯化和鉴定生物活性肽的研究进展及应用
刘铭,刘玉环*,王允圃,阮榕生,樊亮亮,邹慧芳,涂春明
1(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047) 2( 南昌大学 生物质教育部工程研究中心,江西 南昌,330047) 3(明尼苏达大学 生物制品与生态工程系,美国 明尼苏达,55108)
制备、纯化和鉴定生物活性肽的研究进展及应用
刘铭1,2,刘玉环1,2*,王允圃1,2,阮榕生3,樊亮亮1,2,邹慧芳1,2,涂春明1,2
1(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047) 2( 南昌大学 生物质教育部工程研究中心,江西 南昌,330047) 3(明尼苏达大学 生物制品与生态工程系,美国 明尼苏达,55108)
摘要近年来,分离纯化以及鉴定技术的发展加速了生物活性肽的研究进程。生物活性肽被定义为具有生物活性,诸如抗氧化、降血压、抗血栓、减脂、抑菌和抗炎症功效等的,由2~20个氨基酸组成的特定肽类的总称。低毒和高特异性的特点使生物活性肽在食品和医药行业有着独特应用价值。文中重点综述了生物活性肽的制备,特别是微生物发酵和酶水解,并分析了各种技术手段的联用和辅助手段的运用。为了确定表征生物活性肽的主要方法,对分离、纯化和鉴定的方法进行了总结。最后,还对商业化应用中面临的挑战进行了分析。
关键词生物活性肽;纯化;鉴定;应用挑战
蛋白质是人体必需的营养成分之一,是对于人体生长和维持正常生理代谢必不可少的必需氨基酸的来源,同时也是机体能量的来源。蛋白质能够影响食品的物理化学和感官特性,例如溶解性、黏性、凝胶性和乳化稳定性。蛋白质所具有的特定的生物学特性使其成为某些功能性食品的成分之一。在体内消化系统的作用下,蛋白质水解产生了多种具有不同功能的生物活性肽。其中具有某些特定结构的肽能与生物体内的内源性生物活性肽相互作用。这些内源性生物活性肽具有重要的功能,主要包括体内一些重要内分泌腺分泌的肽类激素,如促生长激素释放激素、促甲状腺素、胸腺分泌的胸腺肽等[1]。
生物活性肽可从动植物蛋白中获得。植物蛋白来源主要是谷物,比如大豆、小麦、大米、燕麦和黑麦。其中,研究最广泛的是大豆蛋白源生物活性肽,因为大豆是日常膳食中蛋白的重要来源,也是世界各国重要的经济作物。而动物蛋白来源的研究也越来越多,其研究重点在肉类蛋白水解液的制备,水解液在保持生物学活性的同时也是矿物质和维生素的重要来源,还能被用作增味剂和乳化剂[2]。国内主要是孙宝国院士在这方面做了大量研究并首次提出了“味食同源”的观点,开发出含硫肉味香精等多种食品香精香料。鸡蛋和鱼类蛋白水解制备的生物活性肽也成为了研究热点[3]。
近年来,研究发现了心血管疾病、肥胖、高血压、糖尿病和癌症的发生和日常饮食息息相关。食疗的观念逐渐深入人心,这大大开拓了功能性食品的市场。功能性食品是在食品本身基本的营养功能之外,能够提供特定营养保健功能,调节一种或多种身体功能的食品[4]。
为了确定生物活性肽的来源,研究了蛋白水解物和产生的步骤。MELLANDER等[5]首次发现佝偻病新生儿对酪蛋白水解制备得到生物活性肽的摄入提高了骨骼的钙化。之后,各种具有生物活性的肽类的制备和它们结构鉴定层出不穷。在Biopep肽库中,已经记录了超过1 200种具有不同生物活性的肽段[6]。
1生物活性肽概述
生物活性肽被定义为具有生物活性,诸如抗氧化、降血压、抗血栓、减脂,抑菌和抗炎症功效等的特定肽类的总称。这些肽有2~20个氨基酸,分子质量小于6 000 Da,生物活性主要由氨基酸的组成和氨基酸顺序决定[7]。生物活性肽的功能性一直是现代食品科技领域研究的前沿热点,已发现这些肽可以替代某些药物和充当食品防腐剂[8-9]。
按照UHLIG等[9]的研究,生物活性肽在制药领域有良好的应用前景。在制药的研制过程中,一些肽对于治疗心血管疾病、传染性疾病和新陈代谢疾病都有良好的作用。这些肽类对于传统药物具有很强的竞争优势,主要有以下几点:它们对于特定组织的特异性极佳,而且在剂量很低的情况下也有效;化学合成药物在人体器官中会发生富集,而生物活性肽本身就存在于体内并能正常代谢、利用和排泄。
抗菌肽作为一类特殊的生物活性肽被用作天然食品防腐剂,其机制主要是抗菌肽能够与细胞膜表面相互作用,使膜的通透性改变,继而打破原有的渗透压平衡,导致细菌细胞内容物外流,细菌细胞死亡[10-11]。此外,生物活性肽还能与多糖和其他类化合物进行协同作用,如冬虫夏草中的生物活性肽能和多糖、甾醇类化合物等协同提高机体的免疫力[12]。而阿胶中生物活性肽和多糖协同作用提高机体造血能力,单独的生物活性肽作用效果却并不理想[13]。
生产生物活性肽的工艺可以分为以下几个步骤:(1)寻找合适的蛋白来源。(2)通过蛋白源本身含有的蛋白酶,商业酶制剂和发酵来水解蛋白产生生物活性肽。(3)得到的粗酶解物进行分离纯化得到单一的肽。(4)鉴定提纯出的肽的氨基酸顺序并化学合成肽的纯净物进行生物活性的实验测定,最普遍是小鼠实验。生物活性肽的提取和鉴定步骤可以用图1进行表示。

图1 生物活性肽制备的主要步骤Fig.1 Major processes for obtaining bioactive peptides
在发酵中,主要是发酵乳制品的生产中,能够水解蛋白的乳酸菌的加入形成了生物活性肽。在发酵过程中,蛋白逐渐被酶水解,一些生物活性肽逐渐释放出来。在特定水解步骤使用植物蛋白或者微生物水解蛋白酶,减少了致敏的可能性,提高了消化性,形成了生物活性肽[14]。还有研究表明乳酸菌和酶的联用可以比单一方法、发酵或酶解,产生更多生物活性产物。各种方法的联用和发酵产品中多肽的增加,引起了许多生物活性和功能性的变化[15]。CHEN等[16]按此方法提高了牛乳制备的生物活性肽的血管紧张素转换酶(ACE)抑制的活性。
除了上面提到的常见方法之外,多种其他方法的联用对生物活性肽的制备也具有良好效果。超滤和纳滤是分离和纯化生物活性多肽典型手段,根据分子的大小分离具有特定功效的生物活性肽。掌握这些方法及工艺参数对于蛋白水解产生特定功能的肽至关重要。这些参数既包含蛋白源和特性、化学结构、pH、季节性波动、酶的制备和纯度、基质特异性和比活度,也包含能够保持酶活及其稳定性的pH和温度、操作条件,如酶和底物的浓度、温度和作用时间等[17]。此外,多种酶的联用及其使用次序也需要具体研究。
2生物活性肽制备的主要步骤
生物活性肽可以直接存在于某些食品中,特别是发酵食品,但大多数生物活性肽存在于食物如牛奶、鸡蛋、肉、鱼、大豆、小麦等蛋白序列中,只有在某种条件下如体内胃肠道酶、食品发酵、水解等释放出活性片段后才表现出生理活性。
目前生物活性肽制备可从2个方向进行。通过发酵、酶解等方法把蛋白质水解到一定的程度,使水解液中含有一定量的生物活性肽。由于生物活性肽在含量很低时也有很好的活性作用,使得混合酶解物也具有相当的生物活性。而对于已知氨基酸序列的生物活性肽还可采取定向合成法,包括化学合成,酶法合成和DNA重组技术等。
对于生产应用而言,定向合成法由于在生产设备上投入巨大以及产能不足,在实际生产中开展有诸多限制。因而主要还是通过在发酵和酶解过程控制工艺生产参数,使得每个批次的产品在各方面的功能特性指标都具有一致性,可重复生产出需要的产品。
2.1发酵
发酵是生产生物活性肽和食品级水解蛋白的有效方式。在国外,发酵被应用于生产生物活性肽主要和乳制品的生产有关。乳制品本身就富含能够生产生物活性肽的前体蛋白。乳酸菌是在自然界和人体消化系统中十分常见的有益菌。它的蛋白质水解系统非常复杂且包含3种主要成分:附着于细胞壁上能够提高牛乳中酪蛋白水解成寡肽的蛋白酶;能够转运寡肽到细胞质的特殊转运蛋白;最后能够把寡肽进一步水解成小肽或者游离氨基酸且存在于细胞内的肽酶[18]。乳酸菌的发酵还能显著增强发酵制品的营养特性,风味特性和加工性质[19]。这些微生物具有极强的蛋白酶生产能力,能够制备生物活性肽并在发酵过程中逐渐释放出来。国内外有较多关于这些微生物的研究,包括保加利亚乳杆菌、嗜热链球菌、干酪乳杆菌、嗜酸乳杆菌、双歧杆菌等,它们具有有效的蛋白质水解系统并且有助于生物活性肽的释放[20]。除了直接接种所需微生物之外,从乳酸菌中分离出来的蛋白酶也可以成功用于蛋白质的水解和生物活性肽的生产。乳制品通过发酵生产这些生物活性肽类已经非常普遍,同样豆类、大米和小麦的发酵制品也具有许多生物活性肽[21-22]。像米曲霉和酱油曲霉在中国传统发酵食品生产中有很长的历史,在保证食品安全性的同时富含生物活性肽,作用主要为抗氧化和降血压[23]。而日本传统发酵产品中纳豆中含有纳豆激酶( nattokinase),纳豆激酶是一种具有溶解交联纤维蛋白功能的从纳豆(natto)中提取纯化出的丝氨酸蛋白酶[24]。作为一种抗血栓肽,纳豆激酶对血栓有极强的清除能力;JI等[25]研究还发现,其对大脑缺血的保护机制。
微生物发酵法的原料都富含蛋白质,产生的肽类因为发酵控制而有所不同。发酵所产生的生物活性肽通过饮食直接进入人体内消化系统,被人体吸收。发酵法比起酶法生产生物活性肽更加安全,投入更少,所以微生物发酵生产生物活性肽是目前应用最广的方法。
2.2酶解
酶水解是制备生物活性肽中最快、最安全以及最容易控制的技术,它被用来提高蛋白质的功能性质和生物学特性的同时也提高了某些副产品的商业价值[26]。目前一般采用一种或多种特异性或非特异性的蛋白酶,酶的复配能够显著降低成本。蛋白酶能够催化蛋白质中肽键的水解,对底物有一定的特异性,一般是根据肽键周围氨基酸的顺序。这种特异性和水解条件(pH、温度时间等)会影响多肽链的长度和氨基酸顺序以及游离氨基酸的数量,最终影响水解物的生物活性[27]。具有特定活性的蛋白酶比如胰蛋白酶和糜蛋白酶和不同非特异性的蛋白酶比如来自于不同菌属来源的蛋白酶的混合使用能够减少酶解时间和得到不同组成和分子质量分布的酶解物。通过控制制备的参数可以稳定高效地制备生物活性肽。蛋白酶源有动物、植物和微生物。除了商业酶制剂之外,微生物粗酶也能用来生产生物活性肽。表1列举了用商业酶和粗酶制品水解蛋白生产的生物活性肽的情况。
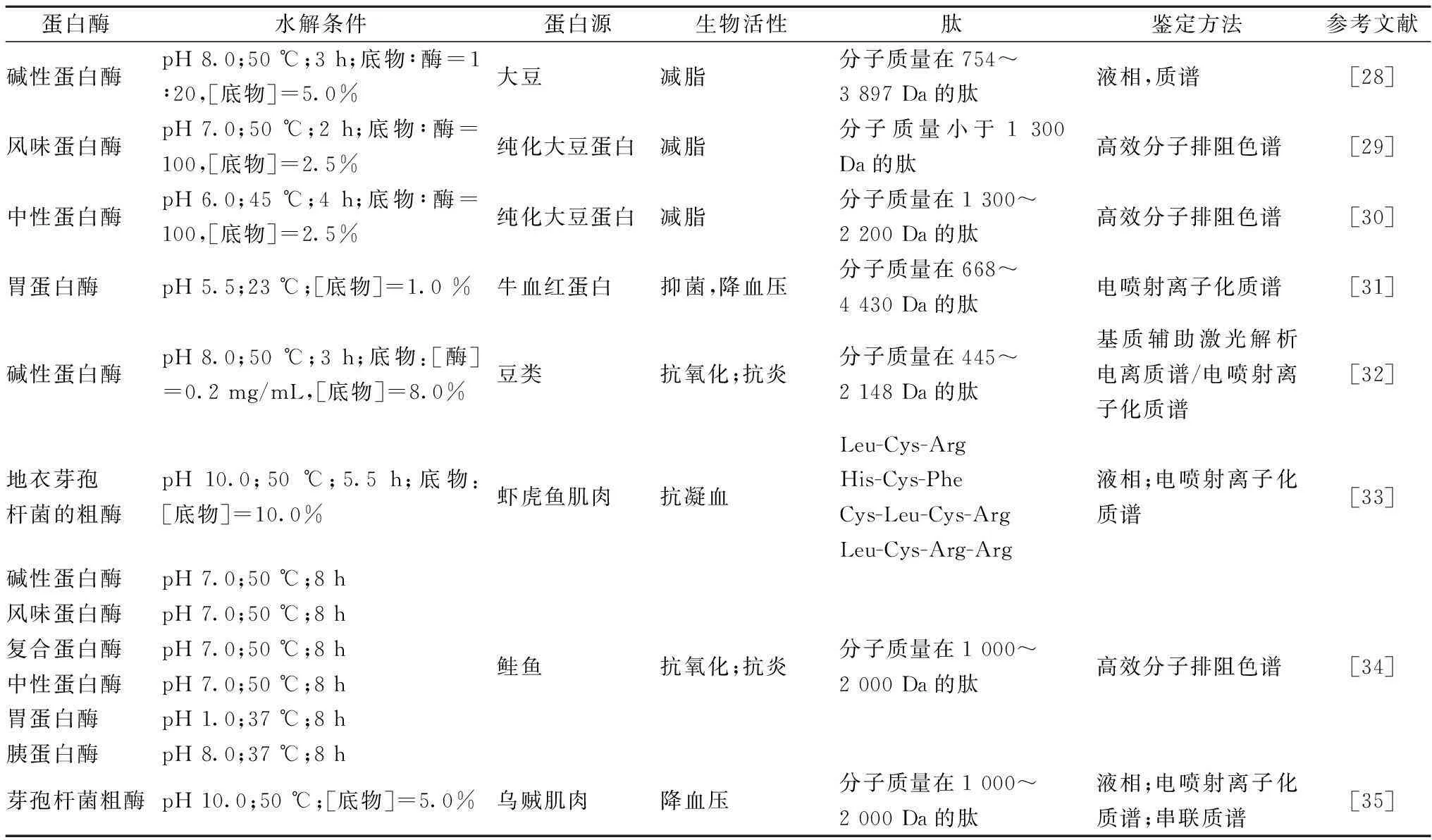
表1 用商业酶和粗酶制品水解蛋白生产的生物活性肽的情况
酶解制备生物活性肽需要蛋白质的预处理技术和可控酶解技术使酶能进行高效靶向性的酶解。蛋白质的预处理主要是为了提高酶对蛋白质敏感性,包括高压均质和超微细粉碎技术、适度变性技术、亚基解离技术、接枝技术、超高压改性和超声改性等;蛋白质的可控酶解主要是为了控制酶切位点,保证产物一定的分子质量分布,包括酶分子修饰和底物蛋白分子修饰。
酶法制备生物活性肽利于稳定生产,对于工业化应用非常有利,具有良好的应用前景。
3生物活性肽的纯化,鉴定的研究进展
生物活性肽定向分离纯化对于生物活性肽进行进一步生物活性评价和结构分析,继而确定构效关系至关重要。定向分离纯化技术主要包括超滤、凝胶色谱、离子交换色谱和高效逆流色谱等。前2种依据分子质量分别进行粗分离和精分离,而后2种分别利用带电性和亲疏水性进行精分离。表2综述了生物活性肽的纯化和鉴定方法的不同特点,包括它们的原理,优点和局限性。
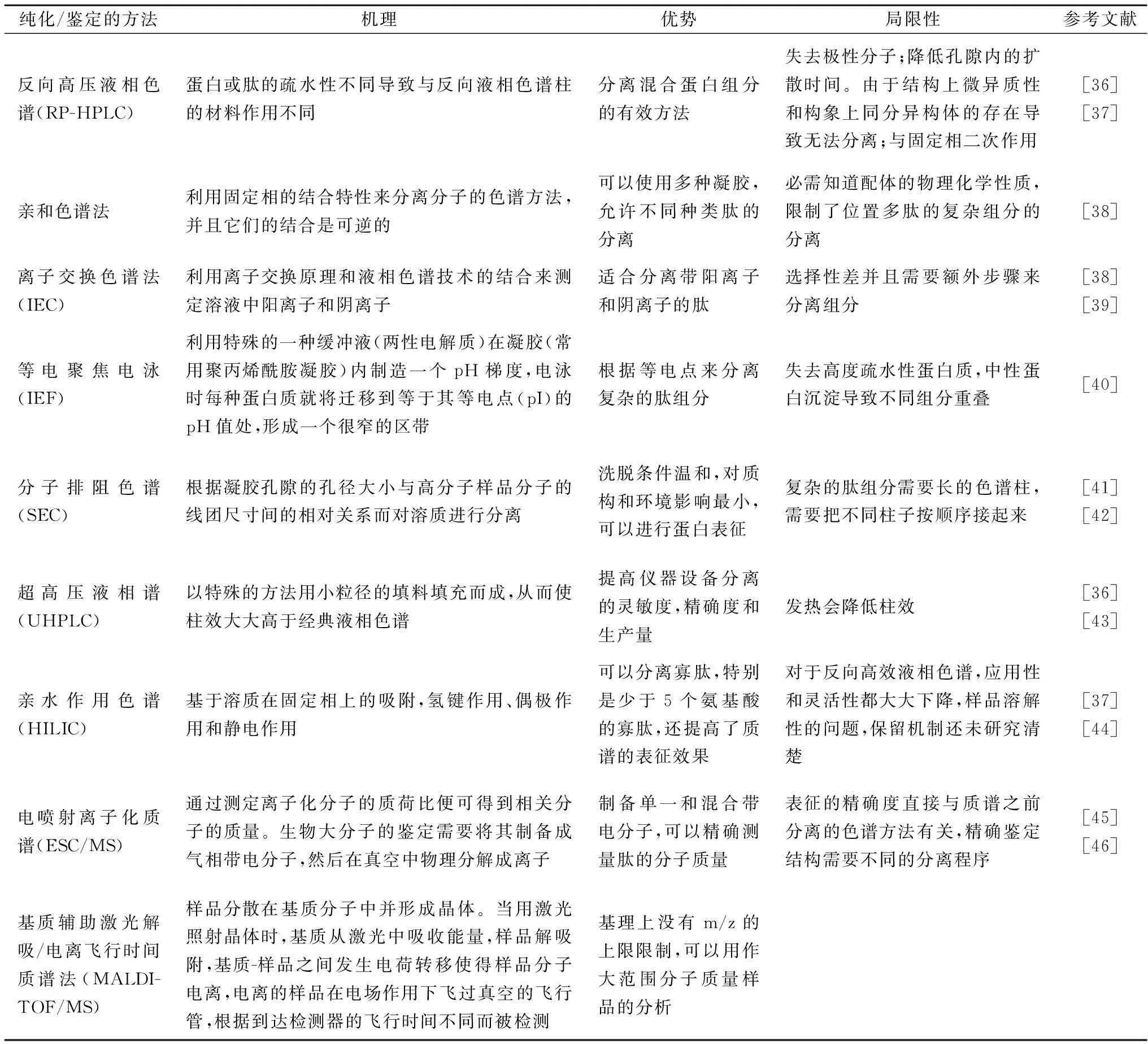
表2 生物活性肽纯化和鉴定不同分析手段的主要特点
色谱技术在其中运用最为广泛,比如高效液相色谱和超高压液相色谱[6]。超高压液相色谱在小分子生物活性肽的分离中有很大的优势,提高了普通高效液相色谱分离的生产量,这种方法的主要优点还在于分辨率和灵敏性的提高[36-47]。高效反向液相色谱可以通过疏水性来分离多肽。亲水作用液相色谱是亲水基质分离的有效手段,这种方法基于随着固定相和溶质的极性增加,用于洗脱的主要有机溶剂的极性减少,与反向液相色谱的原理相反。
LE等[37]利用高效液相色谱法提高了小肽的分离效果并且通过质谱分析了具有相似氨基酸序列的肽类的差异。其中高效液相色谱法(HPLC)是分离、纯化和鉴定生物活性肽最常见的手段。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和超速离心也常用于结构测定和氨基酸组成分析。此外,超滤可以用来分离所需要分子质量和功能活性的生物活性肽。对筛选过的生物活性肽进行超滤能提高生物活性。而凝胶色谱法由于具有设备简单,操作方便,洗脱条件温和和层析柱可反复使用等诸多优点,在生物活性肽的分离纯化中使用极其广泛。
近年来,电喷射离子化(ESI),基质辅助激光解析电离质谱(MALDI-MS)和质谱(MS)逐渐被用来鉴定生物活性肽的结构。质谱能够精确测定分子质量和蛋白序列,也能鉴定蛋白的降解产物和研究蛋白质的构象[46]。分子过滤和分子排阻色谱还能用来提取特定分子质量的生物活性肽。各种方法都有其适用性和局限性,在实际使用中主要根据研究目的和效果进行选择和方法联用。
4生物活性肽制备和商业化应用的主要问题
制备生物活性肽存在诸多问题:(1)大多生物活性肽构效关系不清楚;(2)原料蛋白利用率低,生产成本偏高;(3)生物活性肽有效成分低、功效不突出;(4)蛋白酶对肽键的专一性不强,难以靶向酶解;(5)小分子肽的分离纯化技术大多数难适应于工业化生产;(6)生物活性肽与食品其他成分在加工、储藏过程中反应复杂,难以控制;(7)生物活性肽在体内进行消化吸收后作用机理缺乏研究。
4.1生物活性肽的功能性争议
PICARIELLO等[48]研究表明,生物活性肽的作用机理仍然不能用作为理解药物代谢所必须的药物动力学和药效学来解释。大多数关于食源性的生物活性肽的研究对肽类对胃酶、胰酶和小肠绒毛细胞酶敏感性的研究不足,而且只有极小的分子浓度才可能进入体循环。虽然一些肽类可能在局部胃肠道中还保持生物活性,但大多数生物循环肽在体循环中已经完全失去了生物活性。所以,关于生物活性肽的体内稳定性、有效性和利用性和它们的吸收、代谢和排出都很有争议。
BOUTROU等[49]对在摄入30 g的牛乳酪蛋白和乳清蛋白的健康成年人空肠液分别检测和测序了356种和146种肽,这些肽的含量都足够使其生物活性的得到表现,包括β-酪蛋白产生的已知序列生物活性肽的降血压功能。但是,并未发现这些寡肽的吸收和生物利用情况。对于像纳豆激酶这样由275个氨基酸组成的肽,基本不可能进入人体血液循环。由于诸如此类研究都采用动物实验的方法,包括进行生物活性肽注射和体外凝血实验等,而人体主要通过膳食途径摄入这些生物活性肽,关于实验结果是否适用于人体,效果是否显著的研究并不充分。
从原理上看来,生物活性肽在人体内要发挥一定功效是很难实现的。一方面进入消化系统被酶分解成更小的肽和氨基酸;另一方面通过消化道壁乃至进入人体血液循环很难保证一定的含量来发挥其生物活性。此外,还可能直接被免疫系统识别为外来异物,引起免疫反应。有学者通过肛门给蛋白类药物,想通过直肠吸收药物以避开消化分解的可能,但也未在血液中检查到目标物。
所以生物活性肽在人体中的生物活性,所起的效果还存在着诸多问题,这也是制约生物活性肽商业化应用最大的瓶颈。而且也缺乏足够的医学数据特别是患者服用效果的统计数据来证明生物活性肽的有效性。
4.2生物活性肽的风味问题
民以食为天,食以味为先。对于食品而言,最大的影响因素就是风味。没有良好的风味,消费者是不愿意为新产品买单,特别是在功效还不明确的情况下。
TEMUSSI[50]发现,在考虑一类肽的许多重要的生物功能性时,往往会忽略肽的风味。而多种的肽类产品的风味却极其苦涩,所以需要合适的配方与其他成分如可可粉和阿斯巴甜,或果糖、果胶等的加入调配来提升风味和色泽。同时还需要风味提升技术和稳态保护技术。
生物活性肽的应用还有诸多其他的问题。表3列举相关的问题和解决方法。

表3 生物活性肽商业化的问题与挑战和对应的解决方法与研究需要
当今世界,非传染性疾病的流行突显了生物活性肽作为功能膳食原料的研究价值。然而,大规模的生物活性肽的商品化应用仍然面临诸多技术和工艺上的问题。首先,生物活性肽的功效性需要大量的临床疗效实验数据来证明;其次,对于生产条件的控制和生物活性肽制剂在人体内的活性保护需要严格的操作保证和稳态保护技术;最后,对于产品风味和颜色需要一些食品添加剂的调配,但是对于生物活性肽和其他食品组分的反应还需要进一步的研究。
作为食疗,生物活性肽的摄入具有许多药物所没有的优势,生物活性肽产业机遇和挑战并存。
参考文献
[1]赵谋明, 任娇艳. 食源性生物活性肽结构特征与生理活性的研究现状与趋势[J]. 中国食品学报, 2011, (9): 69-81.
[2]LAFARGA T, HAYES M. Bioactive peptides from meat muscle and by-products: generation, functionality and application as functional ingredients[J]. Meat Sci, 2014, 98(2): 227-239.
[3]SAKANAKA S, TACHIBANA Y, ISHIHARA N, et al. Antioxidant activity of egg-yolk protein hydrolysates in a linoleic acid oxidation system[J]. Food Chem, 2004, 86(1): 99-103.
[4]王伟军, 李延华, 于俊林, 等. 功能性食品的研究现状及发展趋势[J]. 通化师范学院学报, 2008(10): 37-39.
[5]MELLANDER O. The physiological importance of the casein phosphopeptide calcium salts. 2. Peroral calcium dosage of infants. Some aspects of the pathogenesis of rickets[J]. Acta Societatis Botanicorum Poloniae, 1950, 55(5/6): 247-255.
[6]SINGH B P, VIJ S, HATI S. Functional significance of bioactive peptides derived from soybean[J]. Peptides, 2014, 54: 171-179.
[7]MORA L, REIG M, TOLDRF. Bioactive peptides generated from meat industry by-products[J]. Food Research International, 2014, 65: 344-349.
[8]HONG F, MING L, YI S, et al. The antihypertensive effect of peptides: A novel alternative to drugs?[J]. Peptides, 2008, 29(6): 1 062-1 071.
[9]UHLIG T, KYPRIANOU T, MARTINELLI F G, et al. The emergence of peptides in the pharmaceutical business: From exploration to exploitation[J]. EuPA Open Proteomics, 2014, 4: 58-69.
[10]BRIJESH K P, SAURABH S, MANISH S, et al. Inducing toxicity by introducing a leucine-zipper-like motif in frog antimicrobial peptide, magainin 2[J]. Biochemical journal, 2011, 436(3): 609-620.
[11]苗建银, 柯畅, 郭浩贤, 等. 抗菌肽的提取分离及抑菌机理研究进展[J]. 现代食品科技, 2014(1): 233-240.
[12]王尊生, 俞永信, 袁勤生. 虫草属真菌的生物活性成分[J]. 中草药, 2004(10): 130-133.
[13]LIU M, TAN H, ZHANG X, et al. Hematopoietic effects and mechanisms of Fufang Ejiao Jiang on radiotherapy and chemotherapy-induced myelosuppressed mice[J]. Journal of Ethnopharmacology, 2014, 152(3): 575-584.
[14]KORHONEN H. Milk-derived bioactive peptides: From science to applications[J]. Journal of Functional Foods, 2009, 1(2): 177-187.
[15]HAFEEZ Z, CAKIR-KIEFER C, ROUX E, et al. Strategies of producing bioactive peptides from milk proteins to functionalize fermented milk products[J]. Food Research International, 2014, 63: 71-80.
[16]CHEN G W, TSAI J S, SUN P B. Purification of angiotensin I-converting enzyme inhibitory peptides and antihypertensive effect of milk produced by protease-facilitated lactic fermentation[J]. International Dairy Journal, 2007, 17(6): 641-647.
[17]LI-CHAN E C Y. Bioactive peptides and protein hydrolysates: research trends and challenges for application as nutraceuticals and functional food ingredients[J]. Current Opinion in Food Science, 2015, 1: 28-37.
[19]LOPEZ-KLEINE L, MONNET V 2011. Lactic Acid Bacteria | Proteolytic Systems[M] //JW Fuquay, Encyclopedia of Dairy Sciences (Second Edition). San Diego:Academic Press,2011:49-55.
[21]HATI S, VIJ S, MANDAL S, et al. α-Galactosidase activity and oligosaccharides utilization by lactobacilli during fermentation of soy milk[J]. Journal of Food Processing and Preservation, 2014, 38(3): 1 065-1 071.
[22]NAKAHARA T, SANO A, YAMAGUCHI H, et al. Antihypertensive effect of peptide-enriched soy sauce-like seasoning and identification of its angiotensin I-converting enzyme inhibitory substances[J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 821-827.
[23]GIRI A, OSAKO K, OKAMOTO A, et al. Antioxidative properties of aqueous and aroma extracts of squid miso prepared with Aspergillus oryzae-inoculated koji[J]. Food Research International, 2011, 44(1): 317-325.
[24]SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet[J]. Experientia, 1987, 43(10): 1 110-1 111.
[25]JI H, YU L, LIU K, et al. Mechanisms of nattokinase in protection of cerebral ischemia[J]. Eur J Pharmacol, 2014, 745(1-3): 144-151.
[26]LUNA-VITAL D A, MOJICA L, GONZLEZ DE MEJA E, et al. Biological potential of protein hydrolysates and peptides from common bean (PhaseolusvulgarisL.): A review[J]. Food Research International,2015,76:39-50.
[27]SAMARANAYAKA A G P, LI-CHAN E C Y. Food-derived peptidic antioxidants: A review of their production, assessment, and potential applications[J]. Journal of Functional Foods, 2011, 3(4): 229-254.
[28]GONZALEZ DE MEJIA E, MARTINEZ-VILLALUENGA C, ROMAN M, et al. Fatty acid synthase and in vitro adipogenic response of human adipocytes inhibited by α and α′ subunits of soybean β-conglycinin hydrolysates[J]. Food Chem, 2010, 119(4): 1 571-1 577.
[29]TSOU M J, KAO F J, TSENG C K, et al. Enhancing the anti-adipogenic activity of soy protein by limited hydrolysis with Flavourzyme and ultrafiltration[J]. Food Chem, 2010, 122(1): 243-248.
[30]TSOU M J, LIN W T, LU H C, et al. The effect of limited hydrolysis with Neutrase and ultrafiltration on the anti-adipogenic activity of soy protein[J]. Process Biochemistry, 2010, 45(2): 217-222.
[31]ADJE E, BALTI R, KOUACH M, et al. α 67-106 of bovine hemoglobin: a new family of antimicrobial and angiotensin I-converting enzyme inhibitory peptides[J]. European Food Research and Technology, 2011, 232(4): 637-646.
[32]OSEGUERA-TOLEDO M E, DE MEJIA E G, DIA V P, et al. Common bean (PhaseolusvulgarisL.) hydrolysates inhibit inflammation in LPS-induced macrophages through suppression of NF-κB pathways[J]. Food Chem, 2011, 127(3): 1 175-1 185.
[33]NASRI R, AMOR I B, BOUGATEF A, et al. Anticoagulant activities of goby muscle protein hydrolysates[J]. Food Chem, 2012, 133(3): 835-841.
[34]AHN C B, JE J Y, CHO Y S. Antioxidant and anti-inflammatory peptide fraction from salmon byproduct protein hydrolysates by peptic hydrolysis[J]. Food Research International, 2012, 49(1): 92-98.
[35]BALTI R, BOUGATEF A, SILA A, et al. Nine novel angiotensin I-converting enzyme (ACE) inhibitory peptides from cuttlefish (Sepiaofficinalis) muscle protein hydrolysates and antihypertensive effect of the potent active peptide in spontaneously hypertensive rats[J]. Food Chem, 2015, 170: 519-525.
[36]EVERLEY R A, CROLEY T R. Ultra-performance liquid chromatography/mass spectrometry of intact proteins[J]. Journal of Chromatography A, 2008, 1 192(2): 239-247.
[37]LE MAUX S, NONGONIERMA A B, FITZGERALD R J. Improved short peptide identification using HILIC-MS/MS: Retention time prediction model based on the impact of amino acid position in the peptide sequence[J]. Food Chem, 2015, 173: 847-854.
[38]ORTIZ-MARTINEZ M, WINKLER R, GARCA-LARA S. Preventive and therapeutic potential of peptides from cereals against cancer[J]. J Proteomics, 2014, 111: 165-183.
[39]BOUHALLAB S, HENRY G, BOSCHETTI E. Separation of small cationic bioactive peptides by strong ion-exchange chromatography[J]. Journal of Chromatography A, 1996, 724(1-2): 137-145.
[40]ISSAQ H J, CONRADS T P, JANINI G M, et al. Methods for fractionation, separation and profiling of proteins and peptides[J]. Electrophoresis, 2002, 23(17): 3 048-3 061.
[41]MORA L, REIG M, TOLDRF. Bioactive peptides generated from meat industry by-products[J]. Food Research International, 2014, 65: 344-349.
[42]FEKETE S, BECK A, VEUTHEY J L, et al. Theory and practice of size exclusion chromatography for the analysis of protein aggregates[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 101: 161-173.
[43]ULIYANCHENKO E, SCHOENMAKERS P J, VAN DER WAL S. Fast and efficient size-based separations of polymers using ultra-high-pressure liquid chromatography[J]. Journal of Chromatography A, 2011, 1218(11): 1 509-1 518.
[44]GRAY N, HEATON J, MUSENGA A, et al. Comparison of reversed-phase and hydrophilic interaction liquid chromatography for the quantification of ephedrines using medium-resolution accurate mass spectrometry[J]. Journal of Chromatography A, 2013, 1 289: 37-46.
[45]MANO N, GOTO J. Biomedical and biological mass spectrometry[J]. Analytical Sciences, 2003, 19(1): 3-14.
[46]DEL MAR CONTRERAS M, LPEZ-EXPSITO I, HERNNDEZ-LEDESMA B, et al. Application of mass spectrometry to the characterization and quantification of food-derived bioactive peptides[J]. Journal of AOAC International, 2008, 91(4): 981-994.
[47]SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1 949-1 956.
[48]PICARIELLO G, MAMONE G, NITRIDE C, et al. Protein digestomics: Integrated platforms to study food-protein digestion and derived functional and active peptides[J]. TrAC Trends in Analytical Chemistry, 2013, 52: 120-134.
[49]BOUTROU R, GAUDICHON C, DUPONT D, et al. Sequential release of milk protein-derived bioactive peptides in the jejunum in healthy humans[J]. The American journal of clinical nutrition, 2013, 97(6): 1 314-1 323.
[50]DIA V P, TORRES S, DE LUMEN B O, et al. Presence of lunasin in plasma of men after soy protein consumption[J]. Journal of Agricultural and Food Chemistry, 2009, 57(4): 1 260-1 266.
Research progress on production, purification and identification of bioactive peptides and its challenges in application
LIU Ming1,2, LIU Yu-huan1,2*, WANG Yun-pu1,2,RUAN Rong-sheng3, FAN Liang-liang1,2, ZOU Hui-fang1,2, TU Chun-ming1,2
1(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China) 2(Engineering Research Center for Biomass Conversion, Ministry of Education, Nanchang University, Nanchang 330047, China) 3(Center for Biorefining and Dept. of Bioproducts and Biosystems Engineering, University of Minnesota, Paul, 55108, USA)
ABSTRACTRecent advances in purification and identification technique of biologically active peptides created a great interest of research. Bioactive peptides can be defined as specific portions of peptides with 2 to 20 amino acids that have desirable biological activities, including antioxidant, antihypertensive, antithrombotic, antiadipogenic, antimicrobial and anti-inflammatory effects. Specific characteristics, including low toxicity and high specificity, make these molecules of particular interest in the field of food and pharmaceutical industries. This review focuses on the production of bioactive peptides, with special emphasis on fermentation and enzymatic hydrolysis. The combination of different technologies and the use of auxiliary processes are also addressed. A survey of isolation, purification and peptide characterization methods helped to choose the best techniques to determine the structures of bioactive peptides. Finally, research trends and challenges for application are discussed.
Key wordsbioactive peptides; purification; identification; challenges for application
收稿日期:2015-07-30,改回日期:2015-10-14
基金项目:食品科学与技术国家重点实验室自由探索课题 (No.SKLF-ZZB-201312 ); 科技部国际合作项目(No.2014DFA61040);江西省重大专项课题(No.20124ABG04103)资助;江西省研究生创新专项资金资助
DOI:10.13995/j.cnki.11-1802/ts.201604045
第一作者:硕士研究生(刘玉环研究员为通讯作者,)。

