铜绿假单胞菌群体感应效应系统细菌毒力调节的研究进展
陈双红,陈锐勇,徐雄利,肖卫兵
·综述与讲座·
铜绿假单胞菌群体感应效应系统细菌毒力调节的研究进展
陈双红,陈锐勇,徐雄利,肖卫兵
[关键词]铜绿假单胞菌;群体感应系统;感染;适应性
铜绿假单胞菌分布广,发病率、致死率高,是院内感染的第三大病原。铜绿假单胞菌有超过10%的基因组动态多变,随环境改变展示极强的种群遗传进化功能,以使其适应不同生长环境[1-2]。其中,群体感应效应(quorum-sensing, QS)系统是其种内及种间相互交流、并完成生物学特性适应性表达的关键基因族群。QS系统接受环境信号激活后可调节铜绿假单胞菌300多个毒力基因,包括:细菌生长、运动、鞭毛形成、分泌系统、生物被膜形成因子及参与细菌与宿主间的相互作用等关键致病环节。另外,QS系统调节生物被膜形成是铜绿假单胞菌临床顽固性耐药菌株产生的主要原因[3]。故,铜绿假单胞菌QS系统调节效应,与细菌致病和宿主逃避等行为密切相关,一直是临床细菌抗感染研究的热点[4-5]。
1铜绿假单胞菌QS系统组成
铜绿假单胞菌的QS系统是一个依赖于种群内细胞密度而被激活的基因调控系统,通过产生自诱导复合调节子调控下游靶基因,实现种群环境适应性生存。迄今认为,铜绿假单胞菌QS系统至少包括三套子系统,即AHL(N-acylated homoserine lactones,AHLs)信号依赖系统:las系统,rhl系统;AQ信号依赖的PQS系统[4-5](图1)。
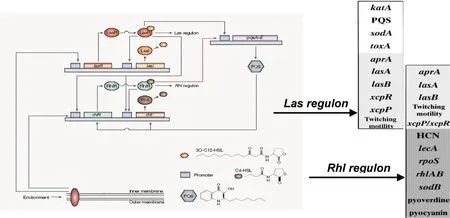
图1 环境信号触发铜绿假单胞菌QS系统响应的级联调控示意图
1.1AHL信号依赖的QS系统QS系统的核心子系统是AHL信号依赖的las/rhl系统[2,6-7]。las系统由lasI、lasR和信号分子3OC12-HSL(N-3-oxo-dodecanoyl-homoserine lactone, 3OC12-HSL)构成,rhl系统由rhlI、rhlR和信号分子C4-HSL(N-butanoyl-homoserine lactone, C4-HSL)构成。在las/rhl系统中I基因编码合成酶I蛋白,催化酰基载体蛋白酰基侧链与S-腺苷蛋氨酸高丝氨酸侧链生成AHL信号分子。AHL信号分子细胞外浓度达到一定,进入细胞内与R基因编码的R蛋白结合形成复合调节子,启动对下游靶基因的调控。lasR/3OC12-HSL复合子主要调节碱性蛋白酶、外毒素A、弹性蛋白酶等细胞主要急性毒力因子的基因转录表达;rhlR/ C4-HSL复合子则指导鼠李糖脂溶血素、几丁质酶、氰化物、绿脓菌素等细胞外次级代谢物质的产生,其调节作用滞后于lasR/3OC12-HSL复合子。
1.2AHQ信号依赖的QS系统喹诺酮类[2-alkyl-4(1H)-quinolone, AHQ]信号分子系统,是近期发现的铜绿假单胞菌第三套QS系统。由Pqs操纵子基因pqsABCDEH的产物指导细胞中的邻氨基苯甲酸合成4-羟基-2庚基-喹诺酮(4-hydroxy-2-heptylquinoli ne,HHQ)分子,同时该操纵子受转录调节子PqsR调控以维持信号分子的生理稳定性。PQS信号分子是由加单氧化酶催化HHQ生成,该酶的生成受pqsH操纵子产物调节,从而进一步调控PQS信号分子水平。PqsR/PQS复合调节子的主要功能是调节细菌密度及毒力因子释放相关基因的功能[2,6-7]。
1.3其他信号分子依赖的QS系统除外AHL和AHQ信号依赖QS系统,近年来还有报道将GacS/GacA系统作为铜绿假单胞菌QS的另一种辅助系统[2-3]。该系统的具体构成和调控机制尚待明确,但已证明其能够提高细菌运动能力、释放可可碱醋酸钠、促进生物被膜形成。
2铜绿假单胞QS系统调节
2.1QS系统内的级联调节铜绿假单胞菌QS系统内存在严格的等级分层调控,las系统位于QS系统内级联调节的最上游。lasR/3OC12-HSL调节子正反馈调节lasI,rhlI和rhlR的基因表达。同时,细胞内存在由RsaL蛋白介导的负反馈回路,调节lasR/3OC12-HSL的功能。亦即,通过RsaL转录调节抑制子与rsaL-lasI双向启动子结合抑制lasI基因转录,使细胞中3OC12-HSL维持稳态水平,进而维持lasR/3OC12-HSL复合调节子正反馈回路的平衡稳定性。RsaL与lasR/3OC12-HSL调节子在rsaL-lasI双向启动子DNA序列上的结合位点是毗邻而非竞争性,且RsaL调节子活性优先于lasR/3OC12-HSL的激活调节。不仅如此,RsaL还直接与QS系统调节的下游毒力基因(如:绿脓菌素等)的启动子区域结合,可直接调节毒力基因的功能[2-3,8-11]。
另外,las系统同时参与调节PQS系统,其中lasR/3OC12-HSL调节子激活pqsH操纵子功能,促进HHQ向PQS信号分子的转化,同时AHQ系统中的pqsABCD和PqsR的转录活性受rhlR/C4-HSL复合调节子的抑制。从而PQS系统信号分子的合成受las和rhl控制,同时PQS信号分子浓度影响las和rhl系统的基因表达,两者之间存在精细生理学平衡关系。这一序贯性级联调节决定las/rhl系统在铜绿假单胞菌QS系统的看家基因(home gene)地位,从而是其环境适应和调节的中心环节[4-5,8-14]。
2.2细菌全局调控因子对QS系统的调节除外QS系统内自反馈调节,铜绿假单胞菌QS系统还受细菌内源性全局调控因子的调节[14]。GacA被认为是QS系统最重要的全局调控因子,GacA蛋白正调控lasR和rhlR启动子;全局转录调节因子AlgR2则与lasR和rhlR启动子区结合,负向调节lasR和rhlR的转录活性;cAMP受体蛋白家族成员之一的Vfr蛋白,是细菌能量代谢和生长活性状态的感应因子,直接参与lasR基因的表达调控,也部分参与rhlR基因的活性调节。lasI基因的表达和转录水平分别受Vfr蛋白和rsaL的调节影响。ppK基因编码的多聚磷酸激酶正向调节QS信号分子3OC12-HSL和C4-HSL合成,转录起始因子σ家族的RpoN和RpoS对维持细胞内子3OC12-HSL和C4-HSL水平的稳定性有重要作用。同时,全局调节因子GacA还调节着另外2个与LuxR同源的R蛋白QscR 和 VqsR的合成。QscR蛋白不仅能抑制lasI基因转录水平,而且在AHLs信号分子缺失情况下,通过形成同源多聚体或与lasR和rhlR蛋白形成异源二聚体对QS系统进行精细调节,其调节功能与其他内源性性调节子的调节功能协调统一。研究还表明,在AHLs基因缺失细胞中,如果同时沉默VqsR基因功能,可以大大降低铜绿假单胞菌内毒力因子水平及其致病性,亦即VqsR参与了QS系统及其下游基因的调节功能。
细胞内参与调节QS系统的额外调节因子大致可分为3类:①正调控因子:GacA,Vfr和DksA等。②负调控因子:AlgR2,MvaT,RsmA和QscR等。③双向调节因子:VqsR,RpoN,RpoS等。这些额外调节因子既参与QS系统调节,又参与铜绿假单胞菌生物学功能中其他基因的调节作用,同时这些额外调节因子几乎都是环境刺激感应因子。正是这一调节特点使得铜绿假单胞菌能在不同环境刺激中激活不同的QS精细调节通路以表达特定的基因,实现对环境的适应性生长表型,从而得以在自然界中广泛存在[4-5,8-14]。
3铜绿假单胞菌QS系统与感染环境适应性调节
环境刺激诱导QS系统响应是铜绿假单胞菌间进行种内交流并完成生物特性适应性表达的关键步骤。该系统接受环境信号刺激并激活调节铜绿假单胞菌10%以上的有效基因,主要包括毒力、生物膜形成、鞭毛运动、细菌与宿主间的相互作用等关键致病环节因子,最终实现利于细菌种群侵袭、定植、免疫逃避和耐药性产生的有益生长表型。正是基于QS系统介导临床特殊生理环境中铜绿假单胞菌感染适应性中的重要作用,近年来其已成为国际研究和关注的热点。铜绿假单胞菌对环境适应性调节研究最为透彻的是侵入临床CF患者并能迅速适应CF患者肺部环境,完成急性感染到慢性迁延性感染的转变。由于慢性适应性感染的病菌无一例外都是顽固耐药菌,合并铜绿假单胞菌感染已成为CF患者院内死亡的主要原因[1,3-4]。
CF患者临床不同感染期,铜绿假单胞菌毒力基因表达差异明显,而这一差异主要是由细菌在不同感染期维持种群适应性生长进化需求决定(图2)[2]。在急性感染侵袭期细菌需要快速生长、侵入并定植于宿主。因此,环境信号主要诱导细菌感应系统激活与侵袭相关的毒力基因(如:toxA,aprA,phzA1)、与生长定植相关的基因(如:鞭毛运动)、与逃避宿主防御功能相关基因(如:TypeⅢ分泌系统)等的大量表达,以适应细菌快速侵染定植的生长需要。慢性感染的临床患者分离株中,铜绿假单胞菌的细胞外分泌产物明显减少,TypeⅢ分泌系统功能失活,与侵袭相关的脂多糖被代之以与生物膜形成相关的表多糖,与细菌黏液样生长表型密切相关的藻酸盐过量表达。铜绿假单胞菌细胞外一旦产生大量的藻酸盐,则可形成生物膜包围细胞使其免遭机体巨噬细胞的吞噬,生物膜形成是细菌慢性感染和耐药性产生的重要基础。这些在急性感染期高表达的毒力基因出现表达抑制,甚至高频失活性序列突变等是为适应缺氧、免疫钝化和抗生素治疗压力等CF慢性感染环境。急慢性环境刺激诱导铜绿假单胞菌的适应调节机制主要有两方面:直接的信号感应激发精细的信号转导调节,持续选择压力诱导基因遗传变异的适应调节[11-12]。
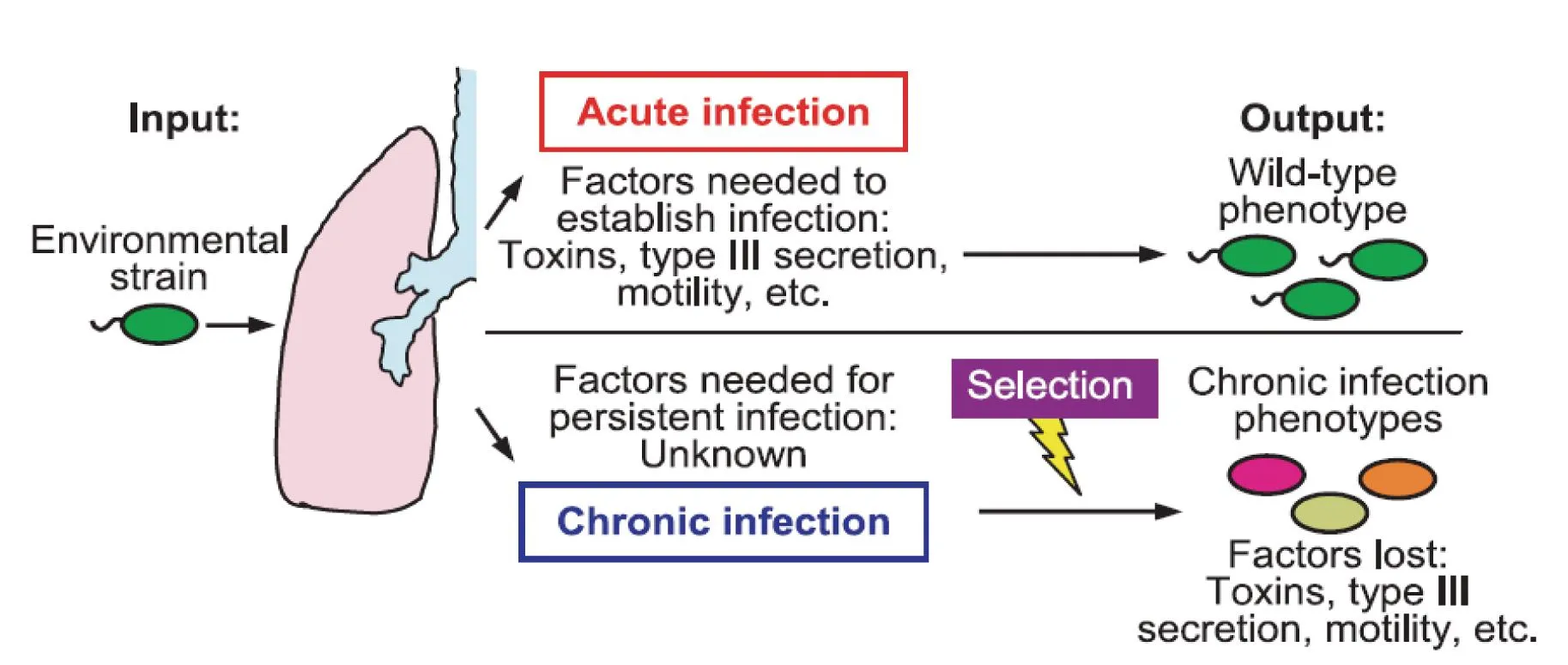
图2 铜绿假单胞菌细胞急慢性毒力因子感染适应性
在持续的环境选择压力下,QS系统及其调节因子的基因组遗传信息改变是其对环境有效适应的另一途径。 Smith对临床急慢性感染的铜绿假单胞菌分离株进行比较基因组学研究发现,慢性感染分离株基因组发生大量的基因突变。基因突变的特点是以单碱基改变、1~3个碱基的插入或丢失居多,少数也出现大片段基因缺失,从而出现相应基因编码蛋白翻译的提前终止、读码框移位、转座子插入等。这种自然环境选择下的非同义突变中约有2/3以上是阳性选择性突变,直接导致了相应蛋白功能的部分或全部丢失。通过对感染早期和感染96个月的分离株的比较发现,感染晚期分离株基因突变发生率最高的是QS效应系统基因,其次突变基因涉及菌体抗原合成、III型分泌因子、细菌颤动、外毒素A调节、多药耐药泵、渗透压平衡和离子获取等基因,这些基因型的改变都减低了细菌在急性感染期的毒性表型,也进一步证明这些表型的改变是为适应CF慢性感染的缺氧、免疫钝化和抗生素治疗的环境选择压力[13-14]。
其中QS系统的lasR基因突变频率最高。研究表明:在对CF慢性感染环境适应过程中,lasR基因的突变至少出现3种有益于种群内和种群间的生长效应:①减少lasR/ 3OC12-HSL复合调节子对急性侵袭因子的诱导表达,逃避宿主细胞对细菌的免疫识别;②减少对lasI基因表达的诱导功能,通过减少细胞自感应分子生成,控制局部种群生长密度以减少生长信息感知。③lasR基因自身功能完全缺失,对细胞外种群间效应分子无反应(signal blind),出现种群间的隐身欺骗效应,以维持种内生长适应要求。除外lasR基因的高频突变外,临床顽固性感染株基因组还检测到rhlR和lasI基因突变,lasR基因上游的全局调控因子Vfr基因突变频率也很高。更有意义的是,在QS系统及其调节子高频突变的菌株中,往往同时伴有Muts基因的突变,Muts基因是铜绿假单胞菌基因组中DNA碱基错配修复基因。其基因突变导致的修复功能缺失,可维持特定环境下细菌自体基因组序列遗传学适应性稳定,从而QS及相关毒力基因环境选择性基因高频突变效率得以选择性维持[8,12]。
因此,细胞生存环境的外源信号一方面通过跨膜的信号感知系统激活下游的全局调控因子,几乎都参与调节QS系统功能,通过激活或抑制QS系统功能进一步精细调控下游毒力基因的表达,实现铜绿假单胞菌对临床急慢性感染环境的适应性;另一方面慢性环境信号的选择压力还可以通过改变信号通路中看家基因的遗传信息实现细菌对环境的定向适应性调节。总之,感染环境诱导铜绿假单胞菌QS系统对毒力的调节作用使细菌在宿主中实现了 “费用-效益” 最优化的种群生存法则。
4结语
综上所述,诸多的环境选择压力可激活铜绿假单胞菌QS调节系统,由其再进一步定向介导下游有效毒力基因表达,使铜绿假单胞菌出现强大“环境-细菌-宿主”的生存适应表型,最终实现存活的“费用-效益”最优化的种群生长法则。正是基于此,笔者认为铜绿假单胞菌在氦氧饱和高气压环境中出现快速增殖并对健康人群表现出高侵害表型,也可能是QS系统对该环境暴露的敏感响应能力诱导调控下游基因所致[6]。如能准确诠释这一调控机制,阐明铜绿假单胞菌潜水职业性高感染的原因,将对研究新的抗感染治疗技术手段、控制该职业领域感染高发有重要意义。
[参考文献]
[1]Hassett DJ, Sutton MD, Schurr MJ, et al. Pseudomonas aeruginosa hypoxic or anaerobic biofilm infections within cystic fibrosis airways[J]. Trends Microbiol, 2009, 17(3): 130-138.DOI:10.1016/j.tim.2008.12.003.
[2]Nguyen D, Singh PK. Evolving stealth: genetic adaptation of Pseudomonas aeruginosa during cystic fibrosis infections[J]. Proc Natl Aced Sci USA, 2006, 103(22): 8305-8306.DOI:10.1073/pnas.0602526103.
[3]Darch SE, West SA, Winzer K, et al. Density-dependent fitness benefits in quorum-sensing bacterial populations[J].Proc Natl Acad Sci USA, 2012, 109(21): 8259-8263.DOI: 10.1073/pnas.1118131109.
[4]Williams P, Cmara M. Quorum sensing and environmental adaptation in Pseudomonas aeruginosa: a tale of regulatory networks and multifunctional signal molecules[J]. Curr Opin Microbiol, 2009, 12(2): 182-191.DOI:10.1016/j.mib.2009.01.005.
[5]Verstraeten N, Braeken K, Debkumari B, et al. Living on a surface: swarming and biofilm formation[J]. Trends Microbiol, 2008, 16(10): 496-506.DOI:10.1016/j.tim.2008.07.004.
[6]Winstanley C, Fothergill JL. The role of quorum sensing in chronic cystic fibrosis Pseudomonas aeruginosa infections[J]. FEMS Microbiol Lett, 2009, 290(1): 1-9.DOI:10.1111/j.1574-6968.2008.01394.x.
[7]Köhler T, Buckling A, van Delden C. Cooperation and virulence of clinical Pseudomonas aeruginosa populations[J].Proc Natl Acad Sci USA, 2009, 106(15): 6339-6344.DOI:10.1073/pnas.0811741106.
[8]Hibbing ME, Fuqua C, Parsek MR, et al. Bacterial competition: surviving and thriving in the microbial jungle[J]. Nat Rev Microbiol, 2010, 8(1): 15-25.DOI:10.1038/nrmicro2259.
[9]Inglis RF, Gardner A, Cornelis P, et al. Spite and virulence in the bacterium Pseudomonas aeruginosa[J]. Proc Natl Acad Sci USA, 2009, 106(14): 5703-5707.DOI:10.1073/pnas.0810850106.
[10] Lee S, Hinz A, Bauerle E, et al. Targeting a bacterial stress response to enhance antibiotic action[J].Proc Natl Acad Sci USA, 2009, 106(34):14570-14575.DOI:10.1073/pnas.0903619106.
[11] Cornforth DM, Popat R, McNally L, et al. Combinatorial quorum sensing allows bacteria to resolve their social and physical environment[J]. Proc Natl Acad Sci USA, 2014, 111(11):4280-4284.DOI:10.1073/pnas.1319175111.
[12] Mathee K, Narasimhan G, Valdes C, et al. Dynamics of Pseudomonas aeruginosa genome evolution[J].Proc natl Acad Sci USA, 2008, 105(8): 3100-3105.DOI:10.1073/pnas.0711982105.
[13] Julou T, Mora T, Guillon L, et al. Cell-cell contacts confine public goods diffusion inside Pseudomonas aeruginosa clonal microcolonies[J]. Proc Natl Acad Sci USA, 2013, 110(31): 12577-12582.DOI:10.1073/pnas.1301428110.
[14] O′Loughlin CT, Miller LC, Siryaporn A, et al. A quorum-sensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation[J].Proc Natl Acad Sci USA, 2013, 110(44): 17981-17986.DOI:10.1073/pnas.1316981110.
(本文编辑:林永丽)
(收稿日期:2015-08-17)
[中图分类号]R378.991
[文献标识码]B[DOI]10.3969/j.issn.1009-0754.2016.02.029
[基金项目]国家自然科学基金项目(NO:81271796);上海市自然科学基金项目(NO:09ZR1421000)
[作者单位]200433上海,海军医学研究所舰艇卫生研究室(陈双红、徐雄利),高气压与潜水生理学全军重点实验室(陈锐勇、肖卫兵)

