颈动脉重度再狭窄患者的再干预治疗结果分析
李金勇 刘 鹏 樊雪强叶志东 王 非 杨煜光 林 凡 陈 洁 郑 夏甄亚楠 钱松屹 王风林中日友好医院心脏血管外科,北京 100029
颈动脉重度再狭窄患者的再干预治疗结果分析
李金勇 刘鹏 樊雪强*叶志东 王非 杨煜光 林凡 陈洁 郑夏甄亚楠 钱松屹 王风林
中日友好医院心脏血管外科,北京 100029
摘要:目的评估手术及腔内治疗颈动脉重度再狭窄的临床安全性及有效性。方法回顾性分析2011-07—2015-06因症状性颈动脉重度再狭窄接受手术和腔内治疗的患者,分析患者的病变特征并评估再次干预治疗的有效性及围手术期脑梗塞、心肌梗塞的发生率及其死亡发生率。结果共7例有症状性颈动脉重度再狭窄患者接受再次干预治疗,其中6例首次治疗方式为颈动脉球囊扩张支架植入术,1例为颈动脉外翻剥脱治疗。再次干预治疗包括6例颈动脉支架及内膜切除术+补片修补术,1例脑保护伞装置保护下球囊扩张支架植入术。术后7例患者脑缺血症状消失,术后30 d内无脑梗塞、心肌梗塞及死亡发生。结论颈动脉重度再狭窄的再次干预治疗安全、有效,具体治疗方式需要个体化。
关键词:颈动脉重度再狭窄;再干预治疗;安全性;有效性
颈动脉狭窄是引起缺血性脑卒中的主要原因之一,治疗目的是减少脑卒中以及脑卒中相关的死亡风险[1,2]。作为经过前瞻性临床试验反复验证的颈动脉血运重建方式:颈动脉内膜切除术(CEA)和颈动脉支架植入术(CAS),目前在临床开展越来越普遍[3]。后续内膜增生及动脉硬化发展引起术后再狭窄,成为困扰临床远期治疗效果的主要问题,如何准确地发现并且选择有效的治疗手段,是目前临床需要明确的问题。本研究回顾性分析中日友好医院心血管外科7例重度颈动脉再狭窄患者,探讨腔内治疗颈动脉重度再狭窄的安全性及有效性。
1 资料与方法
1.1一般资料
选取2011-07—2015-06中日友好医院收治的7例有症状性颈动脉重度再狭窄患者。男性6例,女性1例,平均年龄69.7(54~79岁),入院时均有脑缺血症状:反复头晕发作4例、TIA 2例、单侧脑卒中1例。颈动脉超声检查收缩期峰值流速(PSV):230~300 cm/s 2例;300~400 cm/s 4例;>400 cm/s 1例。5例曾经接受CAS治疗,1例接受颈动脉外翻剥脱治疗,1例首先行颈动脉内膜切除术,2个月后因为颈动脉重度再狭窄而行颈动脉支架植入术,就诊时出现支架近端重度再狭窄,根据狭窄的结果分型:Ⅰ型狭窄3例,分别在支架的近端(病例2)和远端(病例3、4),考虑与支架的长度覆盖不足和远端oversize过大有关;Ⅱ型狭窄4例,位于支架(病例1、5、7)或者手术部位的中段(病例6),严重的内膜增生可能是其成因。(表1)

表1 患者基本特征及再狭窄指标测定
1.2治疗方法
所有患者入院后评估手术适应证及全身状况。在行头颅CT检查无新发脑梗塞后行再次干预治疗。6例选择颈动脉内膜切除术,术中切除斑块及支架;1例选择腔内介入治疗。手术常规放置颈动脉转流管,并且应用人工血管补片成型(高纯聚氨基甲酸乙酯 贝朗公司),在手术结束后即时行颈动脉造影或者超声检查。颈动脉支架植入术是在远端脑保护装置下,扩张至靶血管直径后植入自膨式外周血管支架。颈动脉内膜切除术患者终生口服阿斯匹林100 mg/d;颈动脉支架植入术患者口服双抗(阿斯匹林100 mg/d,盐酸氯吡格雷75 mg/d),在1年后长期口服阿斯匹林100 mg/d。对存在高同型半胱氨酸血症的患者,给予叶酸片口服治疗,所有患者给予西洛他唑100 mg/d Bid,治疗6个月。
2 结果
7例患者均接受颈动脉再次血运重建治疗,其中病例1、3、4、6、7选择颈动脉内膜切除及补片成形术;病例5因术后出现狭窄,行支架治疗可能会再次狭窄,遂选择对侧颈动脉内膜切除术;病例2选择再次介入治疗。围手术期无脑缺血发作、心肌梗死、感染及死亡,术后脑缺血症状均消失。
病例1、6均为右侧颈内动脉支架术后,入院检查提示支架内重度再狭窄,对侧颈内动脉完全闭塞,前循环开放。再狭窄位置为支架中远端,考虑单纯球囊扩张或者支架置入术导致局部内膜的损伤及增生依然明显,如果术中出现血管闭塞,临床后果严重,因此选择颈动脉内膜切除及补片成型术,通过术中提升血压并且放置转流管以保证脑供血,应用人工血管补片加宽颈内直径,防止术后再狭窄发生。(图1)

图1 患者,男性,79岁,因反复头晕发作入院治疗
病例5为双侧颈内动脉重度狭窄患者,左侧行颈动脉外翻剥脱术后3个月,CTA及超声检查提示内膜远端重度狭窄,考虑与局部残留的内膜增生有关。由于近期手术粘连重,并且双侧颈内均为重度狭窄,此次选择右侧经典颈动脉内膜切除术,术后随访双侧颈内血流情况,择期行左侧再狭窄手术治疗。
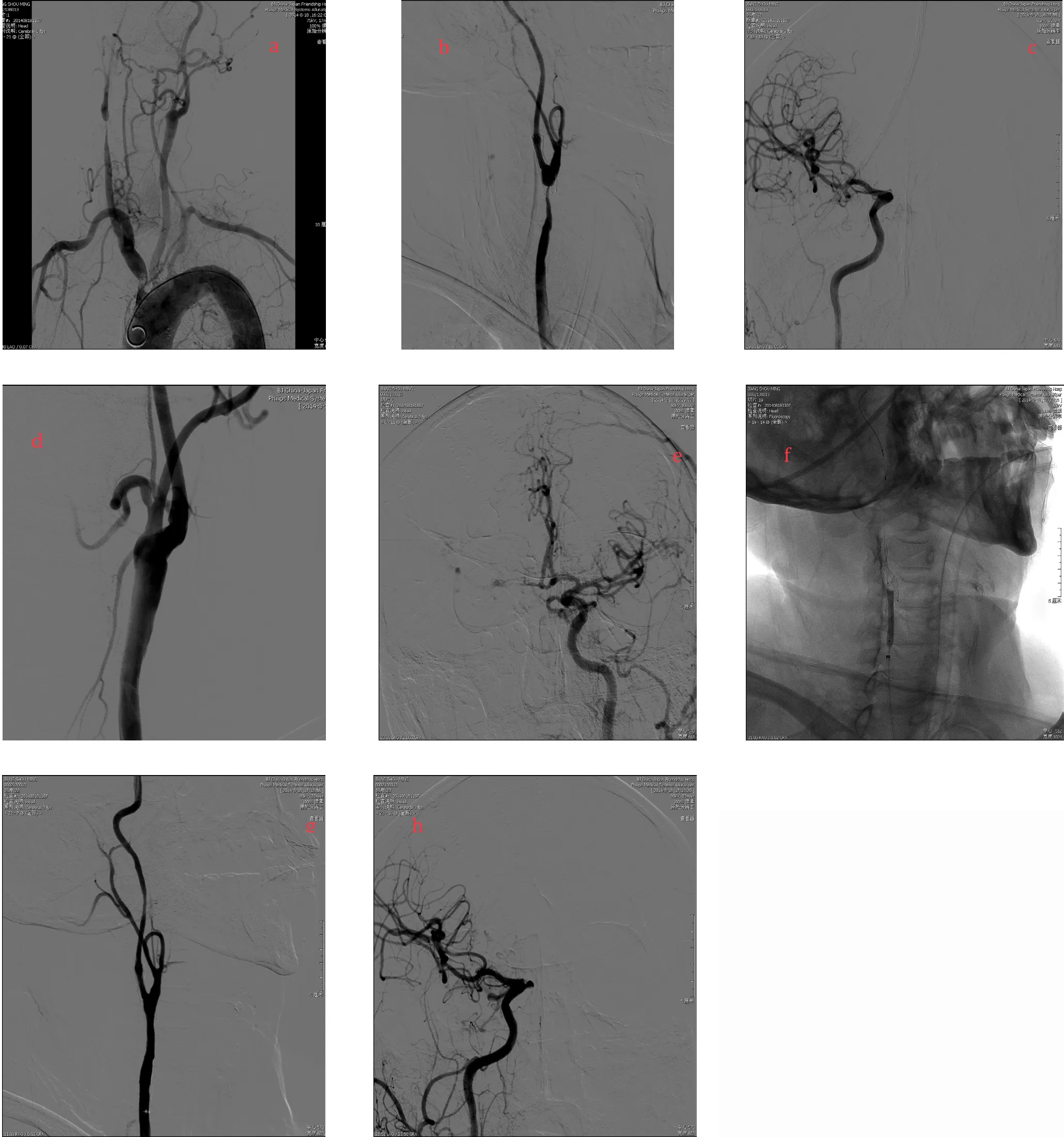
图2 患者,男性,70岁,因右侧颈内动脉狭窄曾行CEA治疗,2个月后因再狭窄行CAS治疗
病例2患者曾经因为颈动脉狭窄行内膜切除手术,是否应用补片不详,经2个月出现再狭窄后行球囊扩张支架置入术(9~30 mm自膨式镍钛合金支架)。入院后检查发现颈总动脉远端、支架近端出现重度再狭窄,而颈内动脉段支架形态及管腔良好,因此选择在颈动脉分叉近侧追加1枚9~30 mm支架,完全覆盖病变。术后PSV减少至110 cm/s。(图2)
病例3为颈动脉支架术后、支架远端重度再狭窄患者,考虑与颈内动脉段支架oversize过大有关,再次介入治疗无法完全打开支架远端,所以选择支架切除及补片成型术,术后发现支架近中段内皮化完善,支架远端开放不良,术后病理提示在增生内膜中有炎性细胞浸润和新生血管形成(图3)。
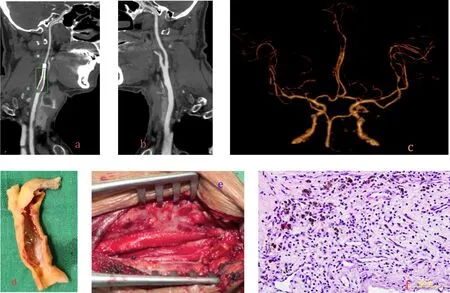
图3 患者 ,男性,76岁,行左侧颈动脉CAS术后2年,因反复头晕发作入院治疗
3 讨论
3.1诊断标准
超声检查是颈动脉狭窄术后随诊的主要方法,具有简便、无创、快捷等优点。主要评价指标为PSV、舒张末期流速(EDV)以及颈内动脉与颈总动脉的比值。颈动脉狭窄患者,ECST的多普勒超声标准为:PSV≥200 cm/s,对应狭窄≥70%;PSV≥300 cm/s,对应狭窄≥80%;PSV≥400 cm/s,对应狭窄≥90%。对接受颈动脉支架植入的患者,由于支架改变了颈动脉分叉部位的顺应性,导致局部血流峰速>自体血管的峰速数值,而颈动脉内膜切除术患者术后血管顺应性与自体血管相似,血流峰速差别不大,所以目前仍然无超声评价颈动脉再狭窄的统一标准。在文献中不同的学者应用不同的超声评判标准[4-6],有学者将颈动脉再狭窄的超声标准定为:PSV>300 cm/s,颈内动脉与颈总动脉比值>3[7]。周伟等[8]以PSV>300 cm/s,EDV>90 cm/s,ICA/CCA>4考虑为支架内狭窄70%,同时指出应用EDV>90 cm/s作为诊断标准的特异性为100%,敏感度达89%。多数学者认为PSV至少达300~350 cm/s,考虑支架内狭窄70%,可以作为支架术后再狭窄灵敏性及特异性较好的指标。
3.2发病率
Setacci等[9]在一项队列研究中报道颈动脉支架术后3.6%患者发生ISR(多普勒超声提示ISR>80%)。Fokkema[10]发现接受CAS治疗组中ISR发生率在12%~43%,明显高于CEA组。SPACE研究中2年再狭窄率为10.7%,与多普勒超声评估标准低有关[11]。在CREST研究[12]中2年后>70%的狭窄在 CAS组为6.0%,CEA组为6.3%,接近真实世界数据。在EVA-3S研究[13]中4年随访发现支架组1.5%再血管化率。SAPPHIRE研究[14]随访2年,CAS组为1.4%靶血管重建率,CEA组为6.1%,2组中患者多数采取再次介入干预。Wolfram等[15]在Pro-CAS研究中显示颈动脉介入术后再狭窄率为2.0%。对特殊颈部条件的患者,例如颈部接受放射性照射的患者,Cam等[16]研究随访发现颈动脉支架术后1年再狭窄率为2.4%,48个月随访再狭窄率为10.8% ,相比于其他人群,这些特殊颈部条件的人群ISR和再次介入干预率高(11% vs 8%),但是没有较高的支架闭塞率和围手术期不良事件发生率。对先前行CEA或者放射性照射的颈动脉狭窄患者行CAS治疗,其发生再狭窄的风险增加[17]。Setacci等[18]在一项5081例患者的回顾性研究中,发现颈动脉CEA术后再狭窄率为1.58%,再次CAS术后再狭窄率为1.67%,表明CEA术后发展为再狭窄的患者容易出现CAS术后再狭窄。
3.3狭窄机制
颈动脉再狭窄的相关病理机制如下[19]:球囊扩张后血管内皮在初始24 h内发生弹性回缩,随后2周内血栓形成,然后发生内膜增生,血管平滑肌细胞迁移和增生以及细胞外基质的积化产生内膜病变而导致管腔狭窄[20]。众多高危因素,例如高血压、吸烟、血脂异常及糖尿病等,在颈动脉狭窄和再狭窄进展中起着极其重要的作用[21]。在后期再狭窄病例报道中也提及了动脉硬化斑块在CAS术后再狭窄的表现[22]。
Wasser等[23]研究发现炎性介质在ISR形成发展过程中起着非常重要的作用,CRPWBC等炎性标记物与临床结局及CAS术后ISR的预测价值,表明了炎性标记物与CAS术后ISR的相关性[24-26]。除此之外,支架的结构(网丝的长度及厚度)也对内膜增生及血管重塑产生一定影响。
依据首次治疗方式,本组再狭窄患者可以分为手术组和支架组,手术组共2例,其中1例患者在行颈动脉内膜切除术后出现再狭窄,经支架植入治疗后再次出现再狭窄,由于首次治疗补片是否应用不详,并且腔内治疗后再次在短期内出现再狭窄,考虑除了内膜增生外,患者本身存在特异性,例如高同型半胱氨酸血症、血清脂蛋白a及血清总胆红素高等。另1例患者之前接受了外翻剥脱手术,远端内膜处理层次以及范围或者术中远端阻断损伤,可能是导致术后出现再狭窄的原因;支架术后再狭窄在本组患者中较多,与国内目前开展的CAS例数多有关,同时与患者的初始病变、医生术中操作习惯、支架的选择有关。有文献表明:颈动脉支架术后残余狭窄和支架植入数量是再狭窄的独立预测因素。
依据狭窄的发生部位可以分为近远端狭窄(Ⅰ型)和中段狭窄(Ⅱ型),支架远端再狭窄在术中发现支架的结构多是挛缩在一起,考虑支架直径与颈内动脉直径不匹配相关,由于国人颈内动脉直径平均在3~4 mm,选择过大的OVERSIZE势必会导致对支架处内膜过度刺激,或者局部支架开放不全引起局部管腔狭窄,近端再狭窄常与覆盖病变不足或者支架贴壁不良有关。而Ⅱ型再狭窄的病因多为内膜增生,部分患者存在特殊因素,例如高同型半胱氨酸血症等。还有文献表明,部分患者后期再狭窄是由于动脉硬化的进展引起,病例3患者术后病理检查结果提示,支架术后修复过程与动脉硬化的过程相似。
3.4治疗方式
针对颈动脉再狭窄患者,美国卒中协会提出[27]:对有症状性颈动脉再狭窄患者,其手术指征应该与原手术适应证相同,对较快进展的再狭窄患者,甚至出现闭塞患者,可以再次行手术治疗。而对无症状性颈动脉再狭窄患者,建议再次行手术治疗的指征也应该与原手术治疗适应证相同。目前关于颈动脉再狭窄患者的治疗方式,包括药物治疗、再次腔内治疗、CEA和支架血管切除以及颈总至颈内动脉搭桥等。西洛他唑作为一种独特的抗血小板药物,同时具有血管扩张作用及抑制血管平滑肌增生的功能。研究表明西洛他唑通过抑制平滑肌细胞增殖效用,可以达到减少CAS术后再狭窄率的效果,但是目前尚缺乏相关随机对照实验证实[28,29]。CEA和血管支架切除术对支架远端病变或者增生斑块突入管腔患者效果显著[22]。在本组患者中85%(6/7)患者接受了支架切除及CEA治疗,围手术期无并发症发生。
再次血管腔内治疗在治疗颈动脉再狭窄的患者中同样有效,例如经皮腔内血管成形术、切割球囊成形术、支架置入及药物涂层球囊血管成形术等[30]。在pro-CAS研究中123例颈动脉再狭窄患者接受了再次介入治疗,无不良事件发生[31]。Ralf等[32]对CAS术后再狭窄患者又一次行介入治疗,住院期间无脑卒中及死亡发生,表明腔内治疗在颈动脉再狭窄患者治疗中的安全性及有效性。但是对支架远端位于颈内动脉部位和对侧闭塞的再狭窄患者,再次介入治疗存在一定的风险,包括在介入过程中急性闭塞、脑缺血和再次支架植入后内膜损伤等,所以本组中病例3、4采取开放手术的处理方式,而病例2狭窄部位位于颈动脉分叉近端,有足够的管径,所以采取再次腔内治疗。
Francesco等[33]回顾分析了颈动脉旁路手术治疗21例重度颈动脉再狭窄患者的资料,发现对CEA术后再狭窄或者CAS-CEA再狭窄患者,旁路手术比再次支架置入有更好的长期通畅率。国内吴鉴今等[34]对21例有症状性颈动脉支架术后再狭窄患者进行报道,所有患者行手术治疗,平均随访(13.2±4.3)个月,除1例因为肺癌死亡外,其余病例无脑卒中或者>50%再狭窄等并发症发生。Boudewijn等[35]报道了15例CEA与CAS术后再狭窄患者,均行CEA和支架移除,中期随访21个月,所有患者术后无头晕、TIA等症状,术后多普勒超声检查无再发≥50%狭窄。
总之,颈动脉狭窄患者治疗后超声随访至关重要,必要时结合CTA或者动脉造影评估再狭窄程度,对有症状性颈动脉再狭窄患者,仍然需要进一步积极干预治疗。目前再次腔内或者开放手术的近期疗效可以接受,远期结果尚不明确。此外,由于患者病变特征及病情差异,治疗方式需要个体化选择。
参考文献
[1]Petty GW, Brown RD, Whisnant JP, et al. Ischemic stroke subtypes: a population-based study of incidence and risk factors. Stroke, 1999, 30: 2513-2516.
[2]Roger VL, Go AS, Lloyd-Jones DM, et al. Heart disease and strokestatistics—2012 update: a report from the American Heart Association. Circulation, 2012, 125: e2-e220.
[3]Gonzalez A, Gonzalez -Marcos JR, Martinez E, et al. Safety and security of carotid artery stentin g for severe stenosis with contralateral occlusion [ J]. Cerebrovasc Dis, 2005, 20 Suppl 2: 123.
[4]Stanziale SF, Wholey MH, Boules TN, et al. Determining in-stent stenosis of carotid arteries by duplex ultrasound criteria. J Endovasc Ther, 2005, 12: 346-353.
[5]Lal B, Kapadia I, Cuadra S, et al. Duplex ultrasound velocity criteria for the stented carotid artery. J Vasc Surg, 2008, 47: 63-73.
[6]Aburahma AF, Abu-Halimah S, Bensenhaver J, et al. Optimal carotid duplex velocity criteria for defining the severity of carotid in-stent restenosis. J Vasc Surg, 2008, 48: 589-594.
[7]Brooks WH, Jones MR, Gisler P, et al. Carotid angioplasty with stenting versus endarterectomy 10-Year randomized trial in a community hospital. JACC, 2014, 7(2):163-168.
[8]Zhou W, Felkai DD, Evans M, et al. Ultrasound criteria for severe in-stent restenosis following carotid artery stenting. J Vasc Surg, 2008, 47: 74-80.
[9]Setacci C, Donato GD, Setacci F, et al. In-stent restenosis after carotid angioplasty and stenting: a challenge for the vascular surgeon. Eur J Vasc Endovasc Surg, 2005, 29: 601-607.
[10] Fokkema M, den Hartog AG, Bots ML, et al. Stenting versus surgery in patients with carotid stenosis after previous cervical radiation therapy: systematic review and metaanalysis. Stroke, 2012, 43: 793-801.
[11] Eckstein HH, Ringleb P, Allenberg JR, et al. Results of the Stent-Protected Angioplasty versus Carotid Endarterectomy (SPACE) study to treat symptomatic stenoses at 2 years: a multinational, prospective, randomised trial. Lancet Neurol, 7: 893-902.
[12]Lal BK, Beach KW, Roubin GS, et al. Restenosis after carotid artery stenting and endarterectomy: a secondary analysis of CREST, a randomised controlled trial. Lancet Neurol, 2012, 11: 755-763.
[13]Trinquart JLM, Leys D, Albucher JF, et al. Endarterectomy versus angioplasty in patients with symptomatic severe carotid stenosis (EVA-3S) trial: results up to 4 years from a randomised, multicentre trial. Lancet Neurol, 2008, 7: 885-892.
[14]Yadav JS, Snead D, Ouriel K, et al. Carotid stenting for the prevention of stroke: 3-year follow-up of the SAPPHIRE trial and US carotid feasibility demonstrates durability of the procedure. The American Journal of Cardiology, 2005, 96: 7A.
[15]Wolfram T,Peter H, Klaus M, et al. A prospective registry of carotid angioplasty and stenting. Stroke, 2004, 35: 2134-2139.
[16]Cam A, Shishehbor MH, Bajaj NS, et al. Outcomes of carotid stenting in patients with previous neck radiation. Catheter Cardiovasc Interv, 2013, 82: 689-695.
[17]Brown KA, Itum DS, Yazan D, et al. Influence of the hostile neck on restenosis after carotid stenting. Ann Vasc Surg, 2015, 29: 9-14.
[18]Setacci F, SirignanoP, Galzerano G, et al. Carotidrestenosis after endarterectomy and stenting: a critical issue? Annals of Vascular Surgery, 2013, 27: 888-893.
[19]Schainfeld RM. Potential emerging therapeutic strategies to prevent restenosis in the peripheral vasculature. Catheter Cardiovasc Interv, 2002, 56: 421-431.
[20]Panyam J, Labhasetwar V. Biodegradable nanoparticles for drug and gene delivery to cells and tissue. Adv Drug Deliv Rev, 2003, 55: 329-347.
[21]Conrad MF, Boulom V, Mukhopadhyay S, et al. Progression of asymptomatic carotid stenosis despite optimal medical therapy. J Vasc Surg, 2013, 58: 128-135.
[22]Tomoji T, Yuji M, Takeshi K, et al. Recurrent subacute in-stent restenosis after carotid artery stenting due to plaque protrusion case report. Neurologia medico-chirurgica, 2009, 49: 413-417.
[23]Wasser K, Schnaudigel S, Wohlfahrt J, et al. Inflammation and in-stent restenosis: the role of serum markers and stent characteristics in carotid artery stenting. PLoS One, 2011, 6(7): e22683.
[24]Rerkasem K, Shearman CP, Williams JA, et al. C-reactive protein is elevated in symptomatic compared with asymptomatic patients with carotid artery disease. Eur J Vasc Endovasc Surg, 2002, 23: 505-509.
[25]Buffon A, Liuzzo G, Biasucci LM, et al. Preprocedural serum levels of C-reactive protein predict early complications and late restenosis after coronary angioplasty. J Am Coll Cardiol, 1999, 34(5): 1512-1521.
[26]Groschel K, Ernemann U, Larsen J, et al. PreproceduralC-reactive protein levels predict stroke and death in patients undergoing carotid stenting. AJNR Am J Neuroradiol, 2007, 28(9): 1743-1746.
[27]Brott TG, Halperin JL,Abbara S, et al. 2011 ASA / ACCF / AHA / AANN / AANS / ACR / ASNR / CNS / SAIP / SCAI / SIR / SNIS /SVM / SVS guideline on the management of patients with extracranial carotid and vertebral artery disease[J]. Circulation, 2011, 124: 489-532.
[28]Hiroshi Y,Nobuyuki S, Yuji M, et al. Periprocedural cilostazol treatment and restenosis after carotid artery stenting: the retrospective study of in-stent restenosis after carotid artery stenting (ReSISteR-CAS). Journal of Stroke and Cerebrovascular Diseases, 2012, 21(3): 193-199.
[29]Tomoji T, Yuji M, Mikito H, et al. Cilostazol reduces restenosis after carotid artery stenting. Journal of Vascular Surgery, 2010, 51: 51-56.
[30]Di Gioia G, Campanale CM, Mega S, et al. Percutaneous treatment of recurrent in-stent restenosis of carotid artery stenting: a case report and state-of-the-art review. Am J Case Rep, 2015, 16: 558-562.
[31]Theiss W, Hermanek P, Mathias K, et al. Predictors of death and stroke after carotid angioplasty and stenting: a subgroup analysis of the Pro-CAS data. Stroke, 2008, 39: 2325-2330.
[32]Ralf Z, Thomas I, Uwe Z. Carotid artery interventions for restenosis after prior stenting: is it different from interventions of denovo lesions? Results from the carotid artery stent (CAS)—registry of the Arbeitsgemeinschaft Leitende Kardiologische Krankenhaus rzte (ALKK). Clin Res Cardiol, 2010, 99: 809-815.
[33]Francesco S, Eugenio M, Francesco S, et al. Carotid bypass: a safe and durable solution for recurrent carotid stenosis. Ann Vasc Surg, 2014, 28: 1329-1334.
[34]吴鉴今,曲乐丰,柏骏,等. 颈动脉支架术后再狭窄的手术治疗. 中华医学杂志,2015,95(24):1902-1905.
[35]Reichmann BL, Laanen JHHV, Vries JPPMD, et al. Carotid endarterectomy for treatment of in-stent restenosis after carotid angioplasty and stenting. J Vasc Surg, 2011, 54: 87-92.
Clinical results analysis for patients with carotid artery severe restenosis after reintervention therapy
LI Jin-yongLIU PengFAN Xue-qiang*YE Zhi-dongWANG FeiYANG Yu-guangLIN FanCHEN JieZHENG Xia ZHEN Ya-nanQIAN Song-yiWANG Feng-lin
Department of Cardiovascular surgery, China-Japan Friendship Hospital, Beijing 100029, China
Abstract:ObjectiveTo evaluate clinical safety and efficacy of surgical and endovascular treatment for carotid artery severe restenosis. MethodsThe symptomatic patients with severe carotid artery restenosis undergoing surgery and endovascular treatment were retrospectively reviewed from July 2011 to June 2015. The patient's disease characteristics were analyzed, the effectiveness of reintervention therapy and perioperative cerebral infarction, myocardial infarction incidence and mortality were assessed. ResultsA total of 7 symptomatic patients with severe carotid artery restenosis receivedreintervention therapy. Initial treatment on 6 patients were carotid artery stenting and 1 patient underwent eversion carotid endarterectomy. Reintervention methods were balloon dilatation and carotid artery stenting under the endbook=18,ebook=22protection device on 1 case and carotid endarterectomyand patch angioplasty on 6 patients. Cerebral ischemic symptoms were all disappeared and without cerebral infarction, myocardial infarction, death within 30 days after procedure. ConclusionReintervention treatment for severe carotid artery restenosis is safe and effective. The specific methods should be individualized depending on characteristics of patients and disease.
Keywords:severe carotid artery restenosis; reintervention; safety; efficacy
*通信作者:樊雪强,E-mail:80367820@qq.com
文章编号:2096-0646.2016.02.01.04

