高效催化剂Ni-CeO2的制备及其对水合肼的催化产氢
马敬环,吴绍斌,刘 莹,赵宝军,康雪婧,胡道友(.天津工业大学环境与化学工程学院,天津300387;2.天津滨瀚环保科技发展有限公司,天津30045)
高效催化剂Ni-CeO2的制备及其对水合肼的催化产氢
马敬环1,2,吴绍斌1,刘莹1,2,赵宝军1,康雪婧1,胡道友1
(1.天津工业大学环境与化学工程学院,天津300387;2.天津滨瀚环保科技发展有限公司,天津300451)
摘要:在常温常压下利用简易的液相还原法合成了高效催化剂Ni-CeO2,该催化剂晶体粒径为21.8 nm,颗粒之间部分粘连,呈絮状分散.相对于纯镍催化剂,氧化铈的加入阻止了镍纳米颗粒的大规模团聚,没有表面活性剂的掩蔽作用,使其暴露出大量的活性位点.考察了镍/氧化铈的比例对催化剂活性的影响,当镍与氧化铈的摩尔比为9∶1时催化剂活性最高;考察了反应体系中的氢氧化钠浓度对催化效果的影响,当氢氧化钠浓度大于等于0.7 mol/L时,该催化剂在70℃下催化降解水合肼时表现出100%的氢气选择性和50.0 h-1的转化频率;在30℃下,依然表现出高达91%的氢气选择性和6.1 h-1的转化频率.
关键词:镍;氧化铈;催化剂;水合肼;储氢材料
第一作者:马敬环(1964—),女,博士,教授,博士生导师,主要研究方为海水淡化及海水综合利用技术及工业污水废水回用技术. E-mail:13920893096@163.com
氢作为一种高能高效清洁的能源,已经引起人们格外的关注.氢能具有四大优势:含能高、能量转化效率高、碳的零排放、可以高密度多样储存[1].然而常温常压下,氢气是一种不稳定的易燃易爆的气体,如何高效安全的储存氢显得尤为重要.水合肼(N2H4·H2O)是无色透明的强碱性液体,氢含量高达12.5%,沸点118.5℃,相对密度1.032 g/cm3,能与水、醇任意混合[2].常压下,在-51.7~120.1℃之间呈稳定液态[2],分解产物是氢气和氮气.氮气是大气层组分,所以,该副产物不会对环境产生负面影响.水合肼的这些特点使其成为非常有应用潜力的化学储氢材料[3].它有2种分解途径:

不完全分解途径(2)会产生对环境有害的氨气,且会导致氢的不完全释放,这种分解途径是要避免的.所以,开发一种廉价、活性高、选择性好的水合肼降解催化剂,对于水合肼作为储氢材料而应用于实际生产生活至关重要[30-31].
2010年,Xu等[4]合成了镍-铱双金属催化剂,该催化剂在室温下表现出催化降解水合肼的相对高活性(转化频率为2.2 h-1)以及对氢气的100%选择性.之后,Xu等[5-6]相继合成了镍-钯、镍-铂双金属催化剂,其中镍-铂催化剂在常温下(25℃)催化降解水合肼100%的氢气选择性及2.8 h-1的转化频率;而镍-钯催化剂的氢气选择性只有82%.一般认为,第二金属的存在改变了镍的电子结构,从而提高了氢气产率[3]. 2014年,He等[7]用铂对负载在氧化铝载体上的镍进行改性,得到镍-铂/氧化铝催化剂,在对水合肼的催化降解反应中,氢气选择性为100%,转化频率提高到了16.5 h-1.上述催化剂都参杂了贵金属(铱、钯、铂),但是贵金属价格昂贵,资源稀少,会大大影响催化剂的经济性和实用性,在一定程度上阻碍了水合肼作为储氢材料在实际商业工业中的应用[1].另外,上述催化剂合成过程中表面活性剂的使用,虽然阻止了纳米颗粒的团聚,却掩蔽了部分活性位点,降低了催化剂活性[8-9].
据报道,一些金属氧化物如氧化铝、氧化铈和氧化镧等可以与金属产生金属-氧化物强交互作用[8],起到分散催化剂颗粒,提高镍催化剂的氢气选择性和转化速率的作用[10-11]. He等[8]发现稀土金属氧化物CeO2修饰的Ni—CeO2催化剂中存在Ni—O—Ce键,这是一种金属-氧化物强交互作用而形成的特殊化学键,它能扰动镍催化剂表面的电子结构,从而提高催化性能.本文利用更简单的液相还原法合成了一系列不同镍/氧化铈比例的催化剂,并研究其对水合肼的催化产氢.
1 实验部分
1.1药品与设备
药品:六水合氯化镍(NiCl2·6H2O,98.0%),七水合氯化铈(CeCl3·7H2O,99.9%),硼氢化钠(NaBH4,98.0%),水合肼水溶液(N2H4·H2O,50%)和氢氧化钠(NaOH,98.0%),以上药品均购自阿拉丁工业公司.
设备:电热鼓风干燥箱,天津汇科仪器设备有限公司产品;磁力搅拌器,巩义市予华仪器有限责任公司产品;恒温磁力搅拌水浴锅,金坛市科普实验仪器厂产品;RINT2000型X射线衍射仪,日本理学公司产品;Kratos AXIS ULTRADLD多功能光电子能谱仪,岛津公司产品;JEM-2100F场发射透射电子显微镜,日本电子株式会社产品.
1.2催化剂制备
合成Nix-(CeO2)10-x催化剂(X = 10,9,8,7,6,5,0),用x /(10-x)表示镍和氧化铈的摩尔比.以合成Ni9-CeO2为例,将0.042 8 g六水合氯化镍(0.18 mmol)和0.007 5 g七水合氯化铈(0.02 mmol)溶于2.0 mL去离子水中,为溶液A;将0.030 0 g硼氢化钠(0.793 mmol)溶于1.5 mL去离子水中,为溶液B.在磁力搅拌下,将溶液A加入到内有溶液B的100 mL双口圆底烧瓶中,溶液迅速变成黑色悬浮液并产生大量气泡. 5 min后,气泡停止产生,制得Ni9-CeO2催化剂,这些悬浮液将用于后面的催化试验.合成各催化剂的药品及其用量如表1所示.

表1 合成各催化剂的药品及其用量Tab.1 Medicines and dosage in synthesis of each catalysts
1.3结构表征
利用RINT2000型X射线衍射仪对催化剂进行物相分析,扫描范围为10°~90°,步长为0.2°,扫描速率为8°/min.
利用JEM-2100F场发射透射电子显微镜对催化剂的微观形貌进行分析,加速电压为200 kV.将金属纳米溶胶直接滴在覆盖着有机膜的铜网上,自然干燥后制得TEM试样.
利用AXIS ULTRADLD多功能光电子能谱仪对催化剂表面元素进行X射线光电子能谱分析(XPS),铝靶X射线源,射线能量为1 486.69 eV,结合能计算用不定碳的C 1 s峰结合能(284.8 eV)为校准值.
1.4性能测试
水合肼的催化降解实验装置图如图1所示.在100 mL双口圆底烧瓶的悬浮液中,含有制备好的纳米催化剂.将烧瓶固定在恒温磁力搅拌水浴锅中,烧瓶的一个口连接气管,另一个口作为注入1.00 mL氢氧化钠(6 mol/L)和0.200 mL水合肼(50%,10 mol/L)的通道.利用量气管排水法监测产生气体的体积.量气管的底端连接盛有水的玻璃瓶.在实验过程中,量气管中水面高度与玻璃瓶中始终持平,产气通过一个内有1 mol/L浓度盐酸的试剂瓶,用于吸收氨气.在磁力搅拌中,水合肼添加到含有催化剂悬浮液的烧瓶中,启动催化反应并开始计时,每2 min记录一次产气体积,直至反应结束.
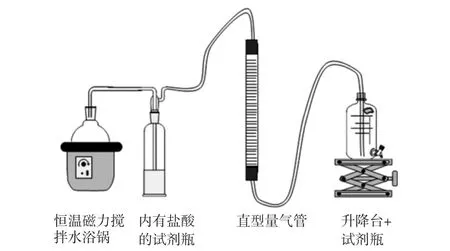
图1 催化实验装置简图Fig.1 Catalytic experimental equipment diagram
1.5计算方法
1.5.1选择性的计算
催化剂的选择性是检验催化剂性能的一项重要指标,它表示催化底物在催化剂的作用下能发生多种反应的反应系统中,同一催化剂促进不同反应的程度的比较.催化剂分解水合肼的氢气选择性(X)的计算方程(3)由水合肼分解方程(1)和(2)计算得出:
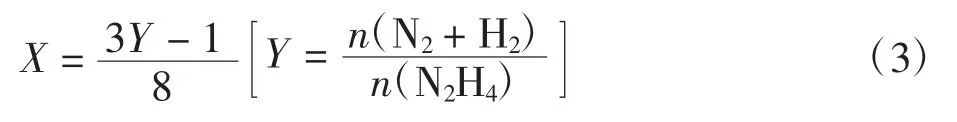
式中:X为催化剂的氢气选择性(%);n(N2H4)为肼的物质的量(mol);n(N2+ H2)为产气(氢气和氮气)的物质的量(mol);Y为n(N2+ H2)与n(N2H4)的比值.
产气中氮气和氢气的物质的量之和用下式计算:

式中:PAtm为室温(25℃)下的大气压(Pa);VN2+H2为产气氮气和氢气的体积(氨气被盐酸吸收)(m3);R为理想气体常数,R=8.314 J/(mol·K);T为绝对温度(K).
1.5.2转化频率的计算
催化剂的转化频率是指在单位时间内单个活性中心转化底物的次数,是催化剂性能的最重要也是最直观的指标.计算催化剂的转化频率(TOF)时,假设镍原子和铈原子都参与催化反应,每个金属原子为一个

式中:TOF为金属原子(镍和铈)对水合肼的转化频率(h-1);nN2H4为50%的肼被转化分解的物质的量(mmol);nNi+Ce为镍原子和铈原子的物质的量之和(mmol);t为转化分解50%水合肼时所用时间(h).
1.5.3镍转化频率的计算
计算催化剂的镍转化频率TOFNi时,假设只有镍原子参与催化反应.活性中心.
诚挚欢迎从事腐植酸行业的各位专家、学者、企业代表、一线科研人员积极投稿,希望通过智慧的碰撞,激发出科技创新的火花,推动腐植酸新产业在建设地球美丽大家园中绽放异彩。

式中:TOFNi为假设只有镍原子参与催化反应时镍的转化频率(h-1).
1.5.4粒径的计算

催化剂的平均晶粒粒径的计算采用Debye-Scherrer公式计算:式中:D为晶粒直径(nm);K为谢乐常数,K = 0.89;λ 为X射线波长,λ= 0.154 056 nm;θ为Bragg衍射角,换成弧度制(rad);β为衍射峰的半峰宽,在计算的过程中,需转化为弧度(rad).
2 结果与讨论
2.1催化剂表征
催化剂的X射线衍射谱图如图2所示.图2显示,Ni和Ni9-CeO2催化剂有3个镍的特征峰:44.5°、51.8°和76.4°,分别对应镍晶体的(111)、(200)和(220)晶面,与Ni(PDF 04-0850)相符合,说明催化剂的晶体构型为镍的面心立方结构[18].从图2中峰型可以看出,利用液相还原法合成的催化剂,掺杂CeO2越多,催化剂晶体粒径越小,结晶度越低,直至变为非晶态,说明CeO2可使金属粒径变小. Ni的X射线衍射谱图上有一些小峰,是由于NaBH4和Ni2+作用生成了少量的B-Ni合金[15].催化剂的平均晶粒大小可以用Debye-Scherrer公式[17]计算得出:

式中:D为晶粒直径;λ为X射线波长;θ为Bragg衍射角;β为衍射峰的半峰宽,计算结果如表2所示.
图3所示为活性最高的Ni9-CeO2催化剂的TEM图片.由于合成过程中没有加入任何表面活性剂,使得纳米颗粒表面暴露,受表面能作用而相互粘连,形成不规则的絮状物,并在其表面暴露出更多的活性位点[9],使其催化活性明显高于其他类型催化剂.

图2 催化剂Nix-(CeO2)10-x(x = 10,9,8,7,6,5,0)的XRD谱图Fig.2 XRD spectra of Nix-(CeO2)10-x(x = 10,9,8,7,6,5,0)catalysts

表2 不同镍-氧化铈比例催化剂的晶粒粒径Tab.2 Crystalline size of catalysts over different ratio of Nickel to Cerium oxide

图3 催化剂Ni9-CeO2的TEM图Fig.3 TEM images of Ni9-CeO2catalyst
图4所示为催化剂Ni9-CeO2的XPS谱图.从图4中看出,Ni 2p3/2的结合能为852.4 eV,与标准Ni0的结合能(852.6 eV)相一致;Ce4+的结合能为881.6 eV,与CeO2中Ce4+的结合能(881.6 eV)相一致[19],这表明催化剂中共存着Ni0和CeO2.同时,通过分峰软件对CeO2的XPS谱图进行分峰,计算得出CeO2中Ce3+/Ce4+的比值高达1.56[20-21],说明催化剂中存在着大量的氧空穴,这些氧空穴会加强金属Ni和氧化物CeO2之间的交互作用,形成一种特殊的Ni—O—Ce化学键[8],这些特殊的化学键可以调整Ni原子的电子特性,从而提高了催化剂的催化活性.此外,图4(a)中有一些Ni2+的小峰出现,这是由于样品在有氧环境中长时间暴露而轻微氧化的结果,这也说明该催化剂的抗氧化性能很好.

图4 催化剂Ni9-CeO2的XPS谱图Fig.4 XPS spectra of Ni9-CeO2catalyst
图5所示为各催化剂的外观形态.

图5 催化剂Nix-(CeO2)10-x(x = 10,9,8,7,6,5,0)在水溶液中的外观形态Fig.5 Morphology of catalystsNix-(CeO2)10-x(x = 10,9,8,7,6,5,0)in aqueous solution
图5显示,纯镍催化剂合成后出现了大规模的团聚,形成了宏观的团状物,这种团聚使得催化剂颗粒之间紧紧贴合,活性表面相互掩蔽,活性位点数量急剧减少;而含有氧化铈的催化剂在水溶液中呈均匀分散状态,大部分活性表面暴露出来,活性位点增加,大大提高了催化剂的催化活性.
2.2催化剂活性评价
在磁力搅拌辅助下,在70℃恒温水浴中测试了各个催化剂降解水合肼的催化性能.由肼分解式(1)和式(2)可知,当n(N2+H2)/n(N2H4)值为3时,肼按照式(1)完全分解,即催化剂的氢气选择性为100%,当n(N2+H2)/n(N2H4)值为1/3时,肼按照式(2)不完全分解,催化剂的氢气选择性为0%.催化反应的产气曲线图如图6所示.
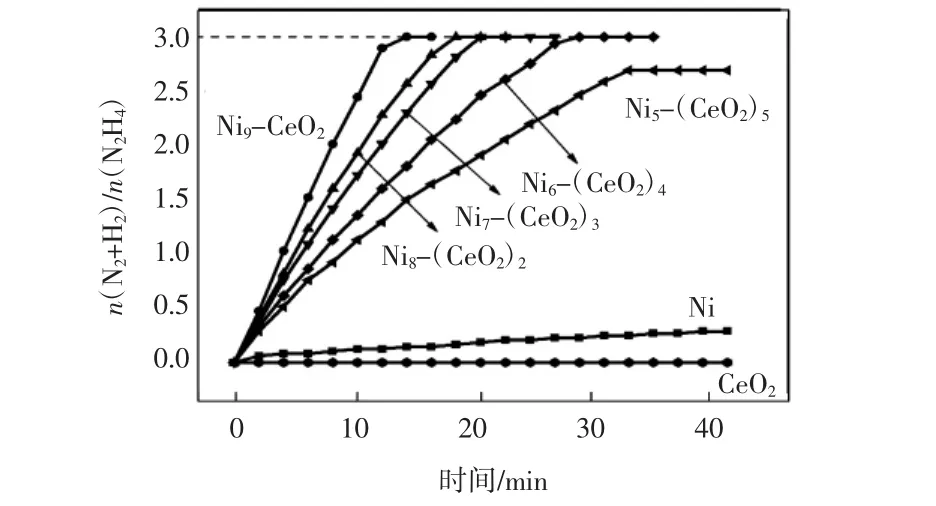
图6 催化剂Nix-(CeO2)10-x(x = 10,9,8,7,6,5,0)催化分解水合肼产气曲线Fig.6 Gas production curve of catalystsNix-(CeO2)10-x(x = 0,5,6,7,8,9,10)catalytic decompose hydrazine hydrate
由图6可知,Ni9-CeO2、Ni8-(CeO2)2、Ni7-(CeO2)3、Ni6-(CeO2)4这4种催化剂的n(N2+H2)/n(N2H4)值为3,氢气选择性高达100%,而Ni催化剂的氢气选择性为3.7%,说明氧化铈的加入完全改变了Ni的催化性能,氧化铈不但分散了催化剂颗粒,防止其团聚,而且通过它本身的氧空穴与金属Ni相互作用,即金属-氧化物强交互作用[22],改变了金属Ni的电子结构,使这种无表面活性剂经济型催化剂Ni9-CeO2分解水合肼拥有100%的氢气选择性和高达50.0 h-1的转化频率.单纯氧化铈对水合肼并没有任何催化分解效果,说明催化剂中活性组分是镍[23].催化剂Nix-(CeO2)10-x的性能如表3所示.
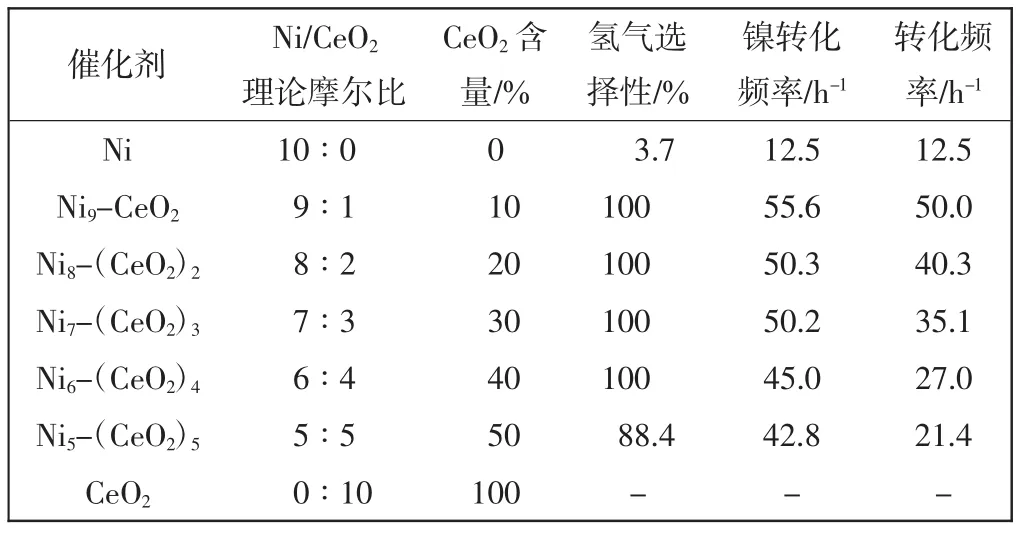
表3 催化剂Nix-(CeO2)10-x(x = 10,9,8,7,6,5,0)催化分解水合肼的性能Tab.3 Performance of catalysts Nix-(CeO2)10-x(x = 10,9,8,7,6,5,0)catalytic decomposehydrazine hydrate
本文考察了Ni9-CeO2催化剂在不同氢氧化钠浓度环境中的催化性能,如图7所示.从图7可以看出,反应溶液中没有加入NaOH时,催化剂的氢气选择性差,且氢气选择性随NaOH浓度的增加而增加.当 NaOH浓度增加至0.713 mol/L时,催化剂的氢气选择性提高至100%,并不再随NaOH浓度的增加而改变.在水溶液中,OH-的存在使催化剂纳米粒子表面呈高碱性,这种表面阻碍了碱性NH3的形成,提高了催化剂的氢气选择性[24];另外,高浓度OH-的存在大大降低了N2H5+的数量,从反应式N2H5++ OH-→N2H4+H2O→N2+2H2+H2O可以看出,N2H5+是水合肼分解为N2和H2相反方向的产物,OH-的大量存在阻碍了水合肼的水解程度,从而提高了催化底物的分解速率[12].因此,氢氧化钠为该经济型高效催化剂的催化水合肼分解反应提供了一个合适的碱性环境,在提高催化剂氢气选择性和肼分解速率两方面作用显著[32].
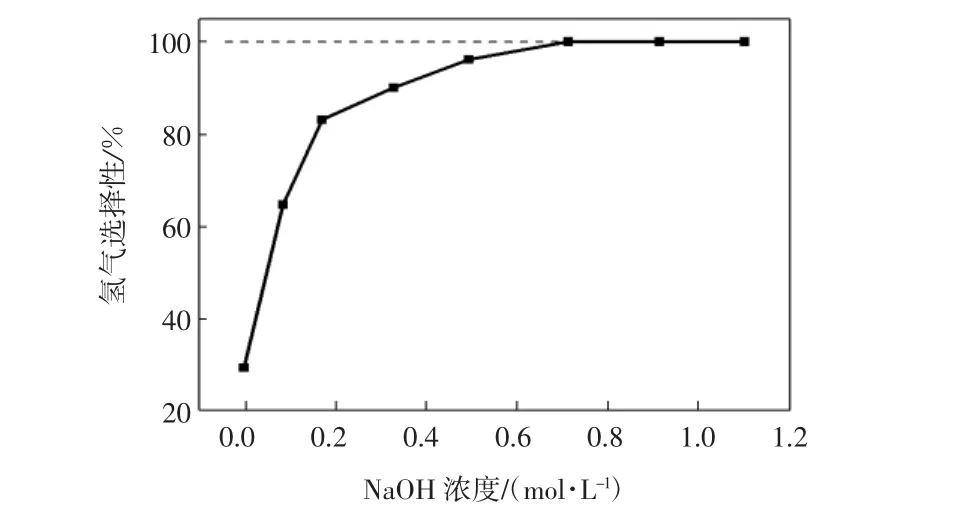
图7 氢氧化钠浓度对催化剂Ni9-CeO2氢气选择性的影响Fig.7 Effect of sodium hydrogen concentration on H2selectivity of catalyst Ni9-CeO2
本文还考察了温度对这种高效催化剂催化降解水合肼性能的影响,如表4和图8所示.

表4 温度对Ni9-CeO2催化性能的影响Tab.4 Effect of temperature on catalytic performance of Ni9-CeO2

图8 不同温度下产气曲线图及Arrhenius点图Fig.8 Gas production curves under different temperature and Arrhenius dot plot
由表4和图8可以看出,催化剂Ni9-CeO2的活化能Ea为45.5 kJ·mol-1(活化能由阿伦尼乌斯公式计算所得),即使在常温(30℃)下,催化剂Ni9-CeO2依然表现出高达91%的氢气选择性和6.1 h-1的转化速率,说明这种利用简单液相还原法合成的廉价金属-氧化物催化剂在常温下仍然可以高效、高选择性分解水合肼产生氢气,这种性能在实际应用中将大大降低能量消耗,在工业生产中减少生产成本,如果应用于氢燃料电池也将节省电池自身能量损耗[25],提高能量输出效率,具有光明的应用前景.
3 结论
在有氧环境中、常温常压情况下,利用简单易操作的液相还原法,不添加任何表面活性剂合成了Ni9-CeO2非贵金属催化剂,利用XRD、XPS、TEM对催化剂进行了表征,并测试了该催化剂在温和条件下(30~70℃)催化降解水合肼的氢气选择性和转化频率,研究表明:
(1)金属镍与氧化铈的摩尔比例为9∶1时,催化剂在催化降解水合肼的性能最高,在70℃下催化降解水合肼的氢气选择性为100%,转化频率为50.0 h-1.
(2)催化剂中活性组分为镍(Ni0),而氧化铈(CeO2)表现出分散和活化催化剂的作用.
(3)相对于单纯金属催化剂,该金属-稀土氧化物催化剂具有一定的抗氧化性,其制备和催化过程不需要提供无氧环境.
(4)氢氧化钠营造的碱性环境,提高了催化降解水合肼的氢气选择性和转化频率.
(5)在常温下Ni9-CeO2非贵金属催化剂依然拥有较高的氢气选择性和催化活性.
(6)该类型廉价高效催化剂在未来的氢气储存、氢燃料电池及清洁能源汽车方面应用前景广阔.
参考文献:
[1] SCHLAPBACH L,ZUTTEL A. Hydrogen-storage materials for mobile applications[J]. Nature,2001,414(2):353-358.
[2] SCHLIEBS R. Hydrazine and Its Derivatives:Preparation,Pro-operties,Applications[M]. Hoboken:Wiley,1985.
[3] YADAV M,XU Q. Liquid-phase chemical hydrogen storage materials[J]. Energ Environ Sci,2012,5(5)9698-9725.
[4] SINGH S K,XU Q A. Bimetallic nickel-iridium nanocatalysts for hydrogen generation by decomposition of hydrous hydrazine [J]. Chem Commun,2010,46:6545-6547.
[5] SINGH S K,XU Q A. Bimetallic Ni-Pt nanocatalysts for selective decomposition of hydrazine in aqueous solution to hydrogen at room temperature for chemical hydrogen storage [J]. Inorg Chem,2010,49(2):6148-6152.
[6] BHATTACHARJEE D,MANDAL K,DASGUPTA S. High performance nickel-palladium nanocatalyst for hydrogen generation from alkaline hydrous hydrazine at room temperature[J]. J Power Sources,2015,287:96-99.
[7] HE L,HUANG Y Q,WANG A Q,et al. Surface modification of Ni/Al2O3with Pt:Highly efficient catalysts for H2generation via selective decomposition of hydrous hydrazine[J]. J Catal,2013,298(2):1-9.
[8] HE L,LIANG B L,LI L,et al. Cerium-oxide-modified nickel as a non-noble metal catalyst for selective decomposition of hydrous hydrazine to hydrogen [J]. Acs Catal,2015,5(1):1623-1628.
[9] WANG H L,YAN J M,LI S J. Noble-metal-free NiFeMo nanocatalyst for hydrogen generation from the decomposition of hydrous hydrazine [J]. J Mater Chem A,2015,3(3):121-124.
[10] HE L,HUANG Y Q,WANG A Q,et al. A noble-metal-free catalyst derived from Ni-Al hydrotalcite for hydrogen generation from N2H4center dot H2O decomposition [J]. Angew Chem Int Edit,2012,51(3):6191-6194.
[11] O S I,YAN J M,WANG H L. Ni/La2O3catalyst containing low content platinum -rhodium for the dehydro genation of N2H4center dot H2O at room temperature[J]. J Power Sources,2014,262(2):386-390.
[12] SINGH S K,SINGH A K,ARANISHI K. Noble-metal-free bimetallic nanoparticle-catalyzed selective hydrogen generation from hydrous hydrazine for chemical hydrogen storage[J]. J Am Chem Soc,2011,133(1):19638-19641.
[13] GAO W,LI C M,CHEN H,et al. Supported nickel-iron nanocomposites as a bifunctional catalyst towards hydrogen generation from N2H4center dot H2O[J]. Green Chem,2014,16 (3):1560-1568.
[14] WANG J,LI Y,ZHANG Y. Precious-metal-free nanocatalysts for highly efficient hydrogen production from hydrous hydrazine[J]. Adv Funct Mater,2014,24(1):7073-7077.
[15] ZHANG J J,KANG Q,YANG Z Q. A cost-effective NiMoBLa(OH)(3)catalyst for hydrogen generation from decomposition of alkaline hydrous hydrazine solution[J]. J Mater Chem A,2013,1(2):11623-11628.
[16] MANUKYANKV,CROSSA,ROUVIMOVS.Low temperature decomposition of hydrous hydrazine over FeNi/Cu nanoparticles[J]. Appl Catala-Gen,2014,476(1):47-53.
[17] PATTERSON A L. The scherrer formula for X-Ray particle size determination[J]. Phys Rev,1939,56(3):978-982.
[18] B D CULLITY. Elements of X-Ray Diffraction[M]. 3rd ed. New York:Prentice Hall,2001.
[19] MOULDER J F. Handbook of X-ray photoelectron spectrosco-py:A reference book of standard spectra for identification and interpretation of XPS data[M]. 2nd ed. Eden Praivie:Physical Electronics,1995.
[20] TROVARELLI A. ChemInform abstract catalytic properties of ceria and CeO2-containing materials [J]. ChemInform,1997,28(1):481-485.
[21] MULLINS D R,OVERBURY S H,HUNTLEY D R. Electron spectroscopy of single crystal and polycrystalline cerium oxide surfaces[J]. Surf Sci,1998,409(3):307-319.
[22] LIAO X,ZHANG Y,HILL M. Highly efficient Ni/CeO2catalyst for the liquid phase hydrogenation of maleic anhydride[J]. Appl Catal a-Gen,2014,488(2):256-264.
[23] HE L,HUANG Y Q,WANG A Q. H2production by selective decomposition of hydrous hydrazine over raney Ni catalyst under ambient conditions[J]. Aiche J,2013,59(1):4297-4302. [24] SINGH S K,XU Q. Complete turnover of hydrous hydrazine to hydrogen at room temperature for chemical hydrogen storage[J]. J Am Chem Soc,2009,131(3):18032-18034.
[25] YAMADA K,ASAZAWA K,YASUDA K,et al. Investigation of PEM type direct hydrazine fuel cell [J]. J Power Sources,2003,115(2):236-242.
[26]冉东凯,储德清.纳米氧化亚铜的制备及其对降解亚甲基蓝的催化性能[J].天津工业大学学报,2010,29(1):60-63. RAN D K, CHU D Q. Preparation of nanocrystalline Cu2O and its catalytic performance for degradation of methylene blue[J]. Journal of Tianjin Polytechnic University,2010,29(1):60-63(in Chinese).
[27]郑淑君.水合肼的发展、现状、展望[J].化学推进剂与高分子材料,2005,3(1):17-21. ZHENG S J. Development,current situation and prospect of hydrazine hydrate[J]. Chemical Propellants & Polymeric Materials,2005,3(1):17-21(in Chinese).
[28]张杰,李丹.水合肼的生产技术及其应用进展[J].化工中间体,2006(3):8-12. ZHANG J,LI D. A review of the production technology and application on hydrazine hydrate [J]. Chemical Intermediate,2006(3):8-12(in Chinese).
[29]吴成一.水合肼脱氢催化剂的设计、合成与性能研究[D].长春:吉林大学,2014. WU C Y. Design, synthesis, and performance investigation of hydrous hydrazine dehydrogenation catalysts[D]. Changchun: Jilin University,2014(in Chinese).
[30]王虹力.水合肼/硼氨制氢用催化剂的合成与性能研究[D].长春:吉林大学,2015. WANG H L. Synthesis and performance investigation of catalysts for hydrogen generation from hydrous hydrazine/ammonia borane[D]. Changchun: Jilin University,2015(in Chinese).
[31]李慧珍,王芃远,陈学年.氨硼烷:一种高性能化学储氢材料[J].科学通报,2014,59(19):1823-1837. LI H Z,WANG P Y,CHEN X N. Ammonia borane: A high capacity chemical hydrogen storage material [J]. Chinese Science Bulletin,2014,59(19):1823-1837(in Chinese).
[32]贺艳斌. N2H4在过渡金属及合金表面吸附和分解的第一性原理研究[D].太原:山西师范大学,2015. HE Y B. First principles investigation of the molecular adsorption and dissociation of hydrazine on the surfaces of transition metals and their alloys[D]. Taiyuan:Shanxi Normal University,2015(in Chinese).
Preparation of efficient catalysts Ni-CeO2and its catalytic hydrogen production from hydrazine hydrate
MA Jing-huan1,2,WU Shao-bin1,LIU Ying1,2,ZHAO Bao-jun1,KANG Xue-jing1,HU Dao-you1
(1. School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China;2. BIN HAN Eco-Technologies Co Ltd,Tianjin 300451,China)
Abstract:A highly efficient catalyst Ni-CeO2is synthesised at room temperature and atmospheric pressure using a simple liquid phase reduction method,the crystal grain size of the catalyst is 21.8 nm,which is a flocculent dispersion in the suspension. Compared with the pure nickel catalyst,the added cerium oxide prevented the agglomeration of nickel nanoparticles,no masking effect of the surfactant leads to a large number of active sites exposed. The influence of the ratio of Ni/CeO2on catalytic activity was investigated,the catalyst has the highest catalytic activity when the molar ratio of nickel and cerium oxide is 9∶1;The influence of the concentration of sodium hydroxide on the catalytic effect in the reaction system was studied,when the concentration of hydrogen sodium is greater than or equal to 0.7 mol/L,the catalyst exhibits catalytic degradation of hydrazine hydrate at 100% of the hydrogen selectivity and 50.0 h-1of turnover frequency at 70℃;At 30℃,the catalyst still exhibits up to 91% of hydrogen selectivity and 6.1 h-1of turnover frequency.
Key words:nickel;cerium oxide;catalyst;hydrazine hydrate;hydrogen storage material
基金项目:国家自然科学基金资助项目(51508384,41373114,51308390)
收稿日期:2015-11-12
DOI:10.3969/j.issn.1671-024x.2016.02.009
中图分类号:TQ246.5
文献标志码:A
文章编号:1671-024X(2016)02-0045-07

