IL-18及趋化因子CX3CL1在慢性胰腺炎大鼠胰腺纤维化中的表达及其意义
陈浩宇 王茜 陈洁
200433 上海,第二军医大学长海医院消化内科
·论著·
IL-18及趋化因子CX3CL1在慢性胰腺炎大鼠胰腺纤维化中的表达及其意义
陈浩宇王茜陈洁
200433上海,第二军医大学长海医院消化内科
【摘要】目的观察IL-18及趋化因子CX3CL1在慢性胰腺炎(CP)大鼠胰腺组织中的表达及其意义。方法雄性Wistar大鼠按分层随机法分为对照组和CP组。采取尾静脉单次注射8 mg/kg体重二丁基二氯化锡(DBTC)造模,对照组注射等容积生理盐水。4周后处死大鼠,取胰腺组织行病理检查并评分,采用免疫组化染色法检测胰腺组织IL-18及CX3CL1蛋白表达。结果造模4周后CP组大鼠死亡2只,存活8只,经病理学检查证实6只大鼠CP造模成功,成功率为60%。CP组大鼠胰腺组织结构异常、腺泡萎缩、纤维化、水肿、炎症细胞浸润评分分别为(2.5±0.4)、(1.9±0.8)、(2.2±0.6)、(0.6±0.4)、(1.8±0.6)分;对照组分别为0、0、0、(0.3±0.4)、0分。CP组大鼠胰腺各项评分均显著高于对照组,差异均有统计学意义(P值均<0.05)。CP组胰腺组织IL-18表达量为35 670±11 878,较对照组的187±134显著升高;CX3CL1表达量为27 416±7 563,亦较对照组的112±598显著升高,差异均有统计学意义(P值均<0.05)。结论CP时胰腺组织高表达IL-18及CX3CL1,两者可能参与CP纤维化的病理过程。
【关键词】胰腺炎,慢性;纤维化;白细胞介素18;趋化因子CX3CL1
慢性胰腺炎(CP)纤维化的过程是机体分泌多种生物因子激活胰腺星状细胞(pancreatic stellate cells, PSC),进而生成大量细胞外基质(extracellular matrix,ECM)沉积在胰腺间质中,最终导致无法逆转的病理性纤维化的过程。IL-18和趋化因子CX3CL1作为重要的炎症因子,参与肝脏、肾脏等重要脏器的病理纤维化过程。胰腺纤维化和肝脏纤维化虽然病因不尽相同,但都以激活PSC为重要病理环节,然而目前关于胰腺纤维化组织IL-18和CX3CL1的表达鲜有研究报道。本研究检测CP大鼠胰腺组织中IL-18与CX3CL1的表达,探讨其与CP纤维化的关系。
材料与方法
一、动物模型制备及分组
雄性Wistar大鼠20只,体重160 g左右,购自第二军医大学动物实验中心,清洁环境饲养2周,体重增至210 g左右。按分层随机法将大鼠分为对照组、CP组,每组10只。二丁基二氯化锡(DBTC)购自Sigma公司,先用无水乙醇溶解DBTC,再与甘油以2∶3比例混合,采用经大鼠尾静脉注射DBTC 8 mg/kg体重方法制备大鼠CP模型[1];对照组注射等容积生理盐水。注射后禁食、水24 h,然后开放饮食,饲养4周。造模后1、2、3、4周测体重。
二、胰腺组织病理检查
造模4周后断颈处死大鼠,取0.3 cm×1 cm的胰腺组织条置于10%甲醛溶液中固定,常规行组织病理学检查。由2位病理学医师读片,并参考van Westerloo等[2]标准从胰腺结构异常、腺泡萎缩、纤维化、水肿、炎细胞浸润5个方面进行病理评分。
三、IL-18、CX3CL1蛋白表达检测
采用免疫组织化学染色法检测IL-18、CX3CL1蛋白表达,以PBS代替一抗作为阴性对照。兔抗鼠IL-18、CX3CL1多抗均购自Abnova公司,工作浓度均为1∶400;通用型IgG购自DAKO公司,最后DAB显色、苏木素衬染、盐酸乙醇分化、烘片、封片。每张切片分别观察3个高倍视野(×400倍)。胞核或胞质内出现棕黄色颗粒为阳性染色,依据不同细胞类型分别进行评分。无染色为0分;浅黄色为1分;浅褐色为2分;深褐色为3分。同时随机选取10个高倍镜视野,通过图像分析软件(Image-proplus-6,美国)测量视野中浅褐色、深褐色细胞的总吸光度的平均值(AOD)。
四、统计学处理

结果
一、CP大鼠生存率、成功率
造模4周后CP组大鼠死亡2只,存活8只,经病理学检查证实6只大鼠CP造模成功,成功率为60%。对照组存活率为100%。
二、大鼠体重变化
对照组大鼠1、2、3、4周的体重分别为(218.0±6.1)、(227.3±5.0)、(243.0±8.5)、(265.1±6.0)g;CP组大鼠分别为(190.0±9.0)、(198.1±6.3)、(209.1±8.7)、(218.1±9.9)g。CP组大鼠体重较同时点对照组大鼠显著降低,差异均有统计学意义(P值均<0.05)。
三、胰腺组织病理变化
CP组大鼠胰腺呈暗黄色,萎缩纤薄,有硬结形成,未见出血坏死灶,肝脏表面可见弥漫性结节,脾大,内脏黄染;镜下见胰腺小叶间及小叶内大量纤维组织增生,腺泡坏死、萎缩并呈空泡样变,大量炎性细胞浸润。对照组大鼠胰腺呈白色,质软,肝脏呈暗红色,质软;镜下未见异常(图1)。

图1 CP组(1A))、对照组(/1B)大鼠胰腺病理变化(HE ×400)
CP组大鼠胰腺组织结构异常、腺泡萎缩、纤维化、水肿、炎症细胞浸润评分分别为(2.5±0.4)、(1.9±0.8)、(2.2±0.6)、(0.6±0.4)、(1.8±0.6)分;对照组胰腺病理评分分别为0、0、0、(0.3±0.4)、0分。CP组大鼠胰腺各项评分显著高于对照组,差异均有统计学意义(t值分别为16.605、6.028、11.619、9.710、7.945,P值均<0.01)。
四、胰腺组织IL-18和CX3CL1蛋白表达
CP组、对照组大鼠胰腺组织IL-18蛋白表达的AOD值分别为35 670±11 878、187.3±133.6;CX3CL1的AOD值分别为27 416±7 563、112±597.7。CP组均显著高于对照组,差异具有统计学意义(t值分别为2.987、3.466,P值均<0.05)。
CP组大鼠胰腺的腺泡细胞、胰管上皮细胞、血管上皮细胞、炎症细胞、胰岛细胞IL-18及CX3CL1蛋白表达量均显著高于对照组胰腺组织,两组差异具有统计学意义(表1,图2、3)。

表1 对照组和CP组胰腺组织各种类型细胞的IL-18、CX3CL1蛋白表达(分,
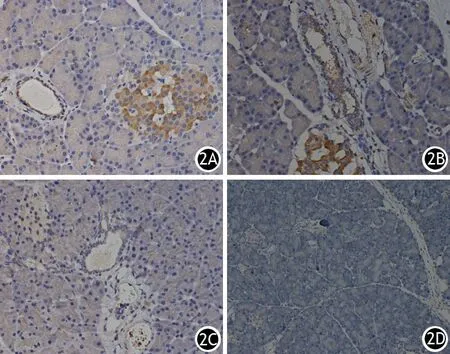
图2 对照组胰腺组织IL-18(2A,2B)、CX3CL1(2C,2D)蛋白表达(免疫组化染色 ×400)
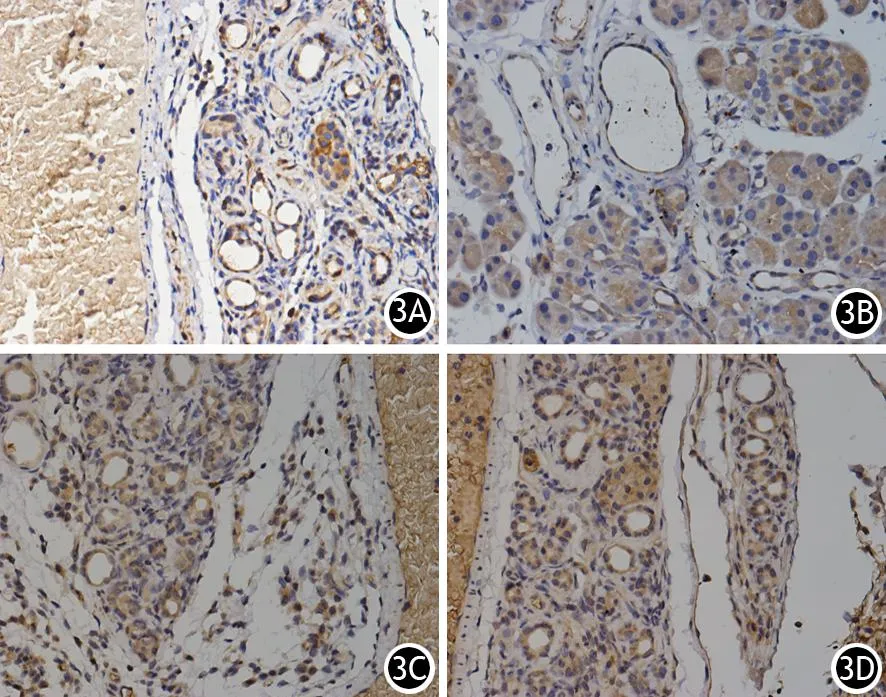
图3 CP组胰腺组织IL-18(3A,3B)、CX3CL1(3C,3D)蛋白表达(免疫组化染色 ×400)
讨论
IL-18是1995年Okamura等[3]在脂多糖诱导的小鼠中毒性休克肝中提取的,结构及信号转导通路类似于IL-1家族,功能上更类似于IL-2家族,具有更强诱导干扰素IFN-γ生成的能力。IL-18主要由单核细胞和巨噬细胞分泌,也在其他细胞、组织广泛表达。在生理情况下部分组织,如小肠上皮、肝脏、脾脏、神经胶质细胞和星形细胞等也可结构性表达IL-18。IL-18最主要的一个生物学功能是可以诱导Th1细胞和NK细胞产生IFN-γ[4]。以往研究表明,IL-18与IL-18受体结合后直接导致IL-1受体相关激酶(IRAK)磷酸化,进而与肿瘤坏死因子受体相关因子6(TRAF-6)形成复合物,激活NF-κB进入核内,与IFN基因启动子中特定的序列结合,激活IFN启动子,进而促进IFN-γ生成,后者又可促进CX3CL1的高表达[5]。
CX3CL1是化学趋化因子CX3C亚家族中独特成员,存在膜结合型和分泌型两种类型,兼有趋化因子和黏附因子功能[6-7]。既往研究认为,介导白细胞迁移的经典途径是整合素依赖性的,即所有趋化因子必须与白细胞表面特定受体通过G-蛋白依赖机制促黏附因子整合素活化才能进一步引起白细胞的黏附和迁移[8]。CX3CL1的趋化因子区域表达在细胞膜外黏蛋白样结构顶部,因它本身就是一种黏附因子,不依赖整合素即可发挥黏附作用。CX3CL1与CX3CR1结合可以增强细胞黏附,促进白细胞透过血管壁向炎症部位迁移。在炎性部位的CX3CL1能诱导活化NK细胞,导致临近的内皮细胞裂解,并促进被捕获的血中CX3CR1阳性细胞向组织内转移,发挥其黏附和迁移作用[9]。 膜结合型CX3CL1在血管内皮细胞表面的表达可以被TNF-β、IL-21、IFN-γ等炎性因子上调,且IFN-γ、TNF-β能协同诱导趋化因子Fractalkine(FKN)的高表达[6-7]。
田轶伦等[10]探讨不同浓度IL-18对人脐静脉内皮细胞FKN表达的影响,结果发现25 μg/L是IL-18调节CX3CL1表达的有效起始浓度,并呈浓度依赖性上调内皮细胞CX3CL1的表达,随着IL-18浓度的升高,内皮细胞对单核细胞趋化作用亦相应增强,而使用CX3CL1中和抗体后单核细胞迁移的数量明显下降,提示IL-18上调CX3CL1表达后能够通过其介导的趋化作用参与炎症反应。王丽敏等[11]在研究阿霉素肾病大鼠时发现,IL-18结合蛋白能特异性结合IL-18,通过降低IFN-γ进而抑制IL-18活性及肾脏纤维化组织中肾血管内皮细胞和肾小管上皮细胞CX3CL1的表达水平。Aoyama等[12]研究发现,CX3CL1通过抑制肝脏Kupffer细胞和巨噬细胞的活化进而抑制肝脏纤维化,且CX3CL1特异性受体是丙型肝炎纤维化的一个高度易感因素[13]。虽然CP和慢性肝炎病因有别,但两者纤维化发生和发展过程有着众多相同之处。
本研究结果显示,CP组胰腺组织IL-18和CX3CL1表达量均显著高于对照组,CP大鼠胰腺中的腺泡细胞、胰腺导管上皮细胞、炎症细胞、胰岛细胞内均有IL-18、CX3CL1的表达,因此可以推测,IL-18和CX3CL1参与了CP纤维化的病理过程。
参考文献
[1]Sparmann G, Merkord J, Jaschke A, et al. Pancreatic fibrosis in experimental pancreatitis induced by dibutyltin dichloride[J]. Gastroenterology, 1997, 112(5): 1664-1672.
[2]van Westerloo DJ, Florquin S, de Boer AM, et al. Therapeutic effects of troglitazone in experimental chronic pancreatitis in mice[J]. Am J Pathol, 2005, 166(3): 721-728.
[3]Okamura H, Tsutsui H, Komatsu T, et al. Cloning of a new cytokine that induces IFN-γ production by T cells[J]. Nature, 1995, 378(6552): 88-91.
[4]刘华锋. 白细胞介素-18 与免疫性肾损伤[J]. 国外医学(泌尿系统分册), 2000, 20(6): 244-246.
[5]Sims JE. IL-1 and IL-18 receptors, and their extended family[J]. Curr Opin Immunol, 2002, 14(1): 117-122.
[6]Yang XP, Mattagajasingh S, Su S, et al. Fractalkine upregulates intercellular adhesion molecule-1 in endothelial cells through CX3CR1 and the Jak-Stat5 pathway[J]. Circ Res, 2007, 101(10): 1001-1008.
[7]Saederup N, Chan L, Lira SA, et al. Fractalkine deficiency markedly reduces macrophage accumulation and atherosclerotic lesion formation in CCR2-/- mice evidence for independent chemokine functions in atherogenesis[J]. Circulation, 2008, 117(13): 1642-1648.
[8]Umehara H, Bloom ET, Okazaki T, et al. Fractalkine in vascular biology from basic research to clinical disease[J]. Arterioscler, Thromb Vas Biol, 2004, 24(1): 34-40.
[9]Yoneda O, Imai T, Goda S, et al. Fractalkine-mediated endothelial cell injury by NK cells[J]. Immunol, 2000, 164(8): 4055-4062.
[10]田轶伦, 姜德谦. 白细胞介素-18 对 Fractalkine 表达和趋化作用的影响[J]. 实用预防医学, 2009, 16(3): 672-675.DOI: 10.3969/j.issn.1006-3110.2009.03.013.
[11]王丽敏, 李春玉, 张佳滨, 等. 分形素趋化因子在肾脏纤维化大鼠肾组织中的表达及 IL-18 结合蛋白对其表达的影响[J]. 中国当代儿科杂志, 2013, 15(12): 1134-1138.DOI:10.7499/j.issn.1008-8330.2013.12.024.
[12]Aoyama T, Inokuchi S, Brenner DA, et al. CX3CL1-CX3CR1 interaction prevents carbon tetrachloride-induced liver inflammation and fibrosis in mice[J]. Hepatology, 2010, 52(4): 1390-1400.
[13]Wasmuth HE, Zaldivar MM, Berres ML, et al. The fractalkine receptor CX3CR1 is involved in liver fibrosis due to chronic hepatitis C infection[J]. J Hepatol, 2008, 48(2): 208-215.
(本文编辑:屠振兴)
IL-18 and CX3CL1 expression and function in the fibrosis of chronic pancreatitis rat
ChenHaoyu,ShenXiangguo,LiZhaoshen,XuCan.DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai, 200433China
【Abstract】ObjectiveTo investigate the expression of IL-18 and CX3CL1 in the tissue of chronic pancreatitis (CP) rat and explore its clinical value. MethodsMale Wistar rats were randomly divided into control group and CP group. CP was induced by dibutyltindich loride (8 mg/kg) injecsion into the tail vein and control group was given equal volume saline solution. The rats were sacrificed 4 weeks later. Pancreatic tissue was harvested for histological examination and immunohistochemical method was used to detected the expression of IL-18 and CX3CL. ResultsAt 4 weeks, 2 in CP group died and 8 survived. 6 rats were histological confirmed as CP and the success rate of mice model was 60%. The score for abnormal structure, acinar atrophy, fibrosis, edema, and inflammatory cells infiltration in rats of CP group was(2.5±0.4),(1.9±0.8),(2.2±0.6),(0.6±0.4),(1.8±0.6)in CP group, but 0, 0, 0,(0.3±0.4), 0 in control group. All the scores were greatly increased compared with controls. IL-18 level in pancreatic tissue was 35 670±11 878 in CP group, which was significantly enhanced compared with (187.3±133.6) in control group (P<0.05). CX3CL1 level was (27 416±7 563) in CP group, which was significantly increased compared with (112±598) in control group (P<0.05). ConclusionsIL-18 and CX3CL1 were over-expressed in pancreatic tissue of CP rats, which may participate in the pathogenesis of pancreatic fibrosis.
【Key words】Pancreatitis, chronic;Fibrosis;Interleukin-18;Chemokine CX3CL1
(收稿日期:2016-02-01)
Corresponding author:Chen Jie, Email: jiechen0115@sohu.com
基金项目:国家自然科学基金(81300352)
通信作者:陈洁,Email: jiechen0115@sohu.com
DOI:10.3760/cma.j.issn.1674-1935.2016.02.009
Fund program:National Natural Sceince Foundation of China(81300352)

