Hippo-YAP信号通路活化参与二甲双胍抑制胰腺癌细胞生长的作用
李映璇 高绥之 苏松 徐茂锦 高军 诸娴 金晶 吴洪玉
200433 上海,第二军医大学长海医院内分泌科(李映璇、徐茂锦、苏松),消化内科(高军、诸娴、金晶、吴洪玉);第二军医大学学员旅(高绥之)
·论著·
Hippo-YAP信号通路活化参与二甲双胍抑制胰腺癌细胞生长的作用
李映璇高绥之苏松徐茂锦高军诸娴金晶吴洪玉
200433上海,第二军医大学长海医院内分泌科(李映璇、徐茂锦、苏松),消化内科(高军、诸娴、金晶、吴洪玉);第二军医大学学员旅(高绥之)
【摘要】目的观察二甲双胍对人胰腺癌PANC1细胞增殖、细胞周期及凋亡的影响,探讨其与Hippo-YAP信号通路活化的关系。方法应用5、10、20、40 mmol/L的二甲双胍分别处理人胰腺癌PANC1细胞24、48、60、72 h,以不加二甲双胍处理的细胞作为对照。采用CCK-8法检测细胞增殖,流式细胞术检测细胞周期和细胞凋亡,实时荧光定量PCR法检测细胞YAP mRNA表达,蛋白质印迹法检测细胞YAP1、磷酸化YAP1(p-YAP1)蛋白表达。结果二甲双胍呈剂量依赖性抑制PANC1细胞的增殖,各组间差异均有统计学意义(P值均<0.01)。二甲双胍抑制PANC1细胞增殖的IC(50)值为20 mmol/L。用20 mmol/L二甲双胍处理细胞48 h后细胞的G1期、S期细胞百分比及YAP1 mRNA表达量、p-YAP1蛋白表达量分别为(77.12±1.22)%、(9.13±0.73)%、4.17±0.37、0.67±0.01;对照组分别为(60.75±1.53)%、(26.97±1.18)%、1.03±0.11、0.17±0.01,两组间的差异均有统计学意义(P值均<0.01)。对照组与二甲双胍处理组细胞的凋亡率分别为(5.65±1.19)%、(9.83±1.36)%,YAP1蛋白表达量分别为0.42±0.00、0.41±0.00,两组的差异均无统计学意义(P值均﹥0.05)。结论二甲双胍可显著抑制人胰腺癌PANC1细胞的增殖,使细胞周期阻滞在G0/G1期,其机制可能与Hippo-YAP信号通路活化有关。
【关键词】胰腺肿瘤;二甲双胍;细胞增殖;细胞凋亡;YAP;信号通路
胰腺癌是常见的消化道肿瘤之一,恶性程度极高,位居癌症相关死亡的第4位[1]。由于起病隐匿,早期诊断困难,多数患者确诊时已发生远处转移,中位生存期仅为4~6个月,预后极差[2]。二甲双胍是治疗糖尿病的一线药物,近年来多项研究证实,二甲双胍有抗肿瘤作用。服用二甲双胍的糖尿病患者较服用其他降糖药物的患者罹患胰腺癌的风险更低[3-4],但其中机制尚未阐明。Hippo通路是一个可调控细胞增殖和凋亡的信号转导通路,Yes相关蛋白(Yes-associated protein,YAP)为Hippo通路的主要效应分子,是一个候选致癌因子。Hippo-YAP 通路的异常与人类肿瘤的发生、发展密切相关[5-6]。本研究应用二甲双胍干预胰腺癌细胞株PANC1,观察其对细胞增殖和凋亡的影响以及 YAP1 基因表达的变化,探索二甲双胍抑制胰腺癌生长的机制。
材料与方法
一、细胞、试剂与仪器
人胰腺癌细胞株PANC1购自中国科学院上海生命科学院细胞资源中心,以含10%胎牛血清(FBS)的DMEM于37℃、5% CO2、湿润无菌的孵箱常规培养、传代;FBS和高糖 DMEM培养液购自美国Gibco公司;二甲双胍粉末和 Cell Counting Kit-8(CCK-8)试剂购自美国 Sigma公司;Trizol及 RT Reagent Kit均购自Takara公司;TaqMan Universal Master Mix Ⅱ购自美国ABI公司;兔抗人YAP1单抗、兔抗人磷酸化YAP1(p-YAP1)单抗和鼠抗人GAPDH(内参)单抗购自美国Abcam公司。实时荧光定量PCR仪为美国罗氏公司产品。
二、CCK-8法检测细胞增殖
收集对数生长期的PANC1细胞,以每孔5×103个细胞接种于96孔板,每孔100 μl,待细胞贴壁后,轻轻吸弃上清液,换入含5、10、20、40 mmol/L二甲双胍的培养基,分别培养24、48、60、72 h,每个浓度每个时间点设3个复孔。以不加药物处理的细胞作为对照组。培养到相应时间时小心吸弃孔内上清液,加入100 μl 含10% CCK-8的无血清培养基,37℃避光孵育1 h。上酶标仪测各孔在波长450 nm处的吸光度值(A450值),以单纯培养液孔调零。细胞抑制率(%)=[1-实验孔A450值/对照孔A450值]×100%。实验重复3次。获取半数抑制浓度(half inhibition concentration,IC50)进行后续实验研究。
三、流式细胞仪测定细胞周期
取对数生长期的PANC1细胞,以每孔5×105个细胞接种于6孔板。待细胞融合至70%~80%,加含20 mmol/L二甲双胍的培养液,以不加药物处理的细胞作为对照组。培养48 h后收集各组细胞,PBS洗涤后加入1 ml 70%预冷乙醇,吹打混匀,4℃固定过夜。次日离心弃乙醇,PBS洗涤后加入500 μl含 50μg/ml溴化乙锭(PI)、100 μg/ml RNase A、0.2% Triton X-100的PBS,轻轻吹打混匀,室温避光反应20~30 min,上流式细胞仪检测细胞周期。实验重复3次,取均值。
四、Annexin V-FITC/PI双染法检测细胞凋亡
取上述二甲双胍处理48 h的细胞及对照组细胞,PBS洗涤后加入5 μl Annexin V-FITC混匀,室温避光反应15 min,2 000 r /min离心,用结合缓冲液洗涤一次,再加200 μl缓冲液悬浮细胞,加入5 μl PI,室温避光放置15 min,上流式细胞仪检测细胞凋亡率。实验重复3次,取均值。
五、荧光实时定量PCR法检测PANC1细胞YAP1 mRNA表达
取上述二甲双胍处理48 h的细胞及对照组细胞,用Trizol抽提细胞总RNA。YAP1上游引物5′-CAGGCAATGCGGAATATCAA-3′,下游引物5′-TGGCTACGCAGGGCTAACTC-3′,产物大小70 bp;内参GAPDH上游引物5′-TGTAGATCTGAACGCTTGTTAATGTG-3′,下游引物5′-GCATCAAAGATGGAAGAGTGAGTGT-3′,产物大小94 bp。引物由上海生工生物工程有限公司设计、合成。先应用反转录试剂盒逆转成cDNA,再行PCR扩增。PCR反应条件: 95℃ 10 min,95℃ 15 s、60℃ 1 min,50个循环。由仪器自带软件获取Ct值,以公式2-△△Ct计算mRNA相对表达量。实验重复6次,取均值。
六、蛋白质印迹法检测 PANC1细胞YAP1、p-YAP1蛋白表达
取上述二甲双胍处理48 h的细胞及对照组细胞,用RIPA裂解液裂解获取蛋白,采用BCA比色法定量蛋白后常规行蛋白质印迹法检测YAP1、p-YAP1蛋白的表达。最后ECL发光,X片曝光、显影、定影。使用Amersham Imager 600分析仪扫描图像,以目的条带与内参条带灰度值比表示蛋白表达量。实验重复3次,取均值。
七、统计学处理
结果
一、二甲双胍对PANC1细胞增殖能力的影响
二甲双胍呈剂量依赖性抑制PANC1细胞的增殖,各组间差异均有统计学意义(P值均<0.01,表1)。二甲双胍抑制PANC1细胞增殖的IC50值为20 mmol/L,故选取20 mmol/L二甲双胍处理细胞48 h进行后续实验。
表1 不同浓度二甲双胍组PANC1细胞增殖的抑制率±s)
二、二甲双胍对PANC1细胞周期的影响
二甲双胍处理组PANC1细胞的G1期和S期细胞所占比例分别为(77.12±1.22)%、 (9.13±0.73)%,对照组分别为(60.75±1.53)%、 (26.97±1.18)%。处理组细胞周期阻滞在G0/G1期,S期缩短,与对照组的差异均有统计学意义(t值分别为8.35、12.83,P值均<0.01)。见图1。

图1 对照组(1A)和二甲双胍组(1B)PANC1细胞的周期变化
三、二甲双胍对PANC1细胞凋亡的影响
二甲双胍处理组PANC1细胞的凋亡率为(9.83±1.36)%,对照组为(5.65±1.19)%,两组间差异无统计学意义(t=2.32,P﹥0.05)。见图2。
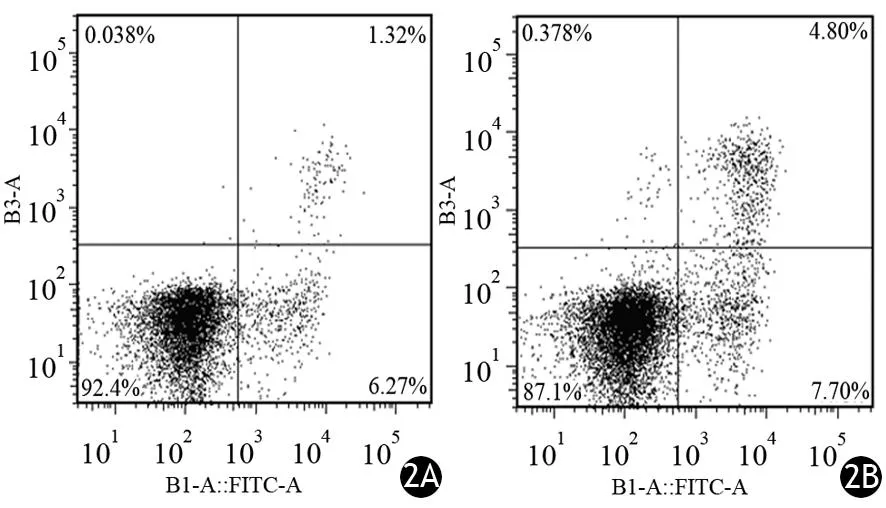
图2 对照组(2A)和二甲双胍组(2B)PANC1细胞凋亡
四、二甲双胍对PANC1细胞YAP1 mRNA表达的影响
对照组、二甲双胍处理组PANC1细胞的YAP1 mRNA表达量分别为1.03±0.11、4.17±0.37,处理组YAP1 mRNA的表达量显著高于对照组,差异具有统计学意义(t=8.06,P<0.01)。
五、二甲双胍对PANC1细胞YAP1、p-YAP1蛋白表达的影响
二甲双胍处理组PANC1细胞的YAP1、p-YAP1蛋白的相对表达量分别为0.41±0.00、0.67±0.01,对照组分别为0.42±0.00、0.17±0.01,两组间YAP1表达水平的差异无统计学意义(t=1.23,P值>0.05),而处理组细胞p-YAP1水平显著高于对照组,差异有统计学意义(t=47.66,P值<0.001)。见图3。

图3 对照组(1)、二甲双胍组(2)细胞YAP1、p-YAP1蛋白表达
讨论
近年研究表明,二甲双胍可抑制乳腺癌、卵巢癌、肺癌、胰腺癌等多种恶性肿瘤的生长[7-9],且联合化疗药物可增强肿瘤细胞对化疗药物的敏感性[10],治疗效果更显著。多项研究报道,二甲双胍可降低糖尿病患者发生胰腺癌的风险[11],通过多种途径抑制胰腺癌的发生[12],但其机制尚未完全明了。因此,本研究以此为着手点展开研究,以期为胰腺癌的早期防治提供一条新思路。
Hippo信号通路是一条抑制细胞生长的信号通路,在维持细胞接触性抑制、增殖/凋亡平衡及调控器官大小等生理过程中发挥重要作用。Hippo信号通路的核心组分包括MST1/2(mammalian Sterile 20-like kinase 1/2)、LATS1/2 (large tumor suppressor gene 1/2)、YAP 、SAV1(Salvador homolog 1)和MOB1(Mob kinase activator 1)[13]。YAP是一个致癌基因,其活性受到磷酸化和亚细胞定位的调控[14],而Hippo通路上的其他几个基因是抑癌基因。Hippo信号通路上游的膜蛋白受体感受到生长抑制信号后,MST1、SAV1、MOB1和LATS1经过一系列磷酸化级联反应,最后磷酸化下游效应因子YAP,磷酸化的YAP滞留在胞质内被降解,不能进入细胞核行使转录激活功能,由此通过抑制YAP的促生长、抗凋亡等功能而维持器官的正常体积。当Hippo通路被抑制,YAP转位到胞核内与多种转录因子结合,如TEADs(transcriptional enhancer associate domain transcription factors)[15],调节下游基因进而促进肿瘤形成。
最近研究证实,Hippo信号通路的激活与G蛋白耦联受体(GPCR)信号调控有关,Hippo信号通路还在组织再生以及干细胞的功能调控上发挥重要作用。二甲双胍可通过削弱干细胞的功能抑制肿瘤生长[12],还可干扰GPCR信号系统与 insulin/IGF-1(insulin-like growth factor-1)轴之间的串扰来抑制胰腺癌细胞的发生[11]。本研究结果显示,二甲双胍可显著抑制胰腺癌PANC1细胞增殖,p-YAP1 蛋白表达显著升高,进一步证实二甲双胍抑制细胞增殖与Hippo-YAP信号通路的激活有关。
细胞增殖与凋亡之间的动态平衡有助于维持机体内环境的稳态和器官的正常体积。除了抑制细胞过度增殖以外,抗癌药物通常还会促进凋亡。本研究结果显示,二甲双胍对胰腺癌PANC1细胞无显著的促凋亡作用,主要通过抑制细胞增殖和阻滞细胞周期发挥生长抑制作用。
参考文献
[1]Jemal A,Siegel R,Ward E,et al. Cancer statistics.2008[J]. CA Cancer J Clin,2008,58(2):71-96.DOI:10.3322/CA.2007.0010.
[2]Berrino F,De Angelis R,Sant M,et al. Survival for eight major cancers and all cancers combined for European adults diagnosed in 1995-99: results of the EUROCARE-4 study[J]. Lancet Oncol,2007,8(7):73-83.
[3]Li D, Yeung SC, Hassan MM, et al. Anti-diabetic therapies affect risk of pancreatic cancer[J]. Gastroenterology,2009,137(4):482-488.DOI:10.1053/j.gastro.2009.04.013.
[4]Wang Z, Lai ST, Xie L, et al. Metformin is associated with reduced risk of pancreatic cancer in patients with type 2 diabetes mellitus: a systematic review and meta-analysis[Z]. Diabetes Res Clin Pract, 2014,106(1):19-26.DOI:10.1016/j.diabres.2014.04.007.
[5]Xie D, Cui J, Xia T, et al. Hippo transducer TAZ promotes epithelial mesenchymal transition and supports pancreatic cancer progression[J]. Oncotarget, 2015,6(34):35949-35963. DOI:10.18632/oncotarget.5772.
[6]Kong D,Zhao Y,Men T,et al. Hippo signaling pathway in liver and pancreas: the potential drug target for tumor therapy[J]. J Drug Target,2015,23(2):125-133.DOI:10.3109/1061186X.2014.083522.
[7]Oliveras-Ferraros C, Cufi S, Vazquez-Martin A, et al. Micro(mi)RNA expression profile of breast cancer epithelial cells treated with the anti-diabetic drug metformin[J]. Cell Cycle,2011,10(7):1144-1151.DOI: 10.4161/cc.10.7.15210.
[8]Rattan R, Giri S, Hartmann LC, et al. Metformin attenuates ovarian cancer cell growth in an AMP-kinase dispensable manner[J]. J Cell Mol Med,2011,15(1):166-178.DOI:10.1111/j.1582-4924.2009.00954.x.
[9]Memmott RM, Mercado JR, Maier CR, et al. Metformin prevents tobacco carcinogen-induced lung tumorigenesis[J]. Cancer Prev Res,2010,3(9):1066-1076.DOI:10.1158/1940-6207.CAPR-10.0055.
[10]Ling S,Feng T,Ke Q, et al. Metformin inhibits proliferation and enhances chemosensitivity of intrahepatic cholangiocarcinoma cell lines[J]. Oncol Rep,2014,31(6):2611-2618.DOI:10.3812/or.2014.3151.
[11]Rozengurt E,Sinnett-Smith J,Kisfalvi K,et al. Crosstalk between insulin/insulin-like growth factor-1 receptors and g protein-coupled receptor signaling systems: a novel target for the antidiabetic drug metformin in pancreatic cancer[J]. Clin Cancer Res,2010,16(9):2505-2511.DOI:10.1158/1078-0432.CCR-09-2229.
[12]Bao B,Wang ZW,Shadan Ali,et al. Metformin inhibits cell proliferation, migration and invasion by attenuating CSC function mediated by deregulating miRNAs in pancreatic cancer cells[J]. Cancer Prev Res,2012,5(3):355-364.DOI:10.1158/1940-6207.CAPR.11-0299.
[13]陈柯宏,王德林. Hippo信号通路核心组分lats1:一种新的肿瘤分子标记和潜在治疗靶点[J]. 中国细胞生物学学报,2015,37(2):256-262.
[14]Zhao B,Li L,Lei Q,et al. The hippo-yap pathway in organ size control and tumorigenesis: an updated version[J]. Genes Dev,2010,24(9):862-874. DOI:10.1101/gad.1909210.
[15]Zhao B,Ye X,Xu J,et al. Tead mediates yap-dependent gene induction and growth control[J]. Genes Dev,2008,22(14):1962-1971.DOI: 10.1101/gad.164408.
(本文编辑:吕芳萍)
Hippo-YAP signaling pathway activation was involved in the inhibitory effect of metformin on the growth of pancreatic cancer PANC1 cells
LiYingxuan,GaoSuizhi,SuSong,XuMaojin,GaoJun,ZhuXian,JinJing,WuHongyu.DepartmentofEndocrinology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
【Abstract】ObjectiveTo investigate the effects of metformin on the proliferation, cell cycle and apoptosis in human pancreatic cancer PANC1 cells, and to explore their relations with Hippo-YAP signaling pathway activation. MethodsPancreatic cancer PANC1 cells were treated with 5, 10, 20, 40 mmol/L metformin for 24 h, 48 h, 60 h, 72 h, respectively. Meanwhile, the PANC1 cells that were not treated with metformin were set as the controls. CCK-8 method was used to examine the proliferation of PANC1 cells. Flow cytometry was used to detect cell cycle and apoptosis, and YAP1 mRNA was detected by real-time fluorescent quantitative PCR, and YAP1 and pYAP1 protein were detected by Western blot, respectively. ResultsTreatment with metformin could observably inhibit the proliferation of PANC1 cells in a dose-dependent manner, and the difference among different groups was statistically significant(all P<0.01).The half inhibition concentration (IC(50)) of metformin was about 20 mmol/L. After treated with 20 mmol/L metformin for 48 h, the proportion of G1 cells and S phase cells, the expression of YAP1 mRNA and p-YAP1 protein was (77.12±1.22)%、(9.13±0.73)%、4.17±0.37、0.67±0.01, while in control group, these were (60.75±1.53)%、(26.97±1.18)%、1.03±0.11、0.17±0.01, and the difference was statistically significant(P<0.01). The apoptosis rate was (5.65±1.19)% vs (9.83±1.36)% and YAP1 protein expression was (0.42±0.00) vs (0.41±0.00). The differences were not statistically significant(all P﹥0.05). Conclusions Metformin could significantly inhibit the proliferation of pancreatic cancer PANC1 cells and lead to G0/G1 phase arrest, in which the activation of Hippo-YAP signaling pathway may be involved.
【Key words】Pancreatic neoplasms;Metformin;Cell proliferation;Apoptosis;YAP;Signal transduction
(收稿日期:2016-02-18)
Corresponding author:Xu Maojin, Email:xumaojinch@126.com;Gao Jun, Email:13816012151@163.com
基金项目:国家自然科学基金(81272663,81472279);上海市教育委员会科研创新基金(13ZZ062)
通信作者:徐茂锦:Email:xumaojinch@126.com;高军:Email:13816012151@163.com
DOI:10.3760/cma.j.issn.1674-1935.2016.02.003
Fund Projects: National Natural Science Foundation of China(81272663,81472279);Scientific Research Innovation Foundation of Shanghai Education Commission(13ZZ062)
共同第一作者:高绥之

