人参皂苷Rg1对局灶性脑缺血再灌注大鼠的神经保护作用
李亮,邓文祥,何军锋,曾光,刘旺华,李花,黄惠勇
·论著·
人参皂苷Rg1对局灶性脑缺血再灌注大鼠的神经保护作用
李亮1,2,邓文祥1,何军锋1,曾光1,刘旺华1,李花3,黄惠勇1
目的:探讨人参皂甙Rg1对局灶性脑缺血再灌注(FCIR)大鼠的神经保护作用。方法:72只大鼠随机分成假手术组、对照组、尼莫地平组(10.8 mg/kg)、人参皂苷Rg1低剂量组(10 mg/kg)、人参皂苷Rg1中剂量组(20 mg/kg)和人参皂苷Rg1高剂量组(40 mg/kg),每组12只。采用大脑中动脉栓塞法制备大鼠FCIR模型。假手术组和对照组给予生理盐水,其它各组则用相应药物连续灌胃14 d。治疗结束后,评定大鼠神经功能,检测顶颞叶皮质金属蛋白酶抑制因子(TIMP1)阳性细胞数及神经细胞凋亡。结果:人参皂苷Rg1各剂量组及尼莫地平组大鼠的神经功能评分明显低于对照组(P<0.05);对照组顶颞叶皮质TIMP1阳性细胞数明显高于假手术组(P<0.01),人参皂苷Rg1各组和尼莫地平组TIMP1阳性细胞数明显高于对照组(P<0.05或<0.01);对照组顶颞叶皮质细胞凋亡率高于假手术组(P<0.01),人参皂苷Rg1各组和尼莫地平组细胞凋亡率明显低于对照组(P<0.05或<0.01)。结论:人参皂苷Rg1可能通过促进TIMP1表达,降低神经细胞凋亡率,进而对FCIR大鼠起到神经保护作用。
人参皂苷Rg1;局灶性脑缺血再灌注;基质金属蛋白酶抑制因子1;细胞凋亡
人参自古誉为“百草之王”,具有补气健脾等功效,为“滋阴补生,扶正固本”之极品。研究表明,人参皂甙Rg1防治大鼠局灶性脑缺血再灌注(focal cerebral ischemia-reperfusion,FCIR)损伤的机制可能与抑制脑组织基质金属蛋白酶(matrix metalloproteinase, MMP)-2、9表达有关[1],但MMPs通过何种机制对FCIR损伤进行神经保护作用尚不明确。研究发现,实现FCIR后神经保护机制,需兼顾基质金属蛋白酶抑制因子(tissue inhibitors of metalloproteinases,TIMPs)与MMPs[2]。本实验采用人参皂苷Rg1干预大鼠FCIR模型,观察人参皂苷Rg1是否通过调节TIMP1表达影响细胞凋亡,进而发挥脑保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年雄性健康清洁级SD大鼠72只(由湖南中医药大学实验动物中心提供),体质量250~280 g,饲养环境温度22℃~25℃,相对湿度50%,自由饮食进水,分笼喂养。
1.1.2 试剂及仪器 人参皂苷Rg1(由湖南中医药大学第一附属医院提供),尼莫地平(购于德国拜耳公司),兔抗鼠TIMP-1多克隆抗体(购于北京中杉金桥公司),细胞凋亡TUNEL原位检测试剂盒(购于南京凯基生物科技发展有限公司)。ChampGel凝胶成像系统(购于美国Bio-Rad公司),振动切片机(购于德国徕卡公司),尼龙栓线(购于北京西浓科技有限公司)。
1.2 方法
大鼠随机分为6组:假手术组、对照组、尼莫地平组(10.8 mg/kg)、人参皂苷Rg1低剂量组(10 mg/kg)、人参皂苷Rg1中剂量组(20 mg/kg)和人参皂苷Rg1高剂量组(40 mg/kg),每组12只。假手术组和对照组给予生理盐水,其余各组均于手术后给予相应药物灌胃,1次/d,连续14 d。
1.2.1 大脑中动脉栓塞模型制备 参照Longa等[3]模型制备方法并加以改良:大鼠以10%水合氯醛(4 mL/kg)腹腔注射麻醉,仰卧位固定。暴露左侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA),距离CCA分叉约5 mm处将ECA结扎剪断,动脉夹夹闭CCA和ICA。在ECA靠断端结扎处剪一小口,将头端包被有5~6 mm硅橡胶的尼龙栓线 [栓线直径0.26 mm,包被硅橡胶一段直径(0.36±0.02)mm]插入,到达CCA分叉处时将ECA拉向下方,使之与ICA走向一致。逐渐将栓线缓慢进入ICA,直达大脑中动脉。插入深度距离CCA分叉处约1.8~2 cm。阻断血流1.5 h后,拉出栓线制成再灌注模型。假手术组只将栓线插至CCA分叉处。(造模后对照组死亡2只,尼莫地平组死亡1只,人参皂苷Rg1低剂量组死亡2只,人参皂苷Rg1中剂量组死亡1只,人参皂苷Rg1高剂量组死亡2只)。
1.2.2 神经功能评分 采用Longa 5级评分法评定大鼠神经功能:0分,无功能障碍;1分,右侧前肢不能前伸;2分,向右侧转圈爬行或向右的推挡阻力减弱;3分,向右侧倾倒,或提起鼠尾向左侧旋转;4分,无自主活动伴意识障碍。
1.2.3 脑片的制备 灌胃14 d后,将各组存活大鼠再次麻醉,开胸灌注固定,快速取脑。在视交叉和大脑后极处各做一冠状切面,弃两头,留中间部分用502胶竖立粘于振动切片机的样品托上,5 min后将样品托固定于盛满PBS的切片台中,确保标本全部浸泡于PBS中。调整刀片角度至18°,通过控制台调整刀片前进速度为0.5 mm/s,振幅2 mm,切片厚度30 μm,选择自动切片。将所有脑片收集于24孔板中,用于免疫组化和TUNEL染色检测。
1.2.4 免疫组化检测TIMP1表达 将脑片用3%H2O2去离子水孵育10 min,PBS冲洗2 min×3次,加入一抗兔抗鼠TIMP1(按1∶100稀释)37℃孵育2 h,PBS冲洗5 min×3次,加Polymer Helper 37℃孵育20 min,PBS冲洗2 min×3次,加二抗羊抗兔IgG 37℃孵育30 min,PBS冲洗2 min×3次,DAB显色。切片于光镜下400倍放大观察,每只大鼠取4张切片,每张切片随机选择5个视野计数TIMP1阳性细胞数。细胞浆或细胞核着色呈棕黄色为阳性细胞。
1.2.5 TUNEL染色检测细胞凋亡 将切片加入1%Triton X-100通透液5 min室温促渗,PBS清洗5 min× 3次;3%过氧化氢封闭10 min,PBS清洗5 min×3次;滴加 TdT酶反应液 37℃避光反应1 h,PBS清洗5 min×3次;Streptavidin-HRP 37℃避光反应30 min,PBS清洗5 min×3次;DAB显色,复染,观察神经元凋亡情况。凋亡细胞结果判定:细胞核中有棕黄色颗粒者为阳性细胞,即凋亡细胞。计数方法:每只大鼠取4张切片,每张切片随机选择5个视野于光镜下200倍放大观察,每个视野计数阳性细胞占总细胞的比例,取平均值代表该张切片的细胞凋亡率。
1.3 统计学处理
采用SPSS 17.0统计软件分析数据,计量结果以(均数±标准差)表示,组间比较采用单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肢体神经功能评分比较
模型制备完成后,各组大鼠清醒后即刻出现霍纳征,右前肢瘫痪,致爬行时向右侧转圈,提尾悬空时对照组大鼠均出现右前肢内收、头向右向背方向扭曲。药物干预14 d后对照组的评分显著高于假手术组(P<0.01);人参皂苷Rg1各剂量组及尼莫地平组的评分低于对照组(P<0.05),但高于假手术组(P<0.01),见表1。
2.2 各组大鼠TIMP1蛋白表达比较
免疫组化结果显示,对照组顶颞叶皮质TIMP1阳性细胞数明显高于假手术组(P<0.01),人参皂苷Rg1各组和尼莫地平组TIMP1阳性细胞数明显高于对照组(P<0.05或<0.01),见表1、图1。
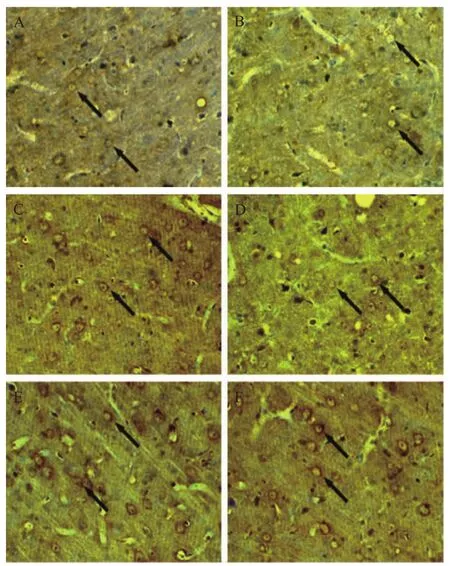
图1 各组顶颞叶皮质TIMP1表达(免疫组化染色,×400)
表1 各组大鼠肢体神经功能评分、TIMP1阳性细胞数、细胞凋亡率比较()
注:与假手术组比较,①P<0.01;与对照组比较,②P<0.05,③P<0.01
组别 只数 神经功能评分 T I M P 1阳性细胞数(个) 细胞凋亡率(%)假手术组 1 2 0 5 . 7 2 ± 2 . 7 8 1 . 9 3 ± 0 . 3 2对照组 1 0 3 . 2 5 ± 0 . 6 4① 1 2 . 9 3 ± 3 . 9 6① 6 5 . 3 2 ± 1 0 . 3 4①尼莫地平组 1 1 2 . 1 3 ± 0 . 2 8①② 2 7 . 8 6 ± 5 . 4 5①③ 4 2 . 3 5 ± 1 3 . 3 5①③人参皂苷R g 1低剂量组 1 0 2 . 8 9 ± 0 . 3 5①② 2 3 . 6 6 ± 4 . 8 4①② 5 2 . 1 3 ± 1 1 . 1 8①②人参皂苷R g 1中剂量组 1 1 2 . 6 5 ± 0 . 1 5①② 2 7 . 1 2 ± 6 . 3 2①③ 4 8 . 9 3 ± 9 . 8 6①③人参皂苷R g 1高剂量组 1 0 2 . 3 4 ± 0 . 2 0①② 2 5 . 3 6 ± 3 . 8 6①③ 4 4 . 5 6 ± 1 4 . 3 2①③
2.3 各组大鼠细胞凋亡比较
TUNEL染色结果显示,对照组顶颞叶皮质细胞凋亡率高于假手术组(P<0.01);人参皂苷Rg1各组和尼莫地平组细胞凋亡率明显低于对照组(P<0.05或<0.01),高于假手术组(P<0.01),见表1、图2。
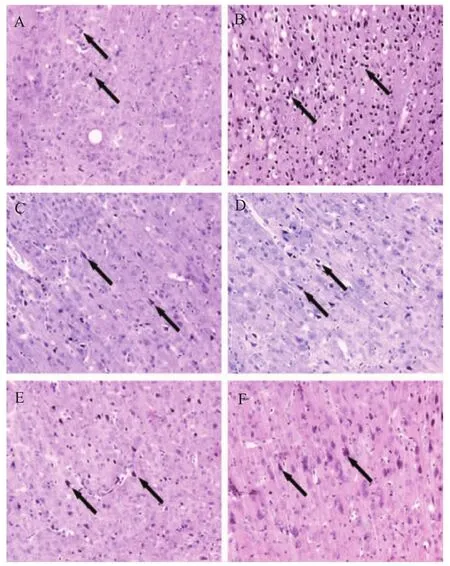
图2 各组细胞凋亡检测(TUNEL染色,×200)
3 讨论
人参作为药用已有几千年的历史,对中枢神经系统具有双向调节作用。人参皂苷Rg1是人参的主要提取物之一,也是临床应用的主要药理活性成分,具有抗氧化、抗衰老、减轻神经功能损伤的作用[4]。研究显示,人参皂苷Rg1能抑制细胞内Ca2+超载,减少星形胶质细胞的活性氧产生[5],上调缺血脑组织的神经元特异性烯醇化酶(neuron-specific enolase,NSE)表达[6],抑制受损脑组织中一氧化氮(nitric oxide,NO)的过量产生,从而减轻FCIR损伤后的神经功能障碍,增加海马CA1区锥体细胞存活数,对脑缺血神经元起到保护作用[7]。
本实验采用线栓法制备左侧大脑中动脉栓塞模型,模拟FCIR的发生,模型大鼠梗死区主要位于左侧顶颞叶等部位。由于使用了订制的线栓,规格统一,同时线栓前端包被了一段硅橡胶,降低了刺破血管的几率,并能较为彻底地堵塞大脑中动脉的起始部。因此,造模过程中动物死亡率低,可形成稳定的脑缺血区域。本实验结果显示,缺血再灌注后对照组的左侧大脑顶颞叶区域可检测到较多凋亡细胞,人参皂苷Rg1不同剂量(10、20、40 mg/kg)均能减少神经细胞损伤后的凋亡,实现其神经保护作用。目前研究认为人参皂苷Rg1抗神经凋亡具体机制涉及MAPK通路[8]。MAPK通路主要通过ERK1/2、JNK、p38活化和NF-κB的激活促进MMP-9、MMP-2的表达,抑制TIMP的表达,参与脑缺血再灌注损伤[9,10]。MMPs参与所有细胞外基质(extracellular matrix,ECM)的调节。TIMP1是MMPs的特异性内源性抑制剂,主要通过氨基酸功能区的半胱氨酸残基与活化MMPs的锌离子活性中心相结合,来阻断MMPs与底物结合,防止ECM降解,使用TIMPs可能成为防治脑缺血再灌注损伤的有效途径之一[11,12]。因此,TIMP1表达升高在脑缺血再灌注损伤后神经保护过程中发挥重要作用[13]。
本研究发现大鼠FCIR后,对照组脑组织TIMP1升高,顶颞叶区神经细胞凋亡率增高;药物干预组TIMP1明显升高,神经细胞凋亡率降低,但尼莫地平组与人参皂苷Rg1中、高剂量组相比以上指标差异无统计学意义。因此,人参皂苷Rg1能上调TIMP1表达,降低神经细胞凋亡率,实现其神经元的保护作用。然而,人参皂苷Rg1发挥这一作用的具体机制尚需进一步验证。
[1]包翠芬,刘霞,魏嘉,等.人参皂甙Rg1对脑缺血-再灌注大鼠基质金属蛋白酶2和9表达的影响[J].中国脑血管病杂志,2009,6:88-92.
[2]Mazumder MK,Bhattacharya P,Borah A.Inhibition of matrix metalloproteinase-2 and 9 by Piroxicam confer neuroprotection in cerebral ischemia:an in silico evaluation of the hypothesis[J].Med Hypotheses,2014,83: 697-701.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[4]胡文涛,闫秋月,方瑜,等.人参皂苷Rg1参与诱导小鼠多潜能干细胞的研究[J].神经损伤与功能重建,2014,9:184-186.
[5]Sun C,Lai X,Huang X,et al.Protective effects of ginsenoside Rg1 on astrocytes and cerebral ischemic-reperfusion mice[J].Biol Pharm Bull,2014, 37:1891-1898.
[6]崔荣太,蒲传强,王培福,等.人参皂甙Rg1对局灶性脑缺血大鼠脑组织神经元特异性烯醇化酶表达的影响及其意义 [J].临床神经病学杂志,2007,20:122-124.
[7]王巧云,吴峰阶.人参皂苷Rg1对局灶性脑缺血再灌注大鼠脑组织NOS活性及蛋白表达的影响 [J].中国病理生理杂志,2011,27: 2328-2332.
[8]Guo RB,Wang GF,Zhao AP,et al.Paeoniflorin protects against ischemia-induced brain damages in rats via inhibiting MAPKs/NF-κB-mediated inflammatory responses [J].PLoS One,2012,7:e49701.doi:10. 1371/journal.pone.0049701.
[9]Maddahi A,Ansar S,Chen Q,et al.Blockade of the MEK/ERK pathway with a raf inhibitor prevents activation of pro-inflammatory mediators in cerebral arteries and reduction in cerebral blood flow after subarachnoid hemorrhage in a rat model[J].J Cereb Blood Flow Metab,2011,31: 144-154.
[10]Wang S,Wei H,Cai M,et al.Genistein attenuates brain damage induced by transient cerebral ischemia through up-regulation of ERK activity in ovariectomized mice[J].Int J Biol Sci,2014,10:457-465.
[11]Maddahi A,Chen Q,Edvinsson L.Enhanced cerebrovascular expression of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 via the MEK/ERK pathway during cerebral ischemia in the rat[J]. BMC Neurosci,2009,10:56.doi:10.1186/1471-2202-10-56.
[12]Wu Y,Wang YP,Guo P,et al.A lipoxin A4 analog ameliorates blood-brain barrier dysfunction and reduces MMP-9 expression in a rat model of focal cerebral ischemia-reperfusion injury[J].J Mol Neurosci,2012,46: 483-491.
[13]Adamczak JM,Schneider G,Nelles M,et al.In vivo bioluminescence imaging of vascular remodeling after stroke[J].Front Cell Neurosci,2014,8: 274.doi:10.3389/fncel.2014.00274.
(本文编辑:王晶)
Neuroprotective Effect of Ginsenoside Rg1 on Focal Cerebral Ischemia-Reperfusion Rats
LI Liang1,2,DENG Wen-xiang1,HE Jun-feng1,ZENG Guang1,LIU Wang-hua1,LI Hua3,HUANG Hui-yong1.1. Provincial Key Laboratory of TCM Diagnostics,Hunan University of Chinese Medicine,Changsha 410007,China; 2.Department of Human Anatomy,Hunan University of Chinese Medicine,Changsha 410208,China;3.Department of Neijing,Hunan University of Chinese Medicine,Changsha 410208,China
Objective:To explore the neuroprotective effect of Ginsenoside Rg1 on focal cerebral ischemia-reperfusion(FCIR)rats.Methods:Totally 72 rats were randomly divided into 6 groups:sham-operation group,control group,Nimodipine group(10.8 mg/kg),Ginsenoside Rg1 low dose group(10 mg/kg),Ginsenoside Rg1 medium dose group (20 mg/kg),and Ginsenoside Rg1 high dose group (40 mg/kg),with 12 rats in each group.The FCIR model was performed with the method of middle cerebral artery occlusion.The sham-operation and control groups were given normal saline,while other groups received corresponding medication by intragastric administration for 14 days.After the treatment,the neural function was assessed,and numbers of positive cells representing tissue inhibitors of metalloproteinases1 (TIMP1)and ratio of cell apoptosis in the parietal and temporal cortex were detected.Results:Compared with the control group,scores of neural function were decreased remarkably in all Ginsenoside Rg1 groups and Nimodipine group(P<0.05).Numbers of TIMP1-positive cells in the parietal and temporal cortex of the control group was significantly higher than that in the sham-operation group(P<0.01).Compared with the control group,numbers of TIMP1-positive cells increased remarkably in all theGinsenoside Rg1 groups and Nimodipine group(P<0.05 or<0.01).Ratio of cell apoptosis in parietal and temporal cortex of the control group was significantly higher than that in the sham-operation group (P<0.01).Compared with the control group,ratio of cell apoptosis was decreased remarkably in all the Ginsenoside Rg1 groups and Nimodipine group (P<0.05 or<0.01). Conclusion:Ginsenoside Rg1 may promote the expression of TIMP1,thus decrease the ratio of cell apoptosis and finally improve the neural function in FCIR rats.
ginsenoside Rg1;focal cerebral ischemia-reperfusion;tissue inhibitors of metalloproteinase 1 (TIMP1);cell apoptosis
R741;R741.05
A DOI 10.16780/j.cnki.sjssgncj.2016.02.001
1.湖南中医药大学中医诊断学湖南省重点实验室长沙 410007 2.湖南中医药大学人体解剖学教研室长沙 410208 3.湖南中医药大学内经教研室长沙 410208
国家自然科学基金(No.81302899,813 73551,81202632);湖南省教育厅科学研究项目重点项目(No.60010408);教育部博士点基金(No.201243231200 03);
湖南省自然科学基金(No.13JJ3097);湖南省中医药科研计划项目(No.2013111)
2015-07-02
黄惠勇huanghy68@126. com

