大鼠胫神经损伤后远侧端髓鞘和轴索再生的研究
冯思航,冯登殿
大鼠胫神经损伤后远侧端髓鞘和轴索再生的研究
冯思航1,冯登殿2
目的:探讨大鼠胫神经损伤时远侧端髓鞘和轴突的再生速度。方法:大鼠54只,建立神经原位桥接动物模型,其中36只大鼠用于荧光示踪注射,根据缝合口神经远端荧光示踪剂注射点位置不同,分为10 mm组和30 mm组各18只,分别于术后4、8、12周三个时间点进行处理,每组每个时间点6只;其他18只大鼠用于髓鞘染色,分别于术后4、8、12周三个时间点进行处理。结果:术后8、12周,10 mm和30 mm组的L3~L6脊神经节内有荧光标记细胞,30 mm组明显少于10 mm组,有显著性差异(P<0.01);术后8、12周,患侧的损伤神经远侧端有大量排列有序的有髓神经纤维,10 mm组与30 mm组间差异无统计学意义(P>0.05)。10 mm和30 mm组术后8、12周的胫神经运动神经传导速度高于术后4周,有显著性差异(P<0.01);术后各时间点,患侧的胫神经运动神经传导速度均低于正常对照(健侧),有显著性差异(P<0.01)。结论:大鼠胫神经损伤后远侧端髓鞘和轴索生长速度不一致。
神经再生;髓鞘;轴索;神经元;大鼠
周围神经损伤中,断裂和缺损最常见,且修复效果不佳。如何修复神经损伤、促进损伤神经尽快再生,成为目前基础和临床神经外科领域研究的热点[1]。周围神经损伤后失神经支配的肌肉在伤后第2周即可出现一些生化方面的改变,数周内肌纤维出现萎缩,一些小肌肉萎缩得更快,并出现纤维化,6周后运动终板将逐渐发生退变乃至消失[2],皮肤感觉减退,这将直接影响伤后神经修复,对于神经再生也增加了难度,成为后期器官功能恢复不良的原因之一,即所谓失神经骨骼肌不可逆萎缩。
近20年来,人们进行许多修复神经的实验研究,采用许多术式,如端端吻合、端侧吻合、“π”式桥接、导管桥接、自体、异体移植、非神经组织移植、雪旺式细胞种植、干细胞种植修复缺损及促神经生长用药。在显微外科最多见是端端缝合,除损伤神经再生纤维数量有限外,单纯的外科操作也难以做到相应神经功能束正确对接,可导致再生神经错向生长,这又可以是造成器官功能恢复不良或困难的又一因素。目前诊断和评价周围神经损伤和再生程度的方法有多种,最常用的是电生理检测,神经再生的电生理评价结果与临床神经功能恢复存在较大差异[3]。为了观察电生理诊断神经损伤和评价神经再生与实际神经功能恢复不相符的原因,进一步揭示失神经肌萎缩的本质,本研究采用原位桥接术式制备动物模型,应用肌电检测手段、神经追踪、神经髓鞘染色方法[4],结合多点定位检测(未见报道),分别观察神经纤维中的髓鞘、神经纤维中的轴索的再生数量、质量,分析髓鞘和轴索再生速度是否同步一致。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 Wistar大鼠54只,雌雄不拘,体质量180~220 g,购于南方医科大学动物中心,制备神经原位桥接动物模型。其中36只大鼠用于荧光示踪注射,根据缝合口神经远端荧光示踪剂注射点位置不同,分为10 mm组和30 mm组各18只,分别于术后4、8、12周三个时间点进行处理,每组每个时间点6只;其他18只大鼠用于髓鞘染色,分别于术后4、8、12周三个时间点进行处理。
1.1.2 主要试剂与仪器 荧光示踪剂(true blue,TB,购于美国Sigma-Aldich公司);髓鞘染色剂Luxol快蓝MBS(由上海化学试剂公司进口分装);4000型肌电图检测仪(购于丹麦丹迪公司);HMIAS-2000型图像分析仪(购于武汉千屏公司);Axioskop 2 plus荧光显微镜(购于德国Zeiss公司);SXP-LB手术显微镜(购于上海医用光学仪器厂);CM1900恒冷箱切片机(购于德国Leica公司)。
1.2 方法
1.2.1 手术方法 神经原位桥接动物模型制备:将大鼠用0.4%戊巴比妥钠(1 mL/kg)行腹腔注射麻醉,在无菌条件下行右臀斜切暴露出右侧坐骨神经,于梨状肌下缘5 mm处在放大10倍的手术显微镜下分离胫、腓总神经,切取胫神经长约8 mm,造成缺损,然后原位用10-0可吸收显微外科缝线行外膜缝合,两断端分别均匀缝合3针,尽量保持神经外膜完整,对位准确,不扭曲成角,伤处内置长效青霉素粉剂,最后用1-0丝线依次缝合肌肉皮肤。对照组在麻醉后同样暴露左侧坐骨神经,但不切断神经,术后分笼饲养。
1.2.2 检测项目 ①荧光剂示踪:10 mm、30 mm组分别于术后4、8、12周用微量注射器将0.2%10 μL荧光示踪剂缓慢注入神经缝合口远端10 mm处或远端30 mm处胫神经干内,注射点外垫塑料薄膜留针15 min,注射后用凡士林封闭72 h后处死。②电生理检测:18只用于髓鞘染色的大鼠,分别于术后4、8、12周用刺激信号强度为0.9 mA、波宽0.1 ms方波的肌电图检测仪,测量胫神经的运动传导速度,以健侧为正常对照。在切取标本前先游离出实验侧的胫神经,然后将刺激电极置于缝合口近端的神经干上,在小腿三头肌处插入记录电极进行测量。③髓鞘染色:18只大鼠于术后4、8、12周进行电生理检测后,分别在缝合口远侧10 mm、30 mm处切取神经组织,采用Luxol快蓝MBS髓鞘染色法进行染色,脊神经节每例标本取5张切片,每组共30张进行计数。
1.2.3 取材 选择制备成功的动物模型,肉眼观察足底无明显溃疡,小腿三头肌较饱满的神经组织进行取材。处死各组大鼠,0.4%戊巴比妥钠腹腔注射麻醉,生理盐水经心脏主动脉灌注冲洗,4%多聚甲醛0.1 mol/L,磷酸盐缓冲液(pH值7.2)灌注固定,后固定2 h,荧光示踪切取L3~L6脊髓节段的背根神经节置于20%蔗糖内4℃冰箱内过夜,再行恒冷箱切片,片厚40 μm,贴于铬明胶片上,进行荧光标注的切片直接在镜下阅片拍照,进行髓鞘染色的切片,分别在缝合口远侧10 mm、30 mm处切取神经组织;进行髓鞘染色切片的动物,处死前进行电生理检测。
1.3 统计学处理
2 结果
2.1 神经荧光示踪
术后4周,10 mm、30 mm组的脊神经节内有荧光标记细胞,30 mm组少于10 mm组(P<0.01,图1A,表1);术后8周,10 mm、30 mm组的脊神经节内荧光标记细胞数增多,30 mm组的荧光标记细胞数远远少于10 mm组(P<0.01,图1B、C,表1);术后12周,30 mm组的荧光标记细胞数少于10 mm组(P<0.01),10 mm、30 mm组的荧光标记细胞数均明显多于术后8周(图1D、E,表1)。
表1 2组术后各时间点脊神经节荧光标记的神经元数(个,)
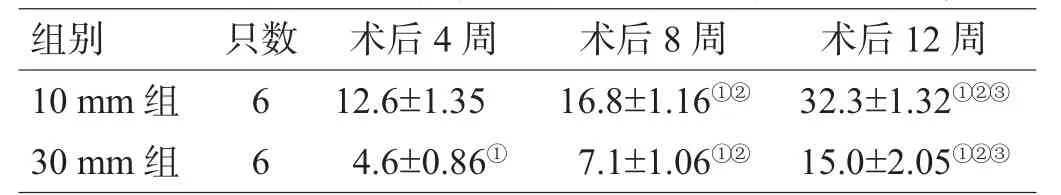
表1 2组术后各时间点脊神经节荧光标记的神经元数(个,)
注:与10 mm组比较,①P<0.01;与术后4周比较,②P<0.01;与术后8周比较,③P<0.01
组别 只数 术后4周 术后8周 术后1 2周1 0 m m组 6 1 2 . 6 ± 1 . 3 5 1 6 . 8 ± 1 . 1 6①② 3 2 . 3 ± 1 . 3 2①②③3 0 m m组 6 4 . 6 ± 0 . 8 6① 7 . 1 ± 1 . 0 6①② 1 5 . 0 ± 2 . 0 5①②③
2.2 髓鞘染色
术后4周,10 mm组可见少量深染和较多的淡染有髓神经纤维(图2A),30 mm组缝合口远端各点组织像呈现部分深染,部分髓鞘明显淡染(图2B);术后8、12周,30 mm组远端各段吻合口以远的髓鞘染色加深,髓鞘轮廓较清晰,排列较整齐,单位面积内有髓神经纤维数减少不明显,部分髓鞘呈塌陷状或变形现象,神经外膜、束膜、内膜完整清晰可辨(图2C、D)。术后8、12周,30 mm组的神经纤维数多于术后4周,有显著性差异(P<0.01);术后12周,10 mm组和30 mm组的神经纤维数与术后8周比较差异均无统计学意义(P>0.05);术后8、12周,10 mm、30 mm组之间差异无统计学意义(P>0.05),见表2。

图1 术后各时间点10 mm、30 mm组荧光标记细胞(荧光神经示踪,×400)
表2 各组有髓神经纤维计数()
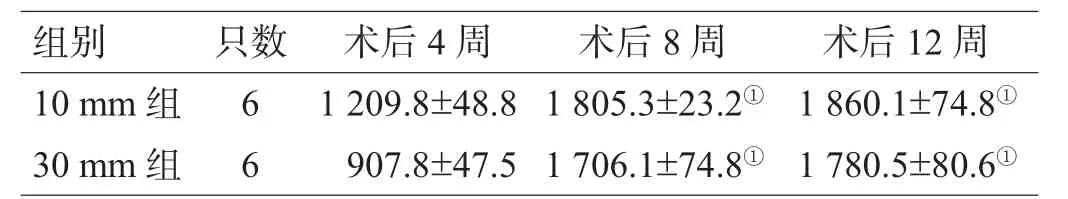
表2 各组有髓神经纤维计数()
注:与术后4周比较,①P<0.01
组别 只数 术后4周 术后8周 术后1 2周1 0 m m组 6 1 2 0 9 . 8 ± 4 8 . 8 1 8 0 5 . 3 ± 2 3 . 2① 1 8 6 0 . 1 ± 7 4 . 8①3 0 m m组 6 9 0 7 . 8 ± 4 7 . 5 1 7 0 6 . 1 ± 7 4 . 8① 1 7 8 0 . 5 ± 8 0 . 6①
2.3 神经电生理检测
患侧术后8、12周的胫神经运动神经传导速度高于术后4周,有显著性差异(P<0.01),术后8周和12周之间比较差异无统计学意义(P>0.05);术后各时间点,患侧的胫神经运动神经传导速度均低于正常对照(健侧),有显著性差异(P<0.01),见表3。
表3 胫神经运动神经传导速度(m/s,)

表3 胫神经运动神经传导速度(m/s,)
注:与正常对照比较,①P<0.01;与术后4周比较,②P<0.01
组别 只数 4周 8周 1 2周正常对照 6 4 8 . 1 6 ± 4 . 0 1 4 9 . 3 3 ± 3 . 4 7 5 0 . 3 8 ± 3 . 8 9患侧 6 1 3 . 6 1 ± 4 . 1 2① 4 0 . 1 4 ± 4 . 0 4①② 4 3 . 5 ± 3 . 7 2①②
3 讨论
3.1 远侧端神经损伤后髓鞘轴索再生过程
神经损伤,尤其中枢神经损伤难以再生,但外周神经损伤是可以再生的,这主要与施万细胞的作用有关[5,6]。神经损伤后,其远侧段神经会发生一系列特异性改变,即Wallerian变性[7,8],原有神经纤维崩解,同时处于静态的施万细胞即进入增殖相开始分裂,分泌各种神经营养因子和细胞外基质及黏附因子,并诱导和参与巨噬细胞进入损伤处,协助施万细胞进入损伤的神经处,帮助施万细胞吞噬、清除髓鞘及轴突溃变的残余物和碎屑,同时有活性的施万细胞促进基底膜形成连续的Schwann管,为轴突再生提供支持通道,引导其生长方向做前期准备[9,10],此时的近段轴突由断端处向后退缩,轴膜在断端处生长并封盖断端,从而阻止轴浆外流,并在近断端处轴突明显形成膨大的回缩球,其内堆杂着各种细胞器、神经丝、囊泡和线粒体等,在回缩球表面长出大量的轴突枝芽,实现终末神经再生并沿着Schwann管向神经的远端段生长。
本研究显示,损伤神经的远侧端神经外膜、束膜、内膜和基膜轮廓仍保持完整,术后4周,在缝合口远段神经内出现许多深染的髓鞘,术后8、12周,有髓神经纤维数量明显增多,数量上无差别,患侧与健侧髓鞘染色相比明显淡染部分髓鞘在染色过程中容易塌陷变形,提示神经髓鞘恢复较快,但施万细胞功能未完全恢复到正常状态,其有髓神经纤维数也未达到健侧水平。在神经移植后的修复过程中,只有施万细胞从近端游走并进入移植神经节段,轴索才能通过移植段进行再生。因此,施万细胞分裂和髓鞘形成在轴索的再生过程中起着关键、不可代替的作用[11],但有髓纤维数量和质量完全恢复到正常水平可能是很困难的。
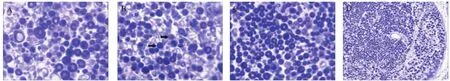
图2 术后2组各时间点髓鞘观察(Luxol快蓝MBS髓鞘染色)
3.2 再生神经电生理改变和轴浆流转运之间的关系
神经突触传递分为化学性传递和电传递两类,前者的信息传递媒介物是神经递质,而后者的信息传递媒介物为局部电流,化学传递是通过神经纤维内轴索的轴浆流途径完成,而电传递则是通过神经纤维的髓鞘,从一个朗飞结向另一个朗飞结呈跳跃式快速传导的途径完成神经冲动的传递。电传导可通过电生理检测,电生理被认为是一种灵敏和较准确的定量方法,也是目前临床上最常用的诊断传导功能的手段[12,13],反映髓鞘电传导通路的建立及恢复程度。本研究观察到电生理指标已恢复到约60%~80%。反映化学传递检测常用神经示踪方法,本研究采用是荧光示踪,荧光剂被广泛应用于神经追踪以研究神经通路,荧光能被神经末梢和轴索摄取通过轴浆顺、逆双向运输到所在感觉、运动神经细胞胞体中[14,15],与神经纤维中微管、微丝和各种膜细胞器等密切相关,一旦神经纤维失去连续性,荧光剂就无法从远端被运送到近端神经内而聚集在细胞体中。所以神经再生的有力证据,就是轴浆流是否能通过缝合口。结果发现,在缝合口远端10 mm、30 mm处,分别注射荧光剂,在相应的脊髓节段的脊神经节内,出现一定数量的强、中、弱阳性细胞,说明此时轴索再生已通过缝合口而长入神经远段内,同时也说明轴索已具有轴浆流的运转能力。本研究中还发现,在缝合口远侧30 mm处注射的荧光剂和在10 mm处注射的荧光剂相比较,30 mm处注射部位在脊神经节内的标记细胞较少,中、弱阳性细胞较多,说明部分轴索还没有长到更远段。由于不能对荧光摄取进行定量估计,就无法对神经轴浆流的转运进行较准确的定量比较。
3.3 电生理与临床功能评价的分析
在许多神经修复的研究中发现,神经再生的电生理评价结果与临床神经功能恢复存在较大差异[3]。本研究发现,髓鞘的功能恢复过程中见髓鞘在神经再生早期恢复相对较快,在8周和12周,10 mm组和30 mm组之间有髓神经纤维计数差异无统计学意义(P>0.05),在患侧8周与12周之间运动神经传导速度差异无统计学意义(P>0.05),说明电生理结果与神经纤维中的髓鞘数关系密切,而在神经示踪的实验结果中见8周与12周相比,有显著性差异(P<0.01),提示示踪剂转运缝合口的量有限或不完全,这说明轴索再生跨越缝合口的数量有限,而且跨越缝合口的轴索也不能全部抵达神经末梢或者神经-肌接头而建立化学传导通路,提示髓鞘与轴索生长速度不一致。总之,外周神经损伤恢复是一个复杂的问题,外周神经恢复质量的实验评估,尚有待进一步研究。
[1]吴林清,殷超,景尚斐,等.周围神经损伤后修复再生的研究进展[J].中华临床医师杂志(电子版),2014,8:1338-1341.
[2]沈鸿斌,苑福升,张巨,等.大鼠去神经支配骨骼肌及运动终板的形态学变化[J].吉林大学学报(医学版),2006,32:87-89.
[3]Goldberg MD,Sharad S,Deshpande,et al.Disparity between neurophysiologic measurements and clinical reality following peripheral nerve transaction and microneuroaphy[J].Surg Forum,1984,35:608-610.
[4]顾兵,金建波,李华南,等.神经组织染色方法的研究概况 [J].中国药理学通报,2011,10:1472-1475.
[5]Zhang YG,Sheng QS,Qi FY,et al.Schwann cell-seeded scaffold with longitudinally oriented micro-channels for reconstruction of sciatic nerve in rats[J].J Mater Sci Mater Med,2013,24:1767-1780.
[6]Sulaiman OA,Gordon T.Role of chronic Schwann cell denervation in poor functional recovery after nerve injuries and experimental strategies to combat it[J].Neurosurgery,2009,65:A105-A114.
[7]Rotshenker S.Wallerian degeneration:the innate-immune response to traumatic nerve injury[J].J Neuroinflammation,2011,8:109-109.
[8]Martin SM,O'Brien GS,Portera-Cailliau C,et al.Wallerian degeneration of zebrafish trigeminal axons in the skin is required for regeneration and developmental pruning[J].Development,2010,137:3985-3994.
[9]Krick K,Tammia M,Martin R,et al.Signaling cue presentation and cell delivery to promote nerve regeneration[J].Curr Opin Biotechnol,201l,22: 741-746.
[10]Gordon T.The physiology of neural injury and regeneration:The role of neurotrophic factors[J].J Commun Disord,2010,43:265-273.
[11]Vrbova G,Mehra N,Shanmuganathan H,et al.Chemical communication between regenerating motor axons and Schwann cells in the growth pathway[J].Eur J Neurosci,2009,30:366-375.
[12]何旭,张元信,屈志刚,等.神经电生理检查在评价大鼠坐骨神经缺损修复中的作用[J].实用医药杂志,2013,30:1097-1098.
[13]Ross MA.Electrodiagnosis of peripheral neuropathy[J].Neurol Clin, 2012,30:529-549.
[14]涂桂花,梁尚栋.神经轴浆运输的功能与疾病研究进展[J].神经解剖学杂志,2013,29:94-98.
[15]Kuznetsov AV.Coupling a dynein transport model with a model of anterograde and retrograde transport of intracellular organelles[J].Int comm Heat Mass Transfer,2011,38:833-837.
(本文编辑:王晶)
Remyelinatin and Axonal Regeneration of Distal Stumps Following Tibial Nerve Transection in Rats
FENG Si-hang,FENG Deng-dian.1.Department of Dermatology,Shenzhen Children's Hospital,Shenzhen 518038,China;2.Department of Central Laboratory,Shenzhen Shajing People's Hospital of Guangzhou Medical University,Shenzhen 518104,China
Objective:To investigate the speed of the regeneration of the medullary sheath and axonsof distal stumps following tibial nerve injury in rats.Methods:An autogenous nerve transplantation model was created in 54 rats,and the fluorescent tracer injection was performed in 36 rats.According to the distance between the injection location and repair site of the distal stumps,the rats were divided into 10 mm group and 30 mm group (18 rats in each group).The other 18 rats were used formedullary sheath staining.Observation was conducted at postoperative weeks 4,8,and 12.Results:At weeks 8 and 12,fluorescent-labeled-cells in the L3~L6dorsal root ganglia in the group 30 mm were evidently fewer than those in the group 10 mm(P<0.01).At weeks 8 and 12,both the 10 mm and 30 mm groups showed a large number of well-ordered myelinated nerve fibers at the distal stumpof the injured nerves.There was no significant statistic difference between the two groups(P>0.05).The conduction velocity of the tibial motor nerve at weeks 8 and 12 was faster than that at week 4 in the group 10 mm and 30 mm(P<0.01). The conduction velocity of the tibial motor nerve in the experimental groups was lower than that of the normal control at every postoperative points(P<0.01).Conclusion:The regeneration rates of the medullary sheath and axon in distal stumps were different following tibial nerve transaction in rats.
nerve regeneration;medullary sheath;axon;neuron;rats
R741;R741.02
A DOI 10.16780/j.cnki.sjssgncj.2016.02.003
1.深圳市儿童医院皮肤科深圳518026
2.广州医科大学深圳沙井人民医院中心实验室深圳518104
2015-06-24
冯思航1.31@163.com

