基于学生为主体的“协进课堂”教学设计
徐新峰

摘要:以“课题3溶液的浓度(第1课时)”为例,呈现“协进课堂”的设计理念,即基于学生为主体,调动各类积极教学因素相互协作,通过学生的主动参与进行解惑,在师生互动、生生合作探究中完成知识体系的构建。
关键词:学生主体;协进课堂;学习方式
文章编号:1008—0546(2016)07—0076-03
中图分类号:G633.8
文献标识码:B
doi:lO.3969/j.issn.1008—0546.2016.07.027
一、背景
“协进”即协作共进,和谐成长。“协进课堂”是师生和谐成长的课堂教学模式,既突出了学生的主体地位,同时也强调了教师的主导角色,理顺教学关系,让各类教学因素协作起来,为学生的可持续发展和教师的专业成长提供保障的课堂。
笔者应南通市教科研中心之邀,参加了江苏省海门市能仁中学教育集团“百花奖”教学活动,并执教了人教版初中化学下册九单元“课题3溶液的浓度(第1课时)”的示范课,起到了很好的教学效果,同时也受到了南通化学教育同行的一致好评。本节课的设计着力体现了“协进课堂”理念,基于学生为主体,调动各类积极教学因素相互协作,通过学生的主动参与进行解惑,在师生互动、生生合作探究中完成知识体系的构建。在设计中,我运用下列策略突出了以学生为主体的教学理念,即:问题(设疑与激疑)、交流(理解与沟通)、协作(互助与竞争)、展示(表达与思考)、倾听(尊重与信任)、构建(体验与归纳)。
二、教学片断及意图
1.片断一:探究有色溶液的颜色深浅与
有关
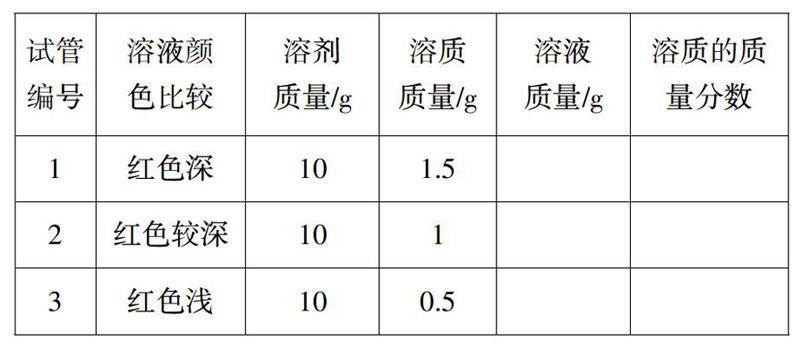
师:请同学们观察老师手上的三支试管中的红糖溶液颜色有何不同,并作出猜想,这与什么有关?(在试管架上事先放有三支试管,分别装有颜色深浅的红糖溶液)
生:红色有深有浅,这与溶液的浓度有关。
师:看来“浓度”一词,对大家并不陌生。请同学们查阅课本,看看溶液浓度的表达方式如何?(停顿,学生阅读)
生:可用溶质的质量分数表示。(同理,这位同学到黑板上书写溶质的质量分数计算公式,其他同学在笔记上书写,整理出的公式如下。)
师:请各位同学先自主设计实验方案,来证明你的猜想:有色溶液的颜色深浅与溶液的浓度有关,然后在小组内交流。(巡视,并参与多个合作小组的交流)
生1:取等质量的3种溶液,蒸干水分后,比较得到3份红糖的质量大小。
生2:另取等质量的水,加入不同质量的红糖,溶解后比较颜色的深浅。
生3:对试管3中的溶液继续加入红糖,观察颜色的变化。(试管3是红色最浅的溶液)
师:从实验的简单易做角度思考,同学们选择哪种方案?请一位同学到前面来完成实验。
生(齐声):第3个。(一名同学在讲台上完成演示实验)
师:刚才上述3支试管中红糖溶液的浓度是多少呢?请同学们查看老师配制这3种溶液时的数据,并计算其溶质的质量分数。
学生完成计算过程,老师选择几个代表性的作业进行投影,采用生生互评的方式组织教学,得出结论:对有色溶液来讲,浓度越大,其颜色越深。
设计意图:溶质的质量分数定义及计算公式是本节课的核心知识。学习形式设计成以学生为主体的探究式,而没有采用“讲授一练习巩固”的传统形式,且从生活中的红糖溶液入手,没有选择教材中的硫酸铜溶液作为实验资源,这样的设计贴近学生的生活,激发学习兴趣,很快将学生带入探究情境。溶质的质量分数的定义与计算式采用学生自主学习的形式,阅读文本而获取(学生自己能看懂)。学生获取计算式之后,没有采用例题巩固应用的“俗套”方式组织教学,而是将公式的解读与实验设计、方案比较、完成实验进行多元融合,加深了学生对溶质质量分数定义和计算式的主动意义建构,这成为本节课的亮点之一。表格设计的计算并非“孤独”,将对比和验证的思想蕴含于其中并渗透给学生,为结论的得出提供了数据论证。
2.片断二:深度认识溶质质量分数的表达式
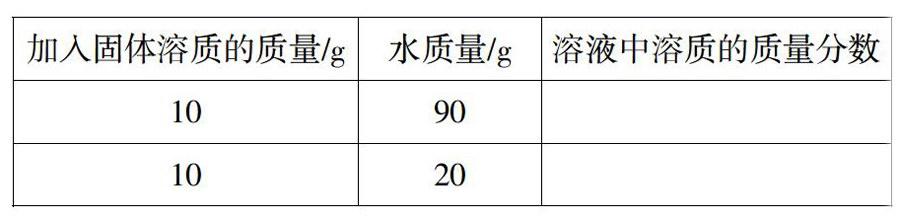
师:现在室内的水温为10℃,已知10℃时,氯化钠的溶解度为35.8g。在10℃时,根据下表规定的质量进行配制氯化钠溶液,并计算溶液中溶质的质量分数(水的密度可看做lg/cm3)。
两位学生主动上黑板板演计算过程。第1题的计算过程所有学生一致赞同,但有少数同学对第2位同学的解题列式(如下)提出了不同见解。
生:根据10℃时,氯化钠的溶解度为35.8g,可推知,此温度下,20g水中最多只溶解7.16g氯化钠,所以溶液中溶质的质量不是lOg。
生:我们可以通过做实验来检验。
师:同桌的两位同学为一组,动手完成上述表格中两种溶液的配制,并汇报实验结果。
学生开始实验,教师巡视,并及时纠正学生实验中的不规范操作。
生:第1个实验中lOg氯化钠全部溶解,第2个实验中lOg氯化钠固体没有全部溶解,得到了饱和溶液。
生:第2个实验中所得溶液中溶质的质量应为7.16g,所以第2问的解题过程如下:
师:你对公式中“溶质的质量”如何理解?
生:必须是溶解的溶质质量。
教师板书,并用红笔标注,“溶质的质量必须溶解的质量”。
师:第2个实验所得溶液是饱和溶液,老师对刚才这位同学的解题过程作如下变通(在黑板上板演):
师:从上述变通中,你是否可以总结出饱和溶液中溶质质量分数的计算公式?
师:已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%”。这种说法对吗?为什么?
学生分析回答,各合作小组进行组内质疑,组内解决。
设计意图:这一片断的教学培养了学生的主动发现能力。学生在学习了溶质质量分数的计算公式后,很容易在第2小题走进教者设计的“陷阱”中。“错误是宝贵的教学资源”,引导学生相互纠错,协作共进,进而提出自己的见解:一是从计算推理角度来阐述,根据溶解度定义来推知l0g氯化钠不能全溶解:二是从实验的角度来证明并创设每位学生动手的机会,在实验动手后真实的感悟出“溶质质量必须是溶解的质量”,这样的设计充分肯定学生是学习主人的前提下展开的,也体现了学科特质和研究问题的真实性,这成了本节课的亮点之二。而饱和溶液的溶质质量分数的推出,是基于例题情境展开的老师引导、学生归纳而总结出来的,体现了让知识的形成与学生的主体参与相结合的教学思想。
3.片断三:根据情境和数据进行编题
师:在农业生产上,常用溶质质量分数为16%的氯化钠溶液进行选种。提供如下数据:①NaCl质量24kg;②水质量126kg;③溶液质量150kg。请同学们自主编题,将上述任一数据设置为未知(即题目的问),通过编制题目来问答。
学生编题,教师巡视,挑选不重复的问题进f=亍展示。
生1的问题:在农业生产上,常用溶质质量分数为16%的氯化钠溶液进行选种。若用24kg的氯化钠来配制溶液,需水的质量多少?
生2的问题:用24kg的氯化钠和126kg的水配制溶液进行农业的选种,求此溶液中的溶质质量分数是多少?
生3的问题:在农业生产上,常用溶质质量分数为16%的氯化钠溶液进行选种。已配制了150kg的此溶液,问需氯化钠和水的质量分别是多少?
生4的问题:在农业生产上,用126kg的水配制成了溶质质量分数为16%的氯化钠溶液去选种,问需氯化钠质量是多少?
全体学生围绕这4个问题,分别列式求解,并归纳出相应的变式公式:
设计意图:这一环节教学将课本中的例题改成学生自编自求题,突破了文本的束缚,改变了传统的教师抛问题学生思考问答的形式。学生成为问题设计的主人,学习和思考的主体意识增强,萌生了自主展示意识,必然会自主思考此题的求解路径、公式变通,至此,变式公式自然生成。同时,这一改变调动了不同层次学生的积极思考,学业成绩优秀的学生想设计出多种不同类型的习题给其他同学来做,同时证明自己是优秀的。有些基础较差的学生也能设计出1至2个问题,尽管有些“羞涩”,但也期待着其他同学来求解自己设计的题目,这正是我们所期待的生生之间的“协作共进”,这成了本节课的亮点之三。教学表明,全体学生在这一环节中充分体现了自己是学习的主人,展示与和谐成长成了这一教学片断的主题。
三、教学反思
1.变通文本资源,与学生走得更近
教学是一种艺术,“教”的服务对象是“学”,“学”是主体。教师在选择教学资源时,不应墨守成规、束缚于课本资源,“变通”会激活“学的主体”。在本节课中放弃了课本中的硫酸铜溶液,去选择学生熟悉的生活情景“红糖水”作为教学资源,拉近了与全体学生的距离,对知识的亲切感和探究欲望自然而生。“教材是个例子”,但并非每个例子都是很好的教学资源,评价标准是学生,只有让学生“走近”教学情景,才能“走进”学科本质,掌握学科内涵。
2.创设多样化学习方式,让各层次学生乐于“协进学习”
教学方式的单一,必然会带来学习方式的单一,势必引起学生对学习化学的厌倦。新课程标准倡导“多样化的学习方式”,鼓励教师从具体的教学目标、教学内容和学生的实际情况出发,灵活创设多样化学习方式,激发各层次学生学习的兴趣,并在互相协作中完成化学的快乐学习,这应是我们化学教师所向往的,追求的教学场景。本节课中创设了自主学习、合作学习、探究学习、发现归纳学习等,生与生之间的实验方案互补协作、实验动手协作、相互纠错协作等合作形式,这些形式最大程度上促进了各层次学生的和谐发展。
3.调动教学多因素“协作”,引领学生主动建构知识
教材内容、教师、学生、教学方式、课堂文化等多因素之间互动的合力所决定了教学效果,学生是关键因素,因为评价的最终落脚点是学生的进步与发展。
本节课中,将计算公式的理解寓于一定的生活情景中,引领学生主动建构了溶质质量分数的公式:在实验情景中,主动理解了公式中“溶质质量”的真正含义,并自主归纳了饱和溶液中溶质质量分数的计算公式:通过自编问题的情境,激发了各层次学生的主动思考,培养了全体学生的问题设计能力。在整个教学过程中,教师起组织者、指导者、帮助者和促进者的作用;利用情境、合作、对话等学习环境要素充分发挥学生的主动性、积极性,最终达到学生有效地实现对当前所学知识的意义建构的目的。

