四环节法:高三化学复习课作业设计的实践研究
葛珊珊 赵华
摘要:化学平衡思想在高中化学知识体系中占有重要地位,是学习化学的重要思维工具。针对学生理解上的常见误区,作者遵循先设计作业目标、建立作业框架,再选编试题、汇总形成作业,最后批阅反馈的作业设计流程,进行了“化学平衡思想理解与应用”高三复习课的作业设计。
关键词:四环节法;高三化学复习;作业设计
文章编号:1008—0546(2016)07—0021—04
中图分类号:G633.8
文献标识码:Bdoi:10.3969/i.issn.1008—0546.2016.07.007
一、问题的提出
突破作业设计的随意行为,理性分析学习目标、学情有助于提升作业设计的有效性。
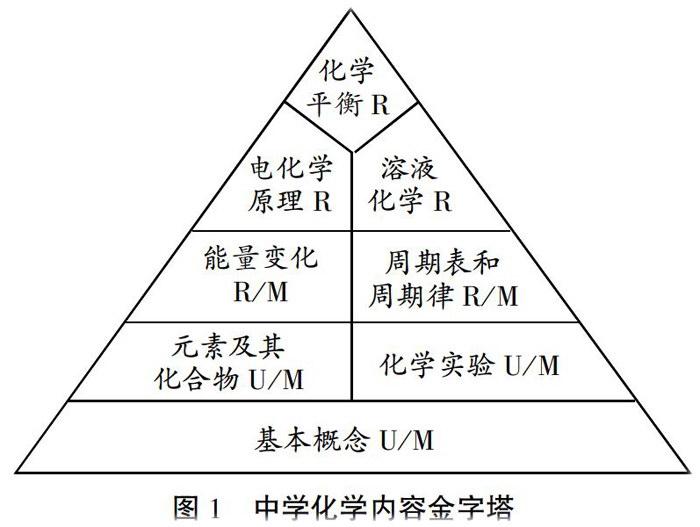
在高三复习过程中,针对化学平衡问题进行专门的作业设计源于化学平衡思想在知识体系中的特殊地位。根据SOLO分类结构理论,有研究者将中学化学的内容比作一个金字塔(见图1),划分为四层结构:(1)化学基本概念,主要包括基础知识概念和基本技能概念。所有化学内容均以此为基础,其构成金字塔的第一层。(2)元素及其化合物和化学实验,两者对应构成了金字塔的二级结构。(3)物质的能量变化和物质结构变化,两者体现了化学性质的规律化。(4)化学平衡、电化学原理和溶液化学是金字塔的最高级别,属于化学原理部分的知识,进人了宏观化学与微观微粒之间的深度结合。
在学生的思维当中,开始的知识学习都是分离的、相互不连贯的内容,但是随着学习的深入,所学的知识不断联系起来,在化学平衡这一最高层次上,学生终于建立了一个抽象体系,可以解决以前从未遇过的问题,甚至有所创新。所以,帮助学生理解和运用化学平衡思想有着重要的教学意义。
二、作业设计
作业设计一般可分为四个步骤,又称四环节:明确目标、建构框架、精编试题、对照评估。
1.明确作业设计的目标
苏教版课程标准中关于《化学反应原理》中化学平衡的学习要求和学习建议,见表1。
在教学要求和活动建议中,我们也可以发现,化学平衡的教学内容有着很强的应用性,与实验和工业联系十分紧密。化学平衡既是一个抽象的知识体系,又是一个实用的思考工具。我们设计相关作业,要让学生既能充分理解知识本身,又能融会贯通化学平衡在工业实际中的运用。
在近三年的高考化学试题当中,化学平衡的相关问题越来越成为命题的热点。
2.建立作业设计的框架
作业设计框架是基于作业目标开展作业设计的第一步。作业框架主要包含作业目标、题型、题量、难度等内容,为后续作业题目的选择和分析以及作业的最终形成奠定了基础。
观察目标1和目标2的完成情况,只需要看结果即可知,所以安排了选择题和填空题,而目标3和目标4则需要文字表述才能检测学生是否达成目标要求,所以安排了填空题和简答题。安排2-3题是希望学生经历不同的问题情境,从多角度理解知识的运用方式。
3.选编合适的试题
高三复习阶段各个省市的模拟试卷交流频繁,试题资源丰富,可以选取符合作业目标的试题进行节选和改编,将与作业目标不一致的其他问题排除在外,将学生精力集中到关键问题上来,在有限的作业时间内达到更好的作业效果。
试题1一定条件下存在反应:2SO2(g)+O2(g)=2SO3(g),△H A.容器Ⅰ、Ⅲ中平衡常数相同 B.容器Ⅱ、Ⅲ中正反应速率相同 c.SO3的体积分数:Ⅱ>Ⅲ D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 [分析]该试题在模型问题上非常典型,涉及到绝热容器、恒温容器、恒容容器和恒压容器。学生在思考时可以巩固化学平衡的相对移动问题,同时强化平衡常数、化学反应速率的影响因素分析,选项D应构建过渡的等效平衡,假设一个体积相同的恒温恒容容器Ⅳ,充入2mol SO2和lmol O2,容器Ⅳ中SO2的转化率与容器Ⅱ中S3的转化率之和为1,再考虑容器I因为绝热温度升高,化学平衡相对容器Ⅳ中逆向移动,故容器Ⅱ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1。答案CD。 试题2臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)=N2O5(g)+O2(g),在T°C下,向2.OL恒容密闭容器中充入2.0mol NOz和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表: 下列有关说法正确的是 ( ) A.反应在O-3s内的平均反应速率V(NO2)=0.24mol/(L·s) B.24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O:)=0.44mol/L,则正反应放热 C.在T℃下,起始时向容器中充人1.0mol NO2、0.5mol 03、0.5mol Nz05和0.5mol 02,反应达到平衡时,压强为起始时的0.88倍 D.在T℃下,起始时向容器中充入2.0mol N2O5,和2.0mol O2,反应达到平衡时N2O5,的转化率大于20%
[分析]选项CD都要运用到等效平衡进行过渡。c中的投料情况与题干中等效,所以反应达到平衡时各种组分的物质的量就和题干中情况一致,所以p(末)÷p(初)=0.88。0.4mol+0.2mol+0.8mol+0.8mol÷1.0mol+0.5mol+0.5mol+0.5mol=0.88D中如果充入1.0mol N2O5和1.0mol O2,反应达到平衡时N2O5的转化率等于20%,此时的充入量相当于加压情况,平衡正向移动,N205的转化率小于20%。答案BC。
试题3 CO2和H2充入容积相同且固定的两个密闭容器中,在一定温度下发生反应:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
按如下方式加人反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为
[分析]首先需要根据平衡后压强的变化情况算出平衡时各物质的物质的量,平衡时有0.4molCH3OH,反应向逆反应方向进行,c>0.4,为了使平衡后乙与甲中相同组分的体积分数相等,甲乙容器中必须能够达到相同的平衡状态,可以理解为反应物充分反应生成产物得到1.0molCH3OH,这是c的最大值。答案(0.4,1]。
试题4某温度下在一恒压容器中充人1.2 molCO和1 mol H2,发生反应:CO(g)+2H2(g)=CH3OH(g)。达到平衡时容器体积为2 L,且含有o.4 mol CH3OH(g),则该反应平衡常数值为__;此时向容器中再通入0.35 mol CO气体,则此平衡将(填“向正反应方向”“不”或“向逆反应方向”)移动。
[分析]这是一条有利于打破思维定势的题目。审题时注意是“恒压容器”,当再通入0.35 mol CO气体时,容器的体积将发生改变,此时各种物质的浓度全发生变化,平衡的移动方向只有通过Q和K的相对大小进行判断,而不能武断地认为加入反应物向正反应方向移动。答案:50,向逆反应方向移动。
试题5高温热分解法利用H2S废气制取氢气:
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L测定H2S的转化率,结果如上图。图中a为H2s的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间时H2S的转化率与温度关系曲线。说明随温度的升高,曲线b向曲线a逼近的原因:
。
[分析]审题注意b曲线表示不同温度下反应经过相同时间时H2S的转化率与温度关系曲线,与达到平衡时的值存在差异主要是因为还没有达到平衡。答案:温度升高,反应速率加快,达到平衡所需的时间缩短,故曲线b向曲线a逼近。评讲时,建议教师联系另一个图像问题共同分析。
变式(NH4)zCO3捕获CO2的反应为:
(NH4)2CO3(aq)+H2O(1)+CO2(g)=2NH4HCO3(aq)△H,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系图所示,则△H (填“>”“<”或“=”)0。
T1~T3的曲线含义和试题5中的b曲线相同,T3~T5的曲线由于温度比较高已经达到平衡,曲线的变化是由于温度升高平衡发生移动导致的。
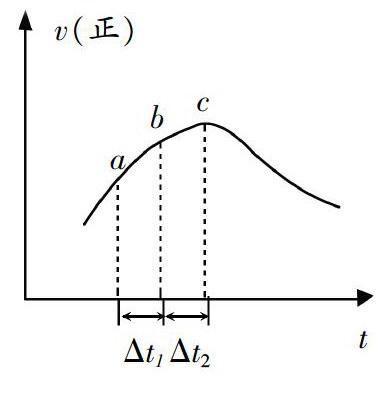
试题6新型O3氧化技术对尾气中的氮氧化物脱除效果显著,尾气中的NO5多数以NO形式存在可发生反应:NO(g)+O3(g)=NO2(g)+Oz(g),在一定条件下,将NO和O3通人绝热恒容密闭容器中发生上述反应,正反应速率随时间变化如图所示。以下说法正确的是
()
a.反应在c点达到平衡状态
b.b点的反应物浓度小于c点
c.该反应反应物的总能量低于生成物的总能量
d.△t11=△t2时,a~b段NO的转化量小于b~c段
[分析]学生分析速率时间图经常容易与平衡问题混淆,本题就容易与试题5的变式混淆,有同学认为c点已经达到平衡状态。实际上c只是一个影响速率的主要因素在交替的一个时间点,还在变化之中,尚未平衡。c点之前反应放热升温使速率增大,c点之后反应物浓度下降占主导,速率下降。答案:d。
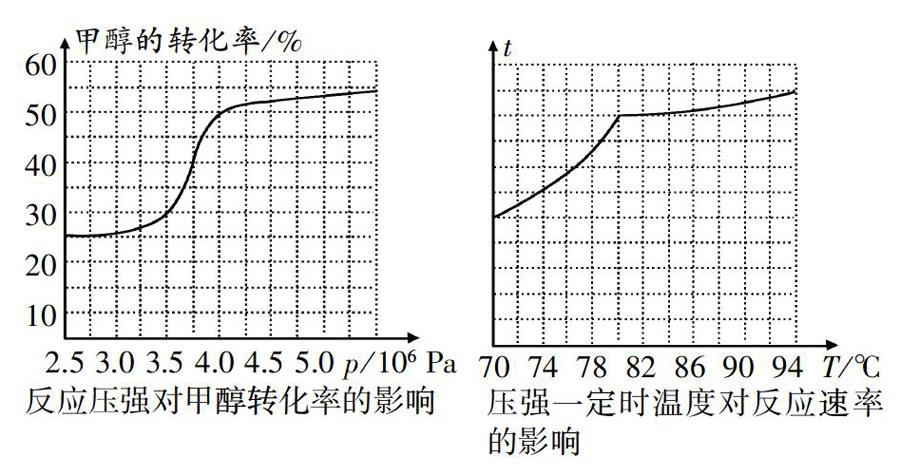
试题7工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
科研人员对该反应进行了研究,部分研究结果如下:
(1)工业制取甲酸甲酯应选择的压强是(填“3.5x 1O6Pa”“4.0x1O6pa”或“5.0x106pa”),选择的理由是____
(2)实际工业生产中采用的温度是80℃,其理由是
[分析]采用简答的方式,鼓励学生更全面地思考问题。
答案:(1)4.0xl06Pa,低于此压强甲醇转化率较低,高于此压强,压强对甲醇转化率的影响不明显,对设备提出了更高要求,能耗过度增加;
(2)低于80℃反应速率较低,高于80℃温度对反应速率影响不明显,且升温导致化学平衡逆向移动。
试题8用O2将HCl转化为Clz,可提高效益,减少污染。该转化通过如图所示的催化循环实现。
(1)总反应的化学反应方程式为
(2)实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的a(HCl)~T曲线如上图,则总反应的△H0(填“>”“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是
(3)在上述实验中若压缩体积使压强增大,画出相应a(HCl)~T曲线的示意图,并简要说明理由:
(4)下列措施中,有利于提高a(HCl)的有
(
)
A.增大n(HCl)
B.增大n(O:)
c.使用更好的催化剂
D.移去HzO
[分析]这样的试题将化学平衡的问题运用到实际生产和实验中去,在陌生的图像和反应背景下,要求学生灵活运用化学平衡原理解决问题。
答案:
(2)AH
(3)根据反应特点,反应后气体分子数减少,增大压强,氯化氢的转化率升高,故此时的aHCl-T曲线应该在题中所给曲线的上方,如图所示:
(4)B、D。
4.对照预设,实测评估
在作业试题的选编基础上,将试题汇总为本课时的作业,试题虽然只有8题,但具有一定的思考性,学生完成起来相对耗时,大约需要30~40分钟时间。学生完成作业之后,教师进行了批阅,得到实际的正确率情况,汇总下表。
总体上看,大部分题目与预测基本一致,本次作业基本达到了预先设计的目的。在作业中只有第4题较明显低于预测值,说明学生通过计算判断化学反应方向还存在思维定势,普遍在审题时没有注意到“恒压容器”,在错题矫正时要重视。
三、本次作业设计的总结
本次作业设计紧扣课程标准、高考考查要求和化学知识体系特点,聚焦学生学习的薄弱之处,确立作业目标并以此为框架,精选改编作业试题、汇总分析逐步形成作业,使作业设计具有较强的操作性,突破了先前仅凭经验粗略选题形成作业的套路,较好地提升了作业的针对性和有效性。并且对作业的正确率进行了预估和实际对比,有利于细化管理下一阶段的课堂教学和作业设计。在实践中,对于作业设计中的正确率流于经验,缺少科学的分析手段,希望在后续的研究中能有所进展。

