萝卜隐性核雄性不育系136A的选育及其育性研究
白静 段乃彬 谢坤 王俊峰 王效睦
摘要:本研究从自然群体中发现萝卜核雄性不育材料136A,通过创制178个杂交组合,经多代杂交,选育出具有50%保持能力的保持系136B。田间遗传试验结果表明,136A不育性状表现稳定,呈现出由隐性单基因控制的核不育遗传特点。细胞学观察显示该材料花粉败育彻底,花粉发育在四分体后开始发生异常,花粉败育主要由花粉壁破裂造成。PCR结果显示,该材料中不含有Ogura 雄性不育类型的主效基因orf138;线粒体和叶绿体测序结果也显示该材料具有正常的可育细胞质。
关键词:萝卜;核雄性不育;136A;保持系
中图分类号:S631.101文献标识号:A文章编号:1001-4942(2016)07-0026-06
萝卜是典型的异花授粉作物,杂种优势非常明显,利用雄性不育系进行杂交育种可以得到纯度高、性状好的杂交种,且制种过程简单,成本低[1]。雄性不育根据不育基因的遗传方式和在细胞中的定位分为细胞核雄性不育和细胞质雄性不育。目前生产上利用最多的萝卜不育系为Ogura类型的细胞质雄性不育系,它不仅在萝卜上使用,还被转育到大白菜、小白菜、甘蓝、油菜、菜花等其他十字花科作物中。单一化的雄性不育种质导致杂交种综合性状难以得到突破性的提高,对外界有害生物与环境的抵抗力非常低,存在潜在的生产风险,如1970年美国大面积种植T型细胞质的玉米杂交种,因玉米小斑病T小种的爆发流行,导致玉米产业遭受严重的经济损失。
细胞核雄性不育 (GMS)由细胞核不育基因控制,不受细胞质影响,没有正、反交遗传效应[2,3]。相对于细胞质雄性不育,核不育系具有育性稳定、恢复源广的优点。核不育现象十分普遍,已在294 种植物和21个种属间杂交组合中发现由细胞核基因控制的雄性不育类型[2,4,5]。目前,在十字花科植物中,细胞核雄性不育已经被应用在油菜、白菜、甘蓝等作物中。
相对于细胞质雄性不育,核雄性不育的保持系只有50%的保持率,在生产上很难直接利用,但通过不断发现新的核不育基因同样得到了保持率100%的保持系。陈凤祥等在甘蓝型油菜中发现一类新的细胞核雄性不育材料9012A受三对核基因控制,分别为两对隐性重叠不育基因和一对隐性上位可育基因[6],并选育出具有100%保持能力的保持系。张书芳等在大白菜中利用核隐性基因和显性上位基因育出了能够100%保持的核雄性不育保持系[7]。通过类似的方法,科研工作者先后育成一些品种应用于生产[8~12]。随着生物技术的发展,核雄性不育材料具有更广阔的应用前景。美国杜邦先锋公司发明了一项杂交种子生产技术(Seed production technology,SPT),这种新的基因工程手段能够充分利用隐性核不育突变材料,将花粉育性恢复基因、花粉致死基因和标记筛选基因紧密连锁并导入核雄性不育突变体中,从而获得相应的保持系,有效解决了隐性核雄性不育系的繁殖难题,同时该方法还解决了产品的转基因问题,为隐性核不育材料的利用提供了新的模式[13]。
然而,在萝卜雄性不育系培育中,国内尚未有细胞核雄性不育材料的报道。本研究利用从自然群体中发现的萝卜雄性不育株为供试材料,通过田间育性遗传统计试验证明新发现的雄性不育材料为由一对隐性基因控制的核不育材料,填补了萝卜雄性不育资源中缺乏核不育材料的空白,为萝卜雄性不育系的培育与研究提供了重要的不育源。通过细胞学观察初步确定花粉败育时期及不同类型不育系花粉败育的差异。
1材料与方法
1.1试验材料
萝卜Ogura雄性不育系RS43,萝卜Ogura雄性不育保持系RS45及50余份国内外萝卜种质材料。
1.2试验方法
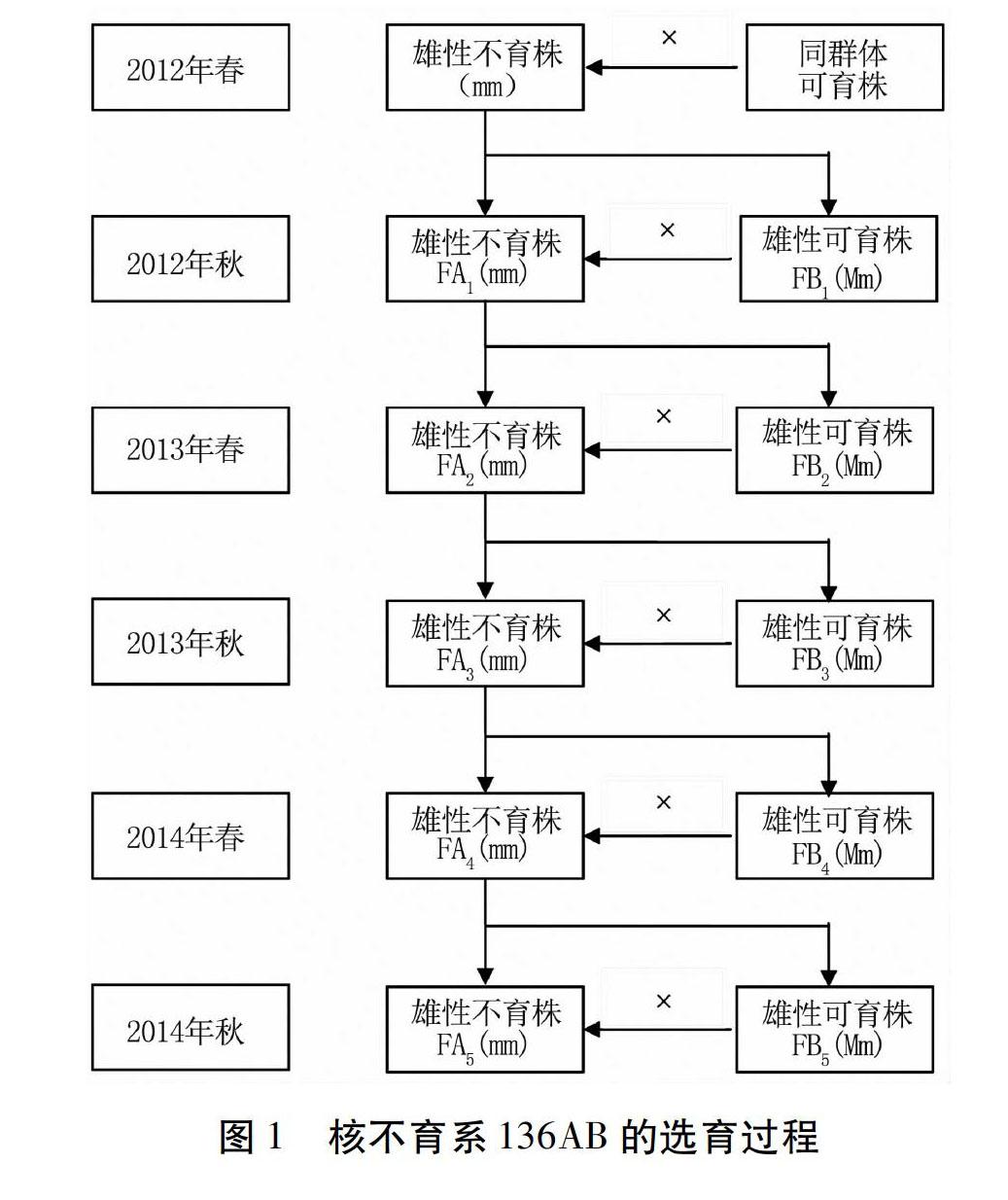
1.2.1萝卜核不育系的选育与遗传学验证2012年春于自然群体中发现1株不育株,命名为136A,以同一自然群体中的可育株作父本进行杂交,杂交组合31个;同时与5个不同品种的可育株进行杂交,杂交组合147个。每个组合后代F1及父本自交种子于当年秋季种于田间,调查育性。从中选出可以对不育材料136A保持的可育株为保持系136B。雄性不育株的标准为,雌蕊发育正常,雄蕊完全退化或不能形成有效花粉。
将不育材料与保持系的后代多代连续姐妹交,统计育性分离情况;将可育株自交,统计后代育性分离情况。
1.2.2花药发育细胞学观察以136A、RS43、136B的50个花蕾为试验材料。从现蕾期开始选取同一花序上不同发育时期的花蕾(从1 mm大小开始,直至开放前的花蕾),每个花蕾取一枚花药放于载玻片上,用镊子将花药研碎,用浓度为1%的醋酸洋红染液浸泡花药进行染色,盖上盖玻片,于显微镜(Leica DM5000 B)下分别观察3个材料不同时期的花药发育情况,并拍照。
1.2.3PCR验证利用CTAB法[14]分别提取RS44(即136A)、RS43(具有Ogura细胞质,阳性对照)、RS45(具有正常可育细胞质,阴性对照)的全基因组DNA,以Ogura类型主效不育基因orf138的特异引物(ORF-F:5′-TTCAAATCCTGTCCCCGCACC-3′和ORF-R:5′-GCCTTACACCATTGGGATACTTC-3′)对3个材料进行PCR扩增,凝胶电泳检测136A中是否含有orf138基因。
1.2.4叶绿体和线粒体测序分别以RS43和RS45为阳性和阴性对照,对RS43、RS45和136A 3个材料进行线粒体和叶绿体基因组DNA测序、组装。
为保证样品纯度,防止出现混杂现象,在提取线粒体和叶绿体DNA过程中,分别从某一单株提取样品。根据线粒体和叶绿体DNA的提取方法[15],提取含有线粒体和叶绿体的混合DNA样品,进行高通量测序。叶绿体测序深度在600倍以上,线粒体测序深度在100倍以上。根据测序深度的不同,经过De novo程序组装及PCR查补间隙,先组装叶绿体。De novo组装的线粒体Contigs先与叶绿体DNA序列进行比对,剔除相同部分,再进行线粒体组装,组装拼接方法与叶绿体相同,最后再用PCR的方法,将叶绿体与线粒体相同的DNA序列进行甄别。
2结果与分析
2.1萝卜核不育系与保持系的选育
与136A进行杂交的178个组合中,2012年秋调查发现有一个组合的杂种F1出现1∶1的育性分离,即对136A不育系具有50%的保持能力,将其命名为136B。136B与136A来自同一自然群体,其他所有组合的杂种一代均表现为可育。将136B自交获得的50粒种子种于田间观察育性,结果为自交后代中有37株可育株,13株不育株,分离比例约为3∶1。将136A与136B杂交一代中的可育株与不育株杂交,收获种子FA2于来年种植观察育性分离情况。2013年春 136A与136B杂交后代中的不育株与可育株杂交后代FA2的育性分离比约为1∶1。
将136A与136B的杂交后代连续6代姐妹交,最终基本形成了纯合、稳定的萝卜核不育AB系,选育过程如图1。
2.2136A基因型的遗传学验证
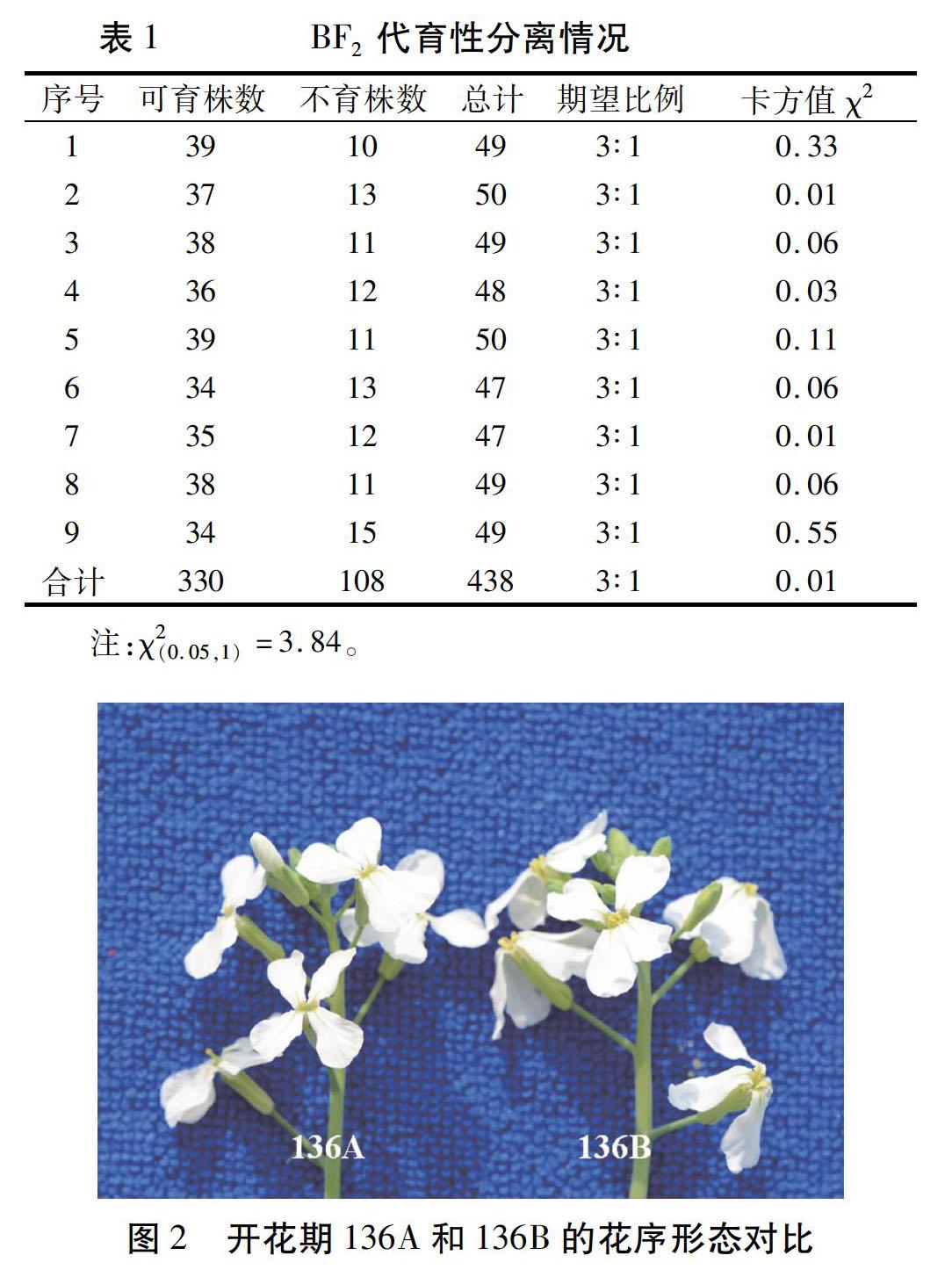
以具有正常细胞质的可育株RS45为母本,以杂交后代中的可育株(FB1)为父本进行杂交,其后代BF1全部可育。取20粒BF1种子种植并自交得到BF2,对20份BF2每份取50粒种子进行春化处理后种于温室中,调查育性分离情况。其中,11份BF2代种子表现为全部可育,9份BF2代种子出现育性分离,两者比例约为1∶1。9份出现育性分离的BF2分离情况如表1,合计可育株330株,不育株108株,分离比例符合3∶1比率,即符合隐性单基因的遗传规律。与136B自交试验相比,该试验中BF2的细胞质由136B的细胞质更换为RS45的细胞质,但育性分离结果一致,表明该材料育性分离情况不受细胞质的影响,同时验证了该雄性不育为核基因控制的隐性单基因性状。
2.3136A花粉败育的生物学观察
2.3.1花器官发育观察通过观察开花期不育系136A和保持系136B的50个花序,选取两者的典型花序进行对比,如图2所示。不育系136A与保持系136B的盛花期基本同步,在花器官的大小上,前者比后者明显要小。
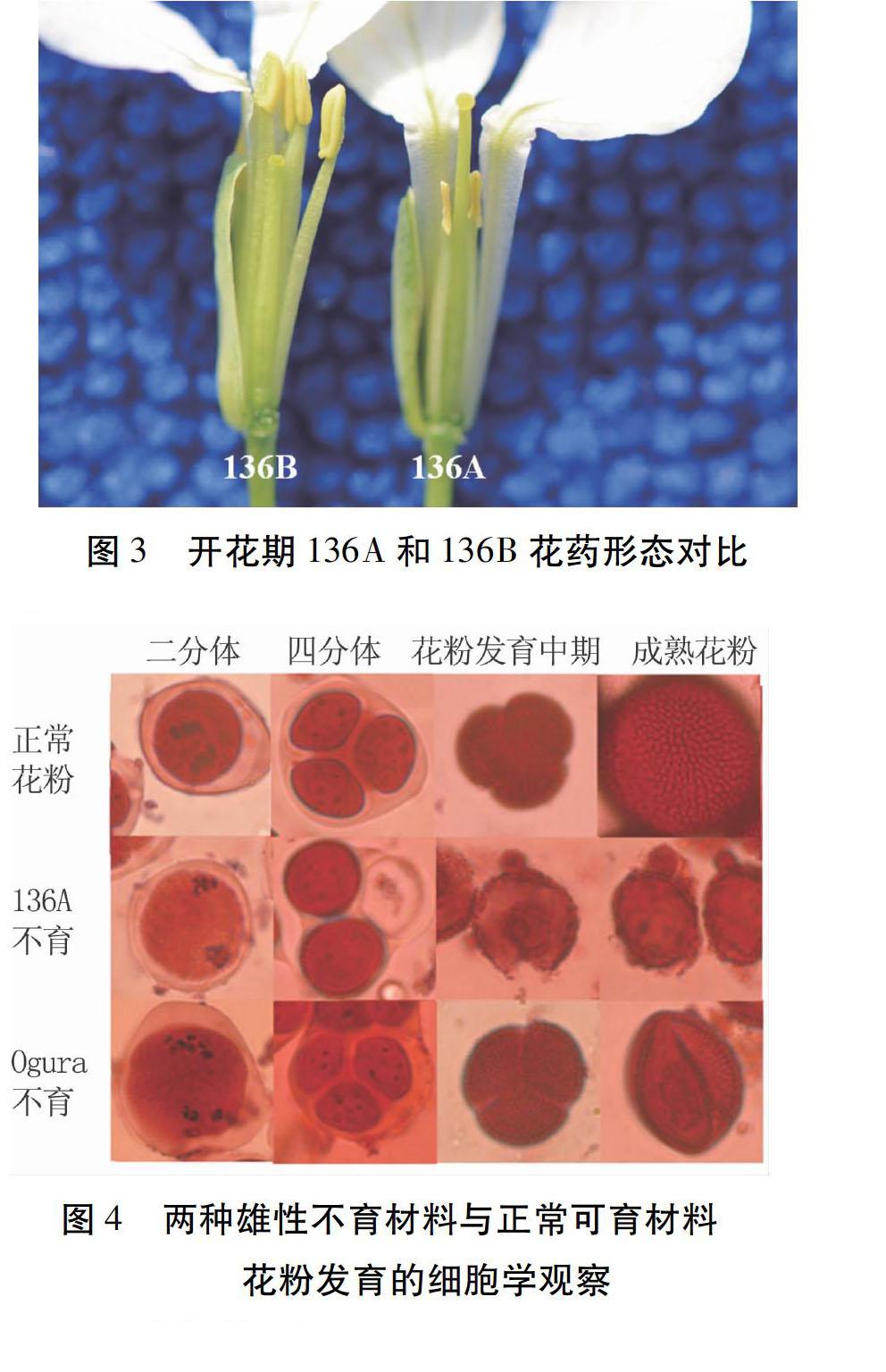
对136A核不育系的花药与保持系136B进行比较(图3)发现,刚开放的花花药就已萎缩的很小,且花药干瘪,摘取花药挤压,无花粉,表明该不育系的花药退化较为彻底。
2.3.2花粉粒败育观察对136A、136B和RS43的花粉粒发育情况进行观察(图4)发现,花粉败育的转折点是四分体时期。在四分体以前,无论是核不育、细胞质不育和正常可育材料,花粉发育都是正常的,三者之间没有明显的区别。在四分体之后,花粉粒的前体游离成单个个体,正常植株的花粉开始出现花粉壁不均匀增厚,并逐渐增大,最后形成球状,且外壁有突起;细胞质雄性不育系的花粉粒前体在四分体后,很快就停止发育,并逐渐萎缩,最后形成干瘪的花粉粒;核雄性不育系在四分体后,游离出的花粉粒前体也有一个短暂的花粉壁增长过程,但随着花粉的发育,花粉壁表面越来越粗糙,局部会逐渐变薄,最后破裂,在花蕾开放前,会剩很少一部分花粉粒,花粉壁粗糙,花粉干瘪不饱满。
花粉发育的细胞学观察
2.4PCR验证结果
orf138基因特异引物的目标带型大小为400~500 bp之间,凝胶电泳检测结果为仅阳性对照RS43中扩增到orf138基因特异条带;核不育系136A与阴性对照RS45中均未出现特异条带(图5)。该结果初步确定核不育材料136A中不含有orf138基因。
1、2、3、4号样品为136A;5号样品为RS43;
6号样品为RS45;M为DL2000。
2.5叶绿体和线粒体测序
以NCBI 公布的萝卜基因组组装序列(GCA_000715565.1)及萝卜的叶绿体、线粒体基因组(KJ716483、AB694744.1)为参考基因组,完成线粒体和叶绿体的测序组装工作。通过本地Blast,136A(RS44)与RS43及RS45的线粒体基因结构对比如图6所示,从上至下顺序为RS44(即136A)、RS43、RS45。RS44与RS45的线粒体基因组序列完全一致,具有Ogura细胞质的RS43与前两者差别较大,存在很大的结构变异,出现大量的基因组重排现象。
通过本地Blast,136A(RS44)与RS43及RS45的叶绿体基因结构对比结果如图7所示,从上至下顺序为RS44(即136A)、RS43、RS45。三个材料的叶绿体基因组序列基本一致,其中RS44比RS45仅在其镜像重复区内多出30个碱基的重复,其它完全一致。对RS44发生变异的区域进行基因序列和开放阅读框(ORF)比对、寻找,结果显示,此30个碱基不在已明确的叶绿体基因或ORF内,表明该区域不存在有功能的基因序列。由此推断,136A不育材料的不育基因不在细胞质中。
3讨论与结论
本研究通过连续6代杂交选育与育性调查、细胞学观察等,明确了136A核雄性不育系的特点。
136A雄性不育材料为核基因控制的隐性单基因雄性不育材料,保持系136B具有50%的保持能力。136A不育系的花器官略小于可育株,雄性育性退化彻底,经过多代观察,其育性不受环境等因素的影响,表现为雌蕊发育正常,花药退化彻底,不能形成具有功能的花粉。
萝卜核雄性不育与细胞质雄性不育花粉发育有着明显的差异。在四分体之后,花粉粒的前体游离成单个个体,细胞质雄性不育系的花粉粒很快就停止发育,并逐渐萎缩,最后形成干瘪的花粉粒;核雄性不育系在四分体后,游离出的花粉粒前体有一个短暂的花粉壁增长过程,但随着花粉的发育,花粉壁表面越来越粗糙,局部会逐渐变薄,最后破裂,在花蕾开放前,只有很少一部分花粉粒,但花粉壁粗糙,花粉干瘪不饱满。
通过对136A(RS44)、Ogura不育材料(RS43)、正常可育材料(RS45)进行线粒体和叶绿体DNA的测序、组装,结果表明136A与RS45的线粒体DNA完全一致,具有正常的可育细胞质,不同于Ogura类型的不育细胞质。
新发现的136A雄性不育材料填补了萝卜雄性不育资源中缺乏核不育材料的空白,为萝卜雄性不育系的培育与研究提供了重要的不育源。为加速136A雄性不育系的利用,在下一步工作中我们将利用136AB系多代选育过程中建立的近等基因系,采用图位克隆与测序相结合的方法定位和克隆出核雄性不育基因与恢复基因。针对核雄性不育系不能获得100%不育株的问题,我们将利用标记基因或对某种药物敏感基因(如荧光蛋白、水稻苯达松敏感基因[16]等)与恢复基因建立连锁,将连锁基因转化到136A雄性不育系中建立新的保持系,该保持系虽然也只有50%的保持能力,但在不育系与保持系的混合群体中,可通过标记基因或药物敏感基因表达,在苗期将具有指示性状的单株拔除或通过喷撒药物杀死可育株获得100%的不育株,使得136A隐性核雄性不育系真正应用于生产中。
参考文献:
[1]马二磊.萝卜雄性不育胞质类型鉴定与分析[D].南京:南京农业大学,2009.
[2]Kaul M L H. Male sterility in higher plants. Monographs on theoretical and applied genetics 10[M]. New York:Springer-Verlag,1988.
[3]Li Z F, Xia J F, Tang G Y. Types and genetic mechanisms of plant male sterility[J].Journal of Anhui Agricultural Sciences,2008,28(6):742-746.
[4]Johns C W, Delannay X, Palmer R G, et al. Structural sterility controlled by nuclear mutations in angiosperms[J].The Nucleus,1981,24:97-105.
[5]Okamuro J K, Denb G W, Jofuku K D, et al. Regulation of Arabidopsis flower development[J]. Plant Cell,1993,5:1183-1193.
[6]陈凤祥,胡宝成,李强生,等. 甘蓝型油菜细胞核雄性不育材料9012A的发现与初步研究[J].北京农业大学学报,1993,19(增刊):57-61.
[7]张书芳,宋兆华,赵雪云.大白菜细胞核基因互作雄性不育系选育及应用模式[J].园艺学报, 1990, 17(2):117-125.
[8]陈凤祥,胡宝成,李强生,等.甘蓝型油菜隐性上位互作核不育双低杂交种皖油14的选育[J].中国油料作物学报,2003,25(1):63-65.
[9]陈凤祥,胡宝成,李强生,等.甘蓝型油菜隐性上位互作核不育双低杂交种“皖油18”的选育[J]. 安徽农业科学,2002,30(4):535-537.
[10]孙超才,赵华,王伟荣,等.甘蓝型双低隐性核不育杂交种沪油杂1号的选育[J].中国油料作物学报,2004,26(1):63-65.
[11]陈大伦,张瑞茂.甘蓝型油菜隐性细胞核雄性不育系118A的发现与选育[J].贵州农业科学,2006,34(6):5-7.
[12]李慧,胡胜武,李玮,等.甘蓝型油菜隐性上位互作核不育系的选育及其细胞学研究[J].西北农林科技大学学报,2010,38(1):111-124.
[13]Hondred D, Young J K, Brink K, et al. Plant genomic DNA flanking SPT event and methods for identifying SPT event:US20090210970A1[P]. 2009.
[14]Paterson A H, Brubaker C, Wendel J F, et al. A rapid method for extraction of cotton (Gossypium spp.) genomic DNA suitable for RFLP or PCR analysis[J]. Plant Mol. Biol. Rep., 1993,11:122-127.
[15]段乃彬,王俊峰,白静,等.萝卜叶绿体及线粒体基因组测序与组装[J].分子植物育种, 2015,13(11):2429-2436.
[16]Wang S M, Zhu Q S, Wang W L, et al. The application of bentazon susceptible gene on seed production of hybrid rice[J]. Agricultural Science & Technology, 2008,9(1):99-103,145.

