应用反向斑点杂交技术快速检测结核分枝杆菌耐药性
施伎蝉 蒋贤高 余志杰 宁洪叶 何贵清 吴正兴 蔡玉伟 程爱琼
应用反向斑点杂交技术快速检测结核分枝杆菌耐药性
施伎蝉 蒋贤高 余志杰 宁洪叶 何贵清 吴正兴 蔡玉伟 程爱琼
全国第五次结核病流行病学抽样调查资料显示,我国15岁以上人群活动性、凃阳和菌阳肺结核的患病率分别为459/10万、66/10万和119/10万,Mtb耐多药率为6.8%[1]。近年来,流动人口的增加、诊断治疗的延误和抗结核药物的滥用等原因导致耐药菌株的增加,造成耐多药结核病(MDR-TB)的流行[2]。多重耐药Mtb的出现、临床缺乏有效的耐药菌株检测手段和尚无新的抗结核药物出现等原因,使患者错过了最佳的治疗时机,增加了耐药菌株的传染机会。因此,对Mtb的快速诊断及寻找有效的耐药检测方法成为了迫切的需求。
反向斑点杂交技术是一种可以简单、快速检测基因突变和基因缺失的技术手段。本研究应用反向斑点杂交技术检测温州地区Mtb临床分离菌株及其对4种一线抗结核药物耐药相关的基因突变(利福平耐药基因rpoB、异烟肼耐药基因katG和inhA、链霉素耐药基因rpsL、乙胺丁醇耐药基因embB),并与液体培养药物敏感性试验(简称“药敏试验”)结果进行对比,探讨其在检测Mtb及耐药性方面的临床应用价值。
材料和方法
一、患者来源
选取2013年11月至2014年10月在温州市中心医院感染科就诊的93例门诊和住院复治肺结核患者作为研究对象,其中男78例,女15例,平均年龄(48.0±12.5)岁。复治肺结核诊断标准参照文献[3],即:(1)初治失败的患者;(2)规则用药满疗程后痰菌复阳的患者;(3)不规则化疗超过1个月;(4)慢性排菌患者。有上述情况之一者确诊为复治肺结核。
收集上述患者的痰标本共计93份。留痰方法如下:(1)在留痰之前先用清水漱口数次,以清除口腔内的食物残渣及部分杂菌。(2)留取的痰应是用力咳嗽后自气管内咳出的痰,痰量不少于3 ml,然后盛于痰盒内送检。不要将唾液或鼻涕吐入痰盒,以免影响查痰结果。(3)留痰标本要使用专用的痰盒,及时送到检验科检查。(4)门诊就诊患者,留取即时痰(就诊当时咳出的痰)2份,住院患者留取清晨痰(起床后深咳吐出的痰)2份。均分别送检Mtb液体培养、药敏试验与反向斑点杂交法检测。
二、试剂与仪器
Mtb耐药突变基因检测试剂盒购自深圳亚能生物技术有限公司;朗基L96+/Y型PCR仪/基因扩增仪,购自杭州朗基科学仪器有限公司;罗氏诊断real-time PCR扩增仪(型号LC-480I和Z480)、FYY-3型分子杂交仪均购自深圳亚能生物技术有限公司;可调移液器(2~10 μl、20~200 μl)购自德国艾本德公司;Fosun生物安全柜购自上海力申科学仪器有限公司;显色液新鲜配制,用时按所需浓度加蒸馏水配制。
三、方法
1.细菌培养、菌种鉴定及药敏试验:所有痰标本按照《结核病诊断细菌学检验规程》[4]进行BACTEC MGIT 960液体培养、菌种鉴定及药敏试验。
2.DNA提取:痰标本1 ml加等量4% NaOH液化后,离心半径8 cm,13 000 r/min离心5 min,混匀;离心半径8 cm,10 000 r/min离心2 min,弃上清。向沉淀中加入50 ml细胞裂解液,打匀,沸水浴10 min,离心半径8 cm,10 000 r/min离心2 min,留上清液进行PCR。
3.膜芯片设计:经GenBank数据库检索和比对分析,设计23条特异性探针,并点样至尼龙膜上,制成膜芯片。
4.PCR扩增:取出PCR 反应管,在管壁上做好标记,离心半径8 cm,50 000 r/min离心2 min,加入已提取的待测样品 DNA 4 μl。同时取两管PCR反应管分别加入阳性标本提取的DNA和阴性标本提取的DNA,作为产品使用过程的质量控制。反应体系如下:模板DNA 20 ng、2.5 mmol/L dNTP 2 μl,25 mmol/L MgCl21.5 μl,25 μmol/L上、下游引物各0.5 μl, DNA Taq酶2.5 U, 10×PCR缓冲液2.5 μl。使用ABI-7300仪器扩增,循环条件为:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 45 s、68 ℃ 60 s,循环次数为30;95 ℃ 30 s、54 ℃ 30 s、68 ℃ 60 s,循环次数为30;68 ℃ 5 min。
5.反向斑点杂交技术:取检测膜条置15 ml离心管中,加5 ml杂交缓冲液(1×柠檬酸钠盐、0.1%十二烷基硫酸钠) 和PCR 产物, 沸水浴10 min,58 ℃杂交2 h。将膜条移至装有预热洗液(0.5×柠檬酸钠盐、0.1% 十二烷基钠)的50 ml管中,于58 ℃轻摇洗涤15 min。用杂交缓冲液配制1∶2000的过氧化物酶溶液,室温轻摇泡膜30 min,弃过氧化物酶液。用杂交缓冲液室温轻摇洗膜2次,每次5 min。将膜条浸泡于新鲜配制的显色液中(0. 1 mol/L柠檬酸钠19 ml、2 mg/ml四甲基联苯胺1 ml、3% H2O210 μl),避光显色5~10 min, 出现蓝色斑点即为含有相应的待检基因。
6.结果判读:阳性质控品正常显色而临床样本只有第CC位点显色,表明被检样本为阴性(即无Mtb)或者样本中待检测的Mtb在本试剂盒最低检出限以下。膜条探针排列顺序见图1。
结 果
一、耐药情况
在93份送检液体培养及药敏试验的痰标本中,44份液体培养Mtb 阳性,4份为非结核分枝杆菌,45份液体培养Mtb阴性。对44株Mtb菌株进行一线抗结核药物药敏试验,RFP耐药15株,INH耐药15株,EMB耐药7株,Sm耐药12株。38.6%(17/44)的Mtb菌株为耐药菌株,其中多重耐药菌株占耐药菌株的88.2%(15/17)(表1)。
二、反向斑点杂交技术检测结果
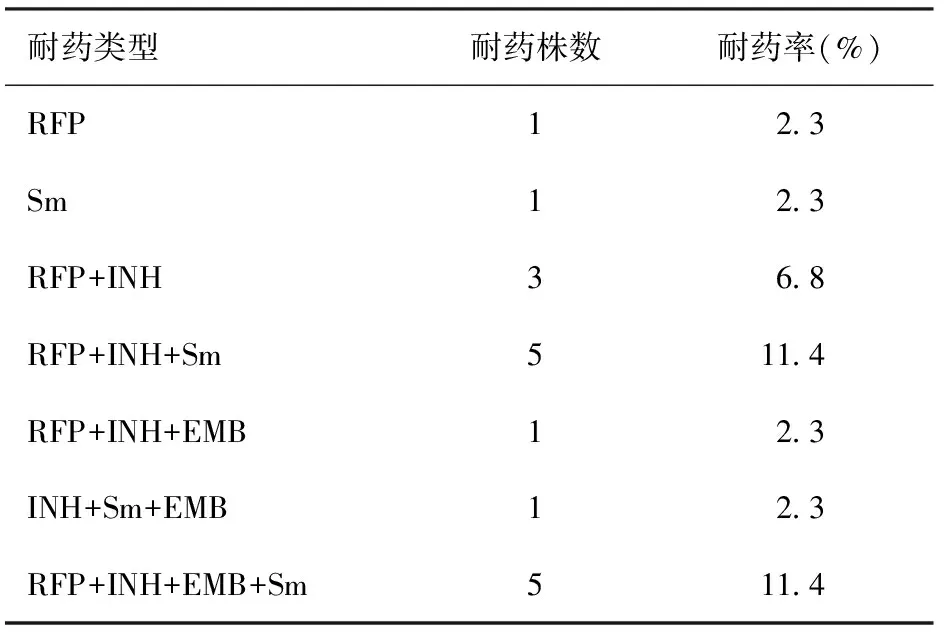
表1 44株Mtb菌株中不同耐药类型的统计
93份痰标本中,应用反向斑点杂交法共检出Mtb基因阳性57份,阳性检出率为61.3%(57/93),其中野生型32份,突变型25份,耐药基因突变菌株占阳性菌株的43.9%(25/57)。
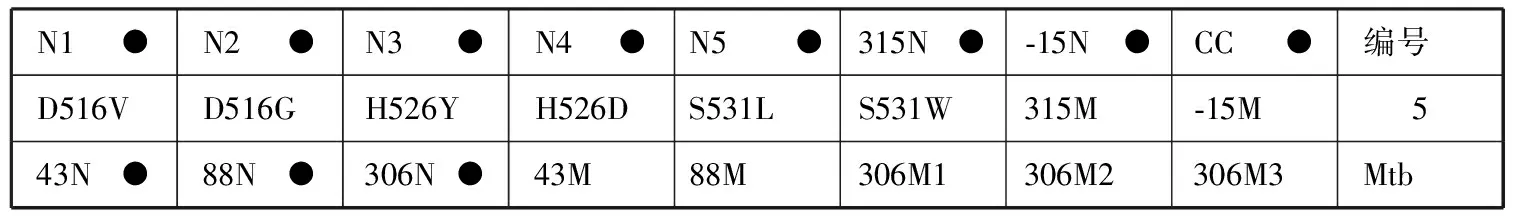
N1●N2●N3●N4●N5●315N●⁃15N●CC●编号D516VD516GH526YH526DS531LS531W315M⁃15M 543N●88N●306N●43M88M306M1306M2306M3Mtb
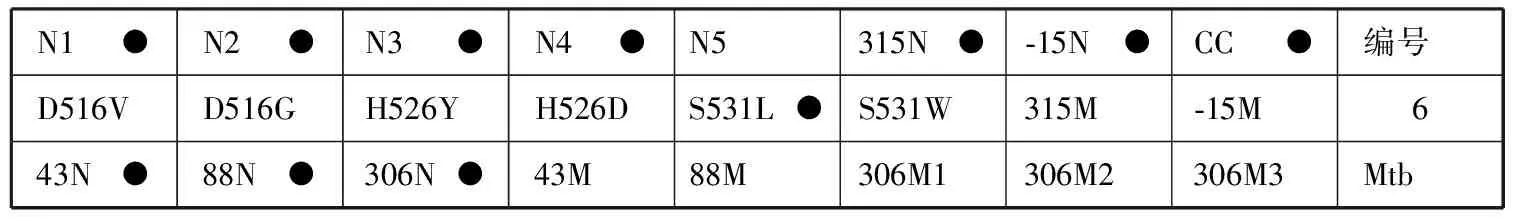
N1●N2●N3●N4●N5315N●⁃15N●CC●编号D516VD516GH526YH526DS531L●S531W315M⁃15M 643N●88N●306N●43M88M306M1306M2306M3Mtb
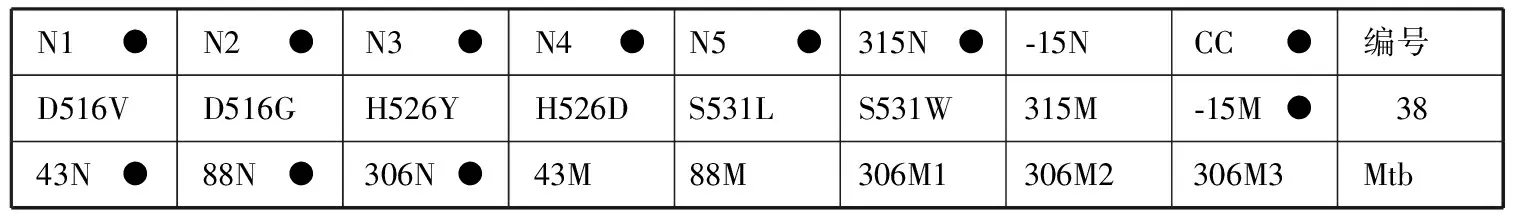
N1●N2●N3●N4●N5●315N●⁃15NCC●编号D516VD516GH526YH526DS531LS531W315M⁃15M● 3843N●88N●306N●43M88M306M1306M2306M3Mtb
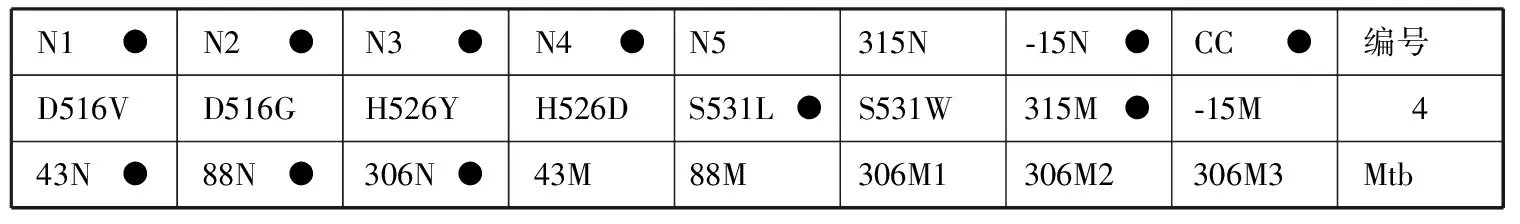
N1●N2●N3●N4●N5315N⁃15N●CC●编号D516VD516GH526YH526DS531L●S531W315M●⁃15M 443N●88N●306N●43M88M306M1306M2306M3Mtb

N1●N2●N3●N4●N5315N⁃15N●CC●编号D516VD516GH526YH526DS531L●S531W315M●⁃15M 5143N88N●306N●43M●88M306M1306M2306M3Mtb

N1●N2●N3●N4●N5315N●⁃15NCC●编号D516VD516GH526YH526DS531L●S531W315M⁃15M● 343N88N●306N43M●88M306M1●306M2306M3Mtb
注 (1)第一排N代表该位点为野生型,第二排是突变位点,其中后2个探针的M代表突变探针。第一 排N1到N5和第二排的前6个位点(D516V到S531W)是利福平耐药相关基因rpoB检测探针;其他的第315和-15位点分别是异烟肼的耐药相关基因katG和inhA检测探针。第三排43N、88N代表链霉素rpsL基因第43和88位密码子位点为野生型,43M、88M代表链霉素rpsL基因相应位点发生突变。第三排306N代表乙胺丁醇embB基因第306位点为野生型,306M1 306M2、306M3代表乙胺丁醇embB基因位点发生不同类型的突变。(2)516代表相关基因(这里是rpoB)上第516个氨基酸,其他位点类同;在rpoB基因相关位点中,N1探针覆盖的位点有511和513及附近区域位点,即若正常位点中只有N1位点不显色,则表明有511、513或附近区域位点发生了突变,其他位点类同;以下是几个正常探针覆盖到的位点及附近区域(N1:511、513;N2:516;N3:522、523;N4:526、529;N5:531、533);突变位点的氨基酸变化:D516V:D→V,代表天冬氨酸突变为缬氨酸;其他氨基酸含义:H为组氨酸,Y为酪氨酸,L为亮氨酸,S为丝氨酸,T为苏氨酸,N为天冬氨酸。(3)编号5膜条代表RHSE均“S”,编号6膜条代表RHSE分别为“R、S、S、S”,编号38膜条代表RHSE分别为“S、R、S、S”,编号4膜条代表RHSE分别为“R、R、S、S”,编号51膜条代表RHSE分别为“R、R、R、S”,编号3膜条代表RHSE分别为“R、R、R、R”;“R”代表耐药,“S”代表敏感
图1 反向斑点杂交技术检测结核分枝杆菌耐药基因的膜条显色示例图
25株耐药基因突变的菌株中,rpoB基因突变占68.0%(17/25),katG+inhA基因突变占80.0%(20/25),rpsL基因突变占52.0%(13/25),embB基因突变占12.0%(3/25)。不同突变类型各个突变基因位点的检出情况见表2。
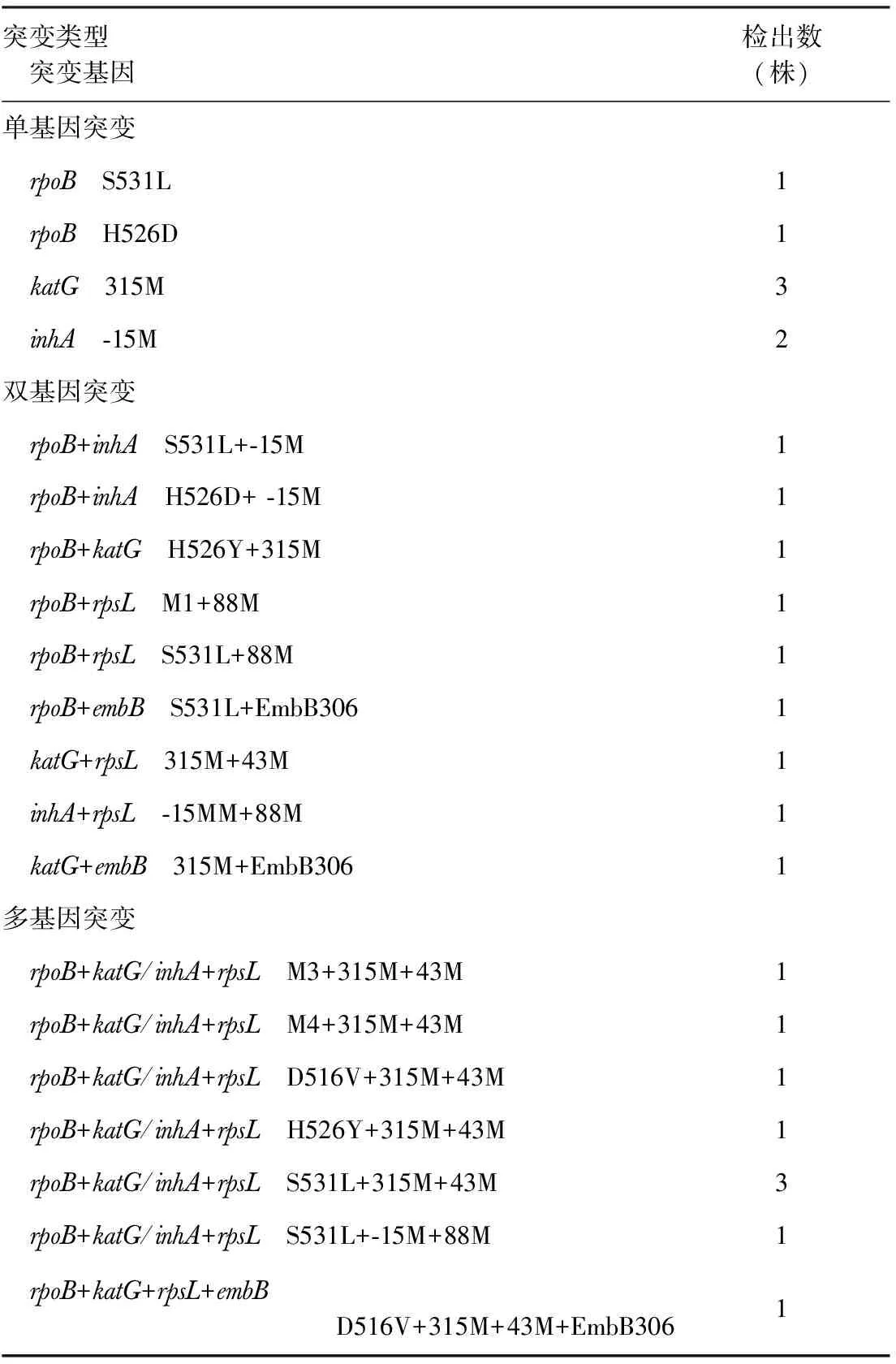
表2 不同突变基因在25株耐药菌株中的检出情况
三、反向斑点杂交法与药敏试验比较
以药敏试验结果为金标准,用反向斑点杂交法检测44株痰培养阳性Mtb菌株对抗结核药物RFP、INH、Sm、EMB耐药基因突变的敏感度、特异度、阳性预测值、阴性预测值,具体见表3。
讨 论
2011—2015年全国结核病防治规划要求,以地市级为单位开展耐多药肺结核诊治工作的覆盖率要达到50%,耐多药肺结核可疑者筛查率达到60%[5]。因此,快速准确的耐药性检测对指导临床用药以提高结核病治疗疗效,防止耐药Mtb的产生和传播具有重要意义。Mtb耐药基因芯片检测系统是将高敏感度的PCR技术和高通量的反向斑点杂交技术相结合的基因检测技术。其原理是应用生物素修饰的特异性引物扩增相关耐药基因,将带有生物素标记物的PCR产物变性后与标记在硝酸纤维素膜上的特异性探针杂交,经生物素或过氧化物酶系统显色,通过膜条上探针杂交后是否显色,来判断是否发生耐药基因突变。若突变位点显色即发生耐药基因突变,若野生位点显色即未发生耐药基因突变。
Mtb对利福平耐药主要是由于rpoB基因编码区发生了点突变、微缺失或微插入等。编码的RNA 聚合酶β亚基构象发生变化,利福平与其亲合力降低所致[6-7]。而rpoB基因是编码β亚基的编码基因,95%以上的耐利福平药物耐药菌都发生rpoB基因突变[8],突变主要集中在第507~533氨基酸位点范围内,其中80%突变与第531、526位点高度相关。异烟肼耐药则与KatG基因突变及inhA基因突变密切相关[9-10],这些突变基因都直接或间接地参与异烟肼中间活性体的形成。最常见的katG基因突变位点为第315位点,它的发生频率约为76.7%。inhA的耐异烟肼突变主要发生在其启动子区的-15位点上[11]。 耐链霉素与核糖体蛋白S12编码基因(rpsL)及16S rRNA编码蛋白(rrs)突变相关[12],而大约有69%的乙胺丁醇耐药菌株都检测出embB的突变[13],第306位密码子突变在耐药菌株中最为常见,还有第303、330位密码子的突变都能导致Mtb对乙胺丁醇耐药。
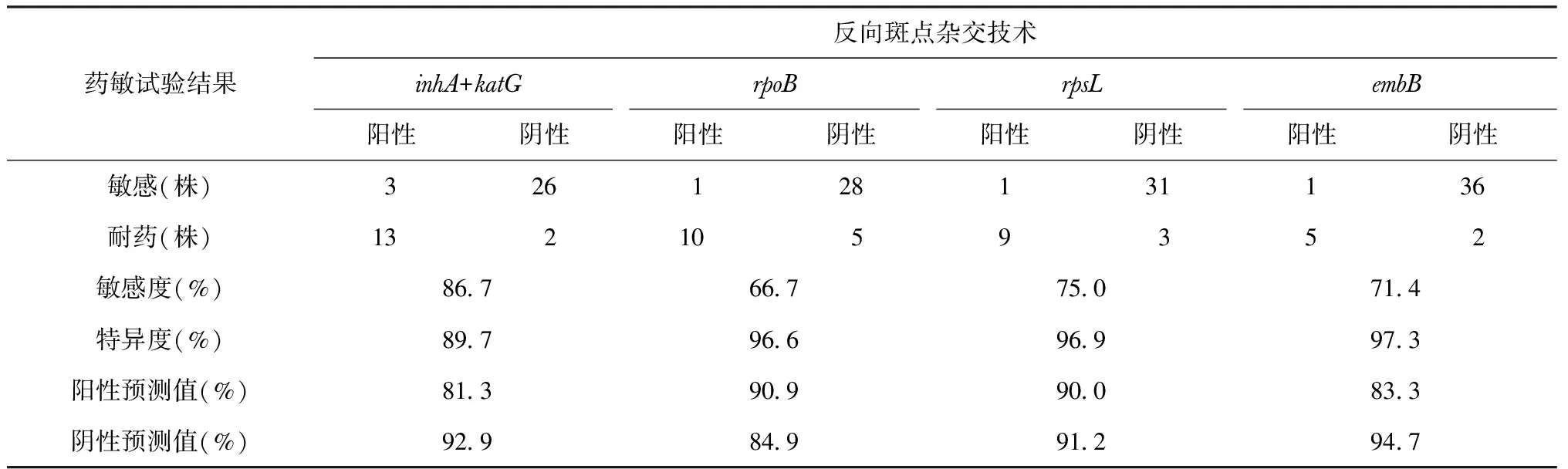
表3 药敏试验与反向斑点杂交法检测结果的对比分析
注 敏感度=药敏试验、反向斑点杂交法均阳性株数/药敏试验阳性株数×100%;特异度=药敏试验、反向斑点杂交法均阴性株数/药敏试验阴性株数×100%;阳性预测值=药敏试验、反向斑点杂交法均阳性株数/反向斑点杂交法阳性株数×100%;阴性预测值=药敏试验、反向斑点杂交法均阴性株数/反向斑点杂交法阴性株数×100%
本研究采用反向斑点杂交技术对浙江温州地区93份痰标本进行rpoB、katG、inhA、rpsL、embB基因突变检测,同时采用液体培养及药敏试验,分析该技术检测RFP、INH、Sm、EMB耐药性的敏感度、特异度等指标。研究发现,38.6%的Mtb菌株为耐药菌株,其中多重耐药菌株占耐药菌株的88.2%,说明温州地区耐药结核病的流行趋势严重。
反向斑点杂交技术检测Mtb阳性菌株57株,检出率为61.3%,与单万水等[14]报道相似。本研究中,反向斑点杂交技术检测INH、RFP、Sm、EMB的耐药基因的敏感度、特异度、阳性预测值与国内外相关报道相似[15-16]。其中,44株临床菌种与药敏试验相比,存在假阳性耐药基因突变株,出现与液体药敏结果不同的假阳性结果,可能与扩增标本中DNA是既往杀灭的Mtb的DNA,也可能是每一种药物的耐药基因突变是逐渐积累的结果,很少量的耐药菌株能扩增为阳性,但药敏试验并不一定表现为耐药,包括药敏试验过程中一些人为因素也可能导致结果的不一致。此外,仍存在未检测出突变位点的耐药菌株,尤其是检测EMB、Sm耐药株敏感度较低,可能由于探针数量的限制,突变类型在本检测芯片设计的探针之外或者存在其他的耐药机制。
目前,临床Mtb耐药性的检测以液体培养和药敏试验为主,此法不仅操作复杂、费时,一般需要4~6周,且培养困难,难以满足临床需要。GeneXpert Mtb/RIF系统虽然检测Mtb的敏感度和特异度高,但仅能检测利福平rpoB基因是否发生耐药[17]。而利用反向斑点杂交技术检测Mtb耐药法不仅能同时检测异烟肼、利福平、链霉素、乙胺丁醇是否发生耐药,还能检测出基因发生耐药突变的具体位点或区域,检测时间仅需1 d,可应用于临床Mtb耐药性的筛查,指导抗结核药物的临床选用,从而减少耐药Mtb的传播,降低耐药率和死亡率。
[1] 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室.2010年全国第五次结核病流行病学抽样调查报告.中国防痨杂志,2012,34(8):485-508.
[2] World Health Organization. Global tuberculosis report 2015. Geneva:World Health Organization,2015.
[3] 中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志,2001,24(2):70-74.
[4] 中国防痨协会.结核病诊断细菌学检验规程.中国防痨杂志,1996,18(1): 28-31.
[5] 中华人民共和国国务院办公厅.全国结核病防治规划(2011—2015年)[EB/OL].(2011-11-17)[2014-02-10].http://www.gv.cn/zwgk/2011-12/06/content_2012869.htm.
[6] de Freitas FA, Bernardo V, Gomgnimbou MK,et al. Multidrug resistantMycobacteriumtuberculosis: a retrospectivekatGandrpoBmutation profile analysis in isolates from a reference center in Brazil. PLoS One,2014,9(8):e104100.
[7] Spies FS, von Groll A, Ribeiro AW, et al. Biological cost inMycobacteriumtuberculosiswith mutations in therpsL,rrs,rpoB, andkatGgenes. Tuberculosis (Edinb),2013,93(2):150-154.
[8] 贾平平,余利岩,岑山.抗结核一线药物及结核分枝杆菌的耐药分子机制.中国抗生素杂志,2011,36(7):487-491.
[9] Fenner L, Egger M, Bodmer T,et al.Effect of mutation and genetic background on drug resistance inMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2012,56(6):3047-3053.
[10] Tseng ST, Tai CH, Li CR,et al. The mutations ofkatGandinhAgenes of isoniazid-resistantMycobacteriumtuberculosisisolates in Taiwan. J Microbiol Immunol Infect,2015,48(3):249-255.
[11] Jagielski T, Bakua Z, Roeske K,et al. Detection of mutations associated with isoniazid resistance in multidrug-resistantMycobacteriumtuberculosisclinical isolates. J Antimicrob Chemo-ther,2014,69(9):2369-2375.
[12] He J, Zhu B, Yang Z,et al. Molecular analysis of therpsLgene for rapid detection of streptomycin-resistantMycobacte-riumtuberculosis: a meta-analysis. Scand J Infect Dis, 2014,46(8):585-592.
[13] Cuevas-Córdoba B, Juárez-Eusebio DM, Almaraz-Velasco R,et al. Mutation at embB codon 306, a potential marker for the identification of multidrug resistance associated with ethambutol inMycobacteriumtuberculosis. Antimicrob Agents Chemo-ther, 2015,59(9):5455-5462.
[14] 单万水,吴驰,陈心春,等.基因芯片技术在结核分支杆菌耐药突变基因检测中的应用.国际检验医学杂志,2008,29(11):964-966.
[15] 罗丹,向延根,潘建华,等.反向斑点杂交技术检测结核分枝杆菌3种耐药相关基因.吉林大学学报(医学版),2011,37(4):759-762.
[16] Nikolayevskyy V,Balabanova Y,Simak T,et al. Performance of the Genotype MTBDRPlus assay in the diagnosis of tuberculosis and drug resistance in Samara, Russian Federation. BMC Clin Pathol,2009,9:2.
[17] 陈子芳,孙义军,孙本海.GeneXpert Mtb/RIF系统在肺结核诊断及利福平耐药检测中的应用价值.中华临床感染病杂志,2014,7(4):351-353.
(本文编辑:王然 李敬文)
10.3969/j.issn.1000-6621.2016.03.016
325000 浙江省温州市中心医院感染科(施伎蝉、蒋贤高、宁洪叶、何贵清、吴正兴、蔡玉伟、程爱琼);温州医科大学附属第一医院内科实验室(余志杰)
蒋贤高,Email:jiangxiangao368@163.com
2015-08-11)

