结核分枝杆菌新型抗原Rv3400的免疫原性研究
朱琳 徐颖 孔聪 粟海波 黄琪 朱胜玲 王洪海
结核分枝杆菌新型抗原Rv3400的免疫原性研究
朱琳 徐颖 孔聪 粟海波 黄琪 朱胜玲 王洪海
目的 用结核分枝杆菌(Mycobacteriumtuberculosis)特异性抗原Rv3400 联合弗氏不完全佐剂(incomplete Freund’s adjuvant,IFA)构建结核亚单位疫苗(Rv3400-IFA),在 C57BL/6小鼠体内评估其免疫效应。体外用抗原Rv3400感染巨噬细胞RAW264.7并评估其免疫应答。方法 PCR扩增基因Rv3400,构建重组质粒pET28a(+)-Rv3400,转入大肠埃希菌BL21(DE3)pLysS感受态细胞中,诱导表达并纯化Rv3400蛋白。用抗原Rv3400、阳性对照脂多糖(lipopolysaccharides,LPS),分别刺激小鼠巨噬细胞RAW264.7,阴性对照为未刺激的巨噬细胞,流式细胞术检测细胞表面分子表达,收集细胞培养上清,ELISA 检测细胞因子的分泌。另一方面纯化的Rv3400蛋白与IFA充分乳化构建亚单位疫苗免疫小鼠;C57BL/6小鼠采用数字表法随机分为3组,分别为实验组Rv3400组、阳性对照组Rv3425组、 阴性对照组IFA组,每组5只,每2周1次、共免疫3次。分别采用酶联免疫斑点检测技术(enzyme-linked immunospot assay,ELISPOT)和酶联免疫吸附测定(ELISA) 技术对免疫小鼠的细胞免疫和体液免疫进行评估。结果 (1)成功克隆表达并纯化结核分枝杆菌特异性抗原Rv3400。(2)体外细胞实验结果显示:Rv3400抗原刺激巨噬细胞,其表面分子CD80、CD86、CD40、MHCⅡ表达量显著提高,阳性细胞比率[分别由未刺激的(34.70±2.40)%、(31.25±18.31)%、(41.80±6.01)%、(44.30±0.44)%提高至1 μg/ml Rv3400抗原刺激后的(90.45±7.71)%、(90.10±4.10)%、(89.97±7.79)%、(85.13±5.12)%];能促进细胞分泌高水平的肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6),分别达(49 217.0±390.61)pg/ml、(1783.4±51.18) pg/ml。(3)免疫小鼠后,ELISPOT结果显示:实验组Rv3400组小鼠分泌INF-γ的斑点形成细胞(spot forming cells,SFC)(136.20±95.09)显著高于阴性对照组(14.00±9.62)(t=2.859,P<0.01);ELISA结果显示: Rv3400组小鼠T细胞产生TNF-α和IFN-γ的水平[(247.38±142.268)pg/ml、(325.45±75.19)pg/ml)]明显高于阴性对照组[(69.25±60.06)pg/ml、(2.22±1.28)pg/ml(t=2.579,P<0.05;t=8.597,P<0.01)];(4)Rv3400 组小鼠脾CD4+CD44high、CD4+CD62Llow、CD8+CD44high、CD8+CD62LlowT淋巴细胞百分比[(44.20±11.95)%,(43.56±11.90)%,(48.88±7.42)%,(47.04±7.72)%]与对照组IFA组[(27.02±6.56)%,(62.60±4.73)%, (30.57±6.00)%,(58.48±6.06)%]相比,差异有统计学意义(one-way ANOVA,F=18.460,F=8.108,F=32.194;F=4.080;P<0.05,P<0.01,P<0.01,P<0.05),呈显著性增加。(5)通过间接ELISA测定免疫后的小鼠血清抗体IgG效价水平高达1∶409 600,表明抗原Rv3400也能诱导有效的体液免疫应答;IgG2b/IgG1水平为1.8,说明抗原Rv3400诱导小鼠以Th1型免疫反应为主。结论 亚单位疫苗Rv3400-IFA 在C57BL/6 小鼠体内可产生较好的细胞免疫和体液免疫效应。结核分枝杆菌特异性抗原Rv3400有望成为新的结核病疫苗设计及诊断的候选抗原。
分枝杆菌,结核; Rv3400; 亚单位疫苗; 细胞免疫; 体液免疫
结核病(TB)是由结核分枝杆菌感染引起的重大传染病,是世界上仅次于艾滋病(AIDS)的第二大高死亡率的传染性疾病。根据WHO 2015年度报告统计,2014年全球新发结核病患者960万例,死亡高达150万例[1]。尽管大部分的肺结核是可控可治的,但每年结核病的死亡率仍然很高。卡介苗(BCG)是目前惟一用于人结核病的预防性疫苗,初生婴儿接种BCG可显著降低儿童原发性肺结核、粟粒型肺结核和结核性脑膜炎的发病率和死亡率,但对于成人肺结核的保护效率差异极大,导致成人接种BCG 的效果较差[2]。因此,亟待研究开发新型高效的结核病预防疫苗。亚单位疫苗成分明确,可以诱导有效的免疫应答,由于亚单位疫苗的保护效果难以超过BCG,对优秀的Mtb抗原,可以构建亚单位疫苗,采用BCG初始免疫-亚单位疫苗增强免疫的策略,可以提高成人的免疫效果[3]。
本实验室前期研究显示,Rv3400抗原在结核病患者的血清学检查中具有较高的敏感度和特异度。通过基因组比对发现,Mtb基因组中的一些片段在BCG 基因组中缺失,这些缺失片段被称为差异区域(region of differences,RD),Rv3400位于RD16区域,研究表明Rv3400作为水解酶,参与分枝菌酸合成途径[4]。而Mtb的生长、致病性、耐药性及抗酸特性都与菌株中所含的分枝菌酸有关,但是目前对其生物学功能还知之甚少。本实验在体外用Rv3400抗原刺激巨噬细胞,显示Rv3400抗原能促进细胞分泌高水平的白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子(tumor necrosis factor-α,TNF-α),引发较强的免疫反应;另外选择Rv3400和能引起强烈细胞免疫反应的弗氏不完全佐剂(incomplete Freund’s adjuvant,IFA)构建亚单位疫苗(Rv3400-IFA),以观察免疫动物的细胞免疫和体液免疫反应,初步评估其免疫效应,旨在寻找新型结核病亚单位疫苗,更好地预防结核病。
材料和方法
一、材料
1.菌株和细胞系:表达菌株大肠埃希菌(E.coli)BL21(DE3)pLysS(北京全式金生物技术有限公司提供), 巨噬细胞系RAW264.7由本实验室保存。
2.实验动物:实验动物为6~8周雌性C57BL/6清洁级小鼠,购自上海斯莱克实验动物有限责任公司,购买后饲养于复旦大学遗传工程国家重点实验室动物房。
3.主要试剂:pET-28a(+)质粒由本实验室保存;H37Rv基因组由上海市肺科医院提供;TransStart FastPfu DNA 聚合酶 (北京全式金生物技术有限公司提供); EcoR I、HindⅢ (日本TaKaRa公司提供);T4 DNA 连接酶 (美国New England Biolabs公司提供);20×PBS(磷酸盐缓冲液)(生工生物工程上海股份有限公司提供);亲和层析所用介质Ni-NTA(nitrilotriacetic acid,氨三乙酸) His·Bind resin(德国Novagen公司提供);弗氏不完全佐剂(incomplete Freund’s adjuvant, IFA; 德国Sigma公司提供);Mouse IFN-γ、TNF-α ELISPOT kit(PVDF)(荷兰U-CyTech biosciences公司提供);小鼠淋巴细胞分离液(加拿大Cedarlane公司提供)。流式检测所用荧光抗体: 异硫氰酸荧光素(FITC)偶联抗鼠CD62L抗体、聚乙烯(PE)/Cy5偶联抗鼠CD8a抗体、PE偶联抗鼠 CD44抗体、PE/Cy5偶联抗鼠 CD4抗体 (美国eBioscience公司提供); PE 偶联抗鼠 CD80抗体、FITC 偶联抗鼠 CD86抗体、FITC 偶联抗鼠 CD40 抗体(美国BD Biosciences公司提供);PE 偶联抗鼠 I-A/I-E抗体 (美国eBioscience公司提供);Mouse 预包被ELISA kit (深圳市达科为生物技术有限公司提供)。
二、方法
1.Rv3400的扩增及原核表达载体pET28a(+)-Rv3400的构建:以Mtb H37Rv的基因组序列为模板,用TransStart FastPfu DNA 聚合酶进行所需基因序列的扩增。上游引物的序列为:5′-CCGGAATTCATGGCGAACTGGTATCGCCC-3′(下划线部分为EcoR I酶切位点),下游引物序列为: 5′-CCCAAGCTTCTACAGCAGCTCGGCGAGAT-CG-3′(下划线部分为Hind Ⅲ酶切位点),预期得到的目的片段大小为789 bp。用 EcoRⅠ和Hind Ⅲ双酶切基因产物, 回收的目的片段与同样酶切后的pET28a(+)载体连接, 转化E.coliDH5α感受态细胞。挑选2个菌落, 分别接种于3 ml含50 μg/ml卡纳霉素的LB(Luria-Bertani)培养液, 37 ℃ 振荡培养过夜。碱裂解法提取质粒DNA, 用EcoRⅠ和Hind Ⅲ双酶切,琼脂糖凝胶电泳鉴定重组质粒正确后,将重组质粒pET28a(+)-Rv3400送至上海睿迪生物科技有限公司测序,将测序正确的质粒转化至E.coliBL21(DE3)PLysS感受态,挑选阳性克隆用于蛋白表达。
2. Rv3400蛋白的诱导表达及纯化:将构建好的表达菌株BL21(DE)-pET28a(+)-Rv3400接到3 ml含50 μg/ml卡纳霉素的LB培养液,过夜培养。将过夜培养物以1∶50的体积比稀释后,37 ℃摇床,转速为180 转/min,培养至吸光度(A)在波长600 nm时=0.4~0.6,加入β-硫代半乳糖苷(IPTG)使其终浓度为0.5 mmol/L,28 ℃诱导过夜,诱导产物通过12%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)进行分析。按照上述确定的最佳条件扩大培养,离心收菌,用PBS将菌体重悬后进行超声波破碎菌体,收集上清。利用Novagen公司的纯化柱纯化目的蛋白,将纯化、透析后得到的蛋白样品置于-70 ℃保存。
3. 细胞实验:将培养好的巨噬细胞RAW264.7计数后以每孔5×105个细胞铺24孔板,将细胞培养过夜后分别加入终浓度为1 μg/ml、10 μg/ml 的Rv3400抗原,阳性对照为用1 μg/ml 脂多糖(LPS),阴性对照为未刺激的细胞,放置在37 ℃、 5% CO2、100%湿度的条件下静置培养,分别于24、48、72 h后收集细胞,重悬于PBS中洗2~3次,加入相应的荧光标记抗体,室温避光孵育30 min,洗涤后重悬于PBS中,滤膜过滤进行流式细胞检测表面分子CD80、CD86、CD40、MHCⅡ的表达量;收集细胞上清ELISA 检测细胞因子TNF-a、IL-6的分泌情况。实验重复3次。
4. 免疫小鼠实验:将小鼠按数字表法随机分成3组,每组5只。选取本实验室的优秀抗原Rv3425作为阳性对照组Rv3425组,实验组Rv3400组,阴性对照组IFA组。免疫方法为皮下注射;免疫策略:用50 μg纯化好的蛋白Rv3425、Rv3400和等体积IFA充分乳化混匀,阴性对照组每只小鼠免疫50 μl IFA。分别于第1、3、5周免疫3次,于第7周取小鼠眼球血处死小鼠,取脾脏分离脾淋巴细胞进行免疫指标的检测。
5.检测方法:(1)采用流式细胞术检测脾淋巴细胞CD4+CD44highCD62Llow、CD8+CD44highCD62LlowT细胞百分比。计数后的脾淋巴细胞悬液加入到12孔板中,每孔加入2.5×105个细胞(500 μl),蛋白Rv3425、Rv3400刺激物浓度为10 μg/ml,混合均匀,于37 ℃,5% CO2培养箱中培养36 h。离心后收集计数后培养的脾淋巴细胞并收集细胞沉淀,重悬于PBS中洗2~3次,加入相应的荧光标记抗体,避光孵育30 min,洗涤后重悬于PBS中,滤膜过滤进行流式细胞检测,FlowJo7.6软件分析结果。(2)采用ELISPOT检测脾淋巴细胞细胞因子IFN-γ分泌水平。处死小鼠后,分离小鼠淋巴细胞,免疫细胞以2.5×105个细胞(500 μl)接种,加入同体积的蛋白刺激物(刺激物浓度为10 μg/ml,1640双抗培养基稀释至相应的浓度),混合均匀,于37 ℃,5% CO2湿度培养箱中培养36 h,按照试剂盒说明书检测脾细胞细胞因子分泌,板子干燥完全后,送至达科为生物技术有限公司读板计数斑点。(3)采用ELISA检测脾淋巴细胞上清细胞因子IFN-γ、TNF-α、IL-4分泌。收集细胞培养36 h的上清用于细胞因子检测,按试剂盒说明书进行实验操作,所用的试剂盒为mouse IFN-γ、TNF-α、IL-4预包被ELISA kit。(4)采用ELISA检验外周血免疫球蛋白抗体IgG、IgG1、IgG2b水平。采集小鼠眼球外周血并分离血清,用包被缓冲液稀释抗原(Rv3425、Rv3400)至适当浓度(5 μg/ml),每孔加入100 μl 抗原,4 ℃包被过夜,封闭1 h,按照对比稀释的方法加入从1/400 开始对比稀释的血清,孵育1 h,分别加入辣根过氧化物酶(HRP)标记的羊抗鼠IgG、IgG1、IgG2b二抗抗体,孵育后显色终止,450 nm处读板,空白组为对照。
结 果
一、 Rv3400蛋白的诱导表达及纯化
对经IPTG诱导的重组菌株BL21(DE)-pET28a(+)-Rv3400进行SDS-PAGE分析,在相对分子质量28 000处出现目的蛋白条带,而空载体菌株BL21(DE)-pET28a(+)无此条带。表明Rv3400基因在大肠杆菌中得到了成功表达。目的蛋白在细菌裂解上清和包涵体均有表达,主要在上清表达,收集上清用Ni-NTA 亲和纯化柱纯化目的蛋白,得到较高纯度的蛋白(图1)。
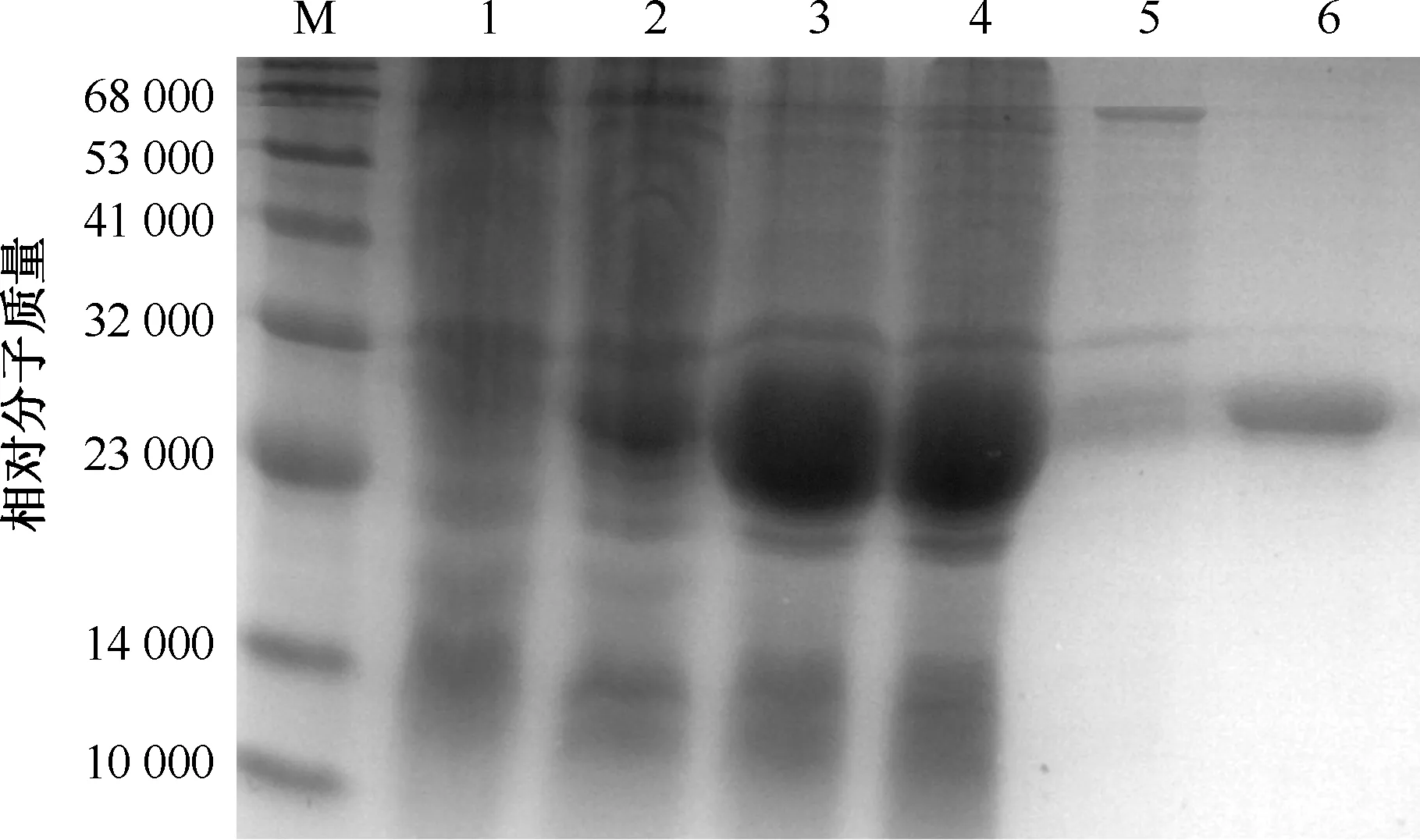
M:蛋白质分子质量标准;1:未诱导重组BL21(DE)-pET28a(+);2:未诱导重组BL21(DE)-pET28a(+)-Rv3400全菌;3:诱导后重组BL21(DE)-pET28a(+)-Rv3400全菌;4:诱导后重组BL21(DE)-pET28a(+)-Rv3400上清;5:诱导后重组BL21(DE)-pET28a(+)-Rv3400沉淀;6:Ni-NTA 纯化后的Rv3400蛋白(相对分子质量28 000)图1 重组蛋白Rv3400纯化的SDS-PAGE电泳分析
二、细胞实验
1.流式细胞术检测巨噬细胞表面分子CD80、CD86、CD40、主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ表达:用1 μg/ml、10 μg/ml Rv3400抗原, 1 μg/ml LPS分别刺激巨噬细胞,放置在37 ℃、 5% CO2、100%湿度的条件下静置培养24、48、72 h后,分别收集巨噬细胞进行流式细胞术检测。未刺激的巨噬细胞做阴性对照。结果用FlowJo 7.6软件分析,以未刺激的巨噬细胞表达CD80、CD86、CD40、MHCⅡ阳性细胞为基准画门,得到1 μg/ml、10 μg/ml Rv3400抗原、1 μg/ml LPS刺激的巨噬细胞表达CD80、CD86、CD40、MHCⅡ阳性细胞百分比。检测抗原刺激细胞后的3个时间相比,刺激24 h后的巨噬细胞表面分子表达量最高。如表1所示,与未刺激的巨噬细胞相比,用1 μg/ml、10 μg/ml Rv3400抗原刺激巨噬细胞后的CD80表达量显著提高,差异有显著统计学意义(one-way ANOVA:F=104.198,P<0.01);CD86、CD40、MHCⅡ的表达而言,用1 μg/ml、10 μg/ml Rv3400抗原刺激巨噬细胞后表达量同样显著提高,差异有显著统计学意义[one-way ANOVA:F=19.900,F=83.567,F=210.811,P值均<0.01];说明Rv3400抗原可以促进巨噬细胞的分化成熟。
2. ELISA检测细胞培养上清特异性TNF-α、IL-6的水平:收集不同抗原刺激的巨噬细胞培养上清,ELISA检测细胞TNF-α、IL-6分泌情况。结果如表2所示,与未刺激的细胞相比,Rv3400蛋白刺激的巨噬细胞分泌TNF-α、IL-6的能力显著升高。1 μg/ml Rv3400、10 μg/ml Rv3400抗原刺激的细胞TNF-α分泌水平与未刺激的细胞相比差异有显著统计学意义(one-way ANOVA,F=377.715,P<0.01),;IL-6的分泌水平来说,10 μg/ml Rv3400抗原刺激细胞的分泌水平高于1 μg/ml Rv3400抗原刺激的分泌水平,差异有统计学意义;1 μg/ml Rv3400刺激的细胞IL-6分泌水平与未刺激的细胞IL-6分泌水平相比无统计学差异(one-way ANOVA,F=10.524,P<0.05);未刺激的巨噬细胞TNF-α、IL-6的分泌水平极低。
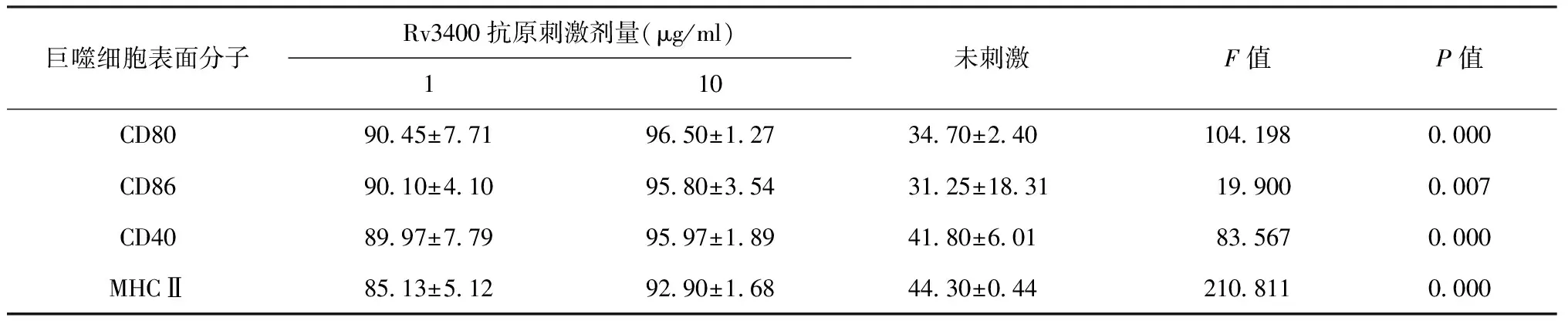
表1 巨噬细胞表面分子CD80、CD86、CD40、MHCⅡ表达量(采用不同剂量Rv3400抗原刺激巨噬细胞24 h后与未刺激巨噬细胞表达量比较)

表2 采用不同剂量Rv3400抗原刺激巨噬细胞24 h后与未刺激组细胞因子分泌量
二、动物实验
1.流式细胞术检测脾CD4+CD44highCD62Llow、CD8+CD44highCD62LlowT淋巴细胞分群:如图2所示,Rv3400组的小鼠可以诱导CD4+、CD8+T淋巴细胞表面分子CD44显著性上调和CD62L 显著性下调。Rv3400组CD4+CD44+、CD8+CD44+双阳性T淋巴细胞百分比[(44.20±11.95)%,(48.88±7.42)%]与对照组IFA组[(27.02±6.56)%,(30.57±6.00)%]相比,差异有统计学意义(one-way ANOVA,F=18.460,F=32.194;P<0.05,P<0.01),T淋巴细胞表面的CD44受到特异性抗原刺激后表达明显升高;CD62L的表达来说,Rv3400组小鼠T淋巴细胞CD4+CD62L+,CD8+CD62L+百分比[(43.56±11.90)%,(47.04±7.72)%]显著性降低(one-way ANOVA,F=8.108,F=4.080;P<0.01,P<0.05),而对照组IFA组CD4+CD62L+,CD8+CD62L+T淋巴细胞比率为(62.60±4.73)%,(58.48±6.06)%。
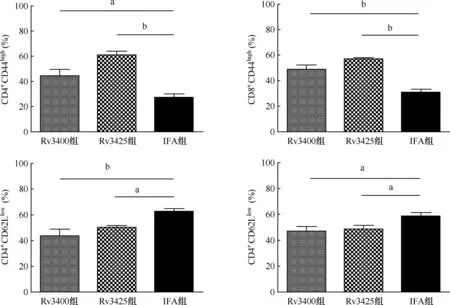
one-way ANOVA,最小显著性差异法(LSD)比较组间差异,a:P<0.05;b:P<0.01图2 CD4+CD44high、 CD4+CD62Llow, CD8+CD44high、 CD8+CD62Llow T淋巴细胞百分比
2.ELISPOT方法检测各组小鼠脾淋巴细胞特异性分泌IFN-γ的水平:在特异性抗原刺激下,实验组小鼠Rv3400组脾淋巴细胞特异性分泌IFN-γ的细胞数[斑点形成细胞(sport forming cells, SFC)]显著高于阴性对照组(成组t检验,t=2.859,P<0.05),免疫效果与阳性对照组Rv3425组差异无统计学意义(图3)
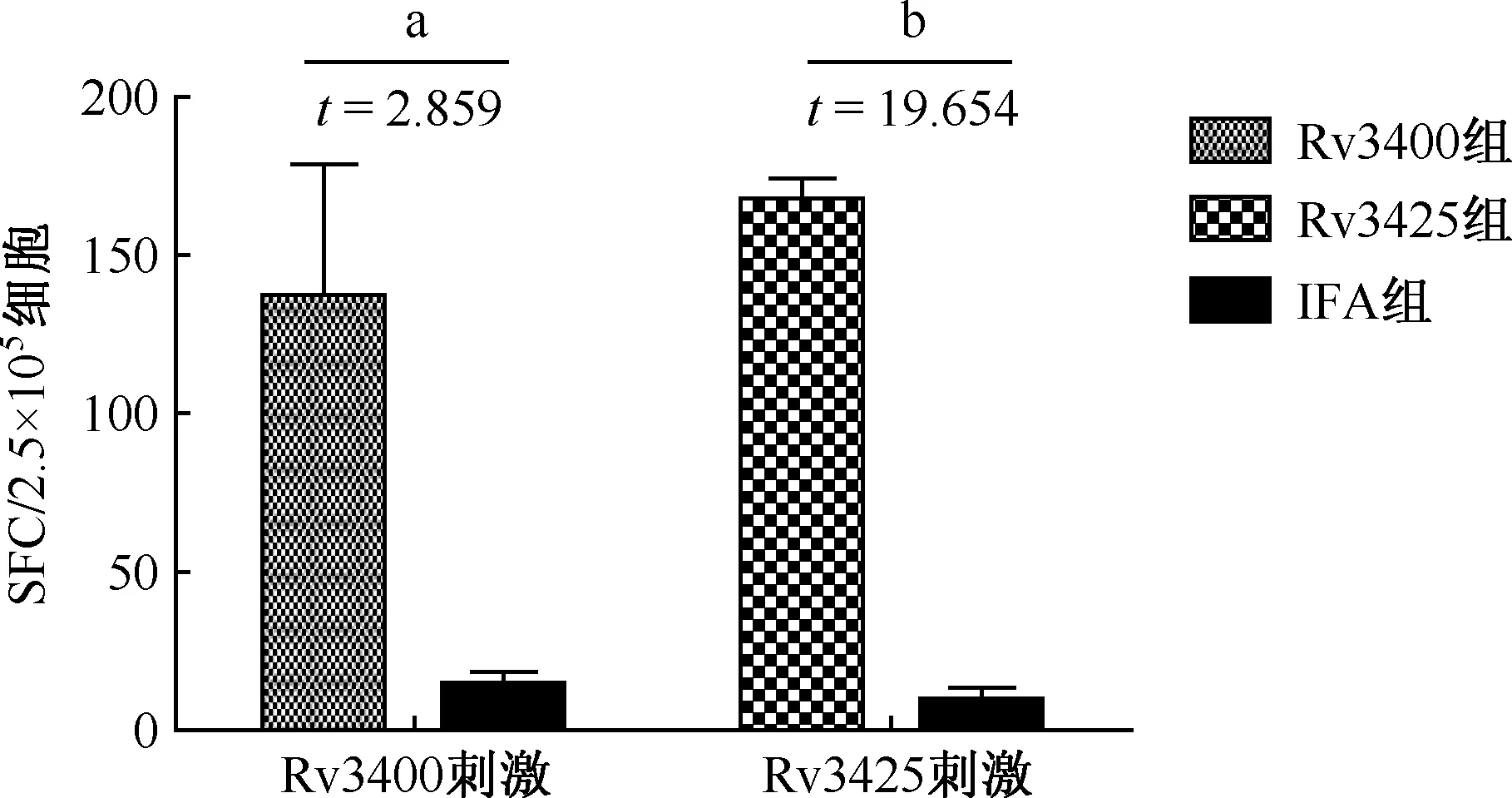
SFC/2.5×105细胞: 2.5×105个细胞中的SFC;成组t检验,a:P<0.05,b:P<0.01图3 ELISPOT 检测免疫小鼠脾淋巴细胞特异性分泌IFN-γ水平
3. ELISA检测脾淋巴细胞培养上清特异性TNF-α、 IFN-γ、IL-4的水平:在特异性抗原刺激下,与对照组IFA组相比,Rv3400组小鼠有更好的TNF-α和IFN-γ的分泌能力,差异有统计学意义(成组t检验,t=2.578,P=0.033;t=8.587,P=0.003);IL-4的分泌水平很低,且各组间的水平差异无统计学意义,说明Rv3400倾向于引起Th1型的免疫反应。
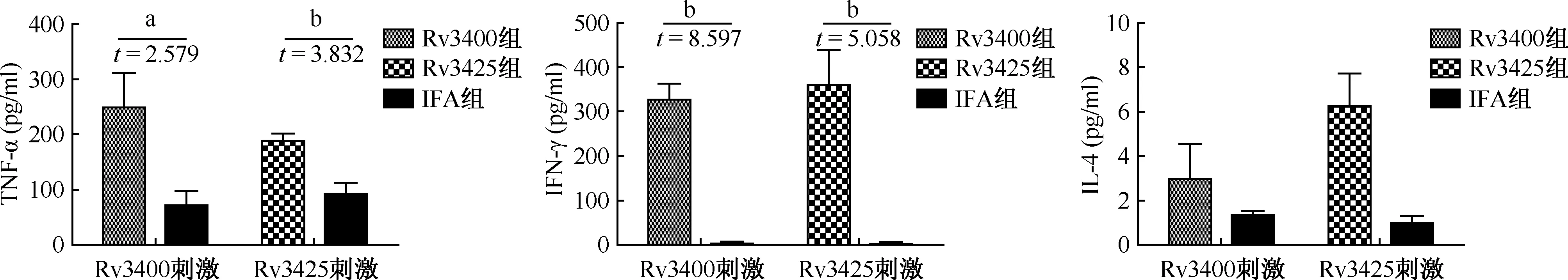
成组t检验,a:P<0.05;b:P<0.01图4 ELISA 检测小鼠脾淋巴细胞培养上清特异性细胞因子TNF-α、 IFN-γ、IL-4的分泌
4. ELISA检验外周血免疫球蛋白IgG、IgG2b/IgG1水平:用抗原Rv3400,Rv3425预包被ELISA 96孔板,对比稀释血清,检测小鼠血清中IgG的效价来评价抗原Rv3400引起小鼠体液免疫水平的变化。结果如图5所示,Rv3400蛋白有较高的抗体IgG滴度,抗体效价达1∶409 600,与Rv3425的效果相当。说明抗原Rv3400能诱导小鼠产生特异性抗体。对IgG2b/IgG1水平来说,同组的血清IgG2b水平高于IgG1水平(如图6),比值为1.8,说明抗原Rv3400诱导小鼠Th1型免疫反应为主,而结核病的保护性免疫恰恰与一个强的Th1型T细胞反应的建立有关。

图5 用抗原Rv3400、Rv3425预包被ELISA 96孔板,对比稀释血清后血清中IgG抗体水平的检测结果
讨 论
结核病是当前危害人类健康的严重公共卫生问题,是世界上由单病原菌引起的死亡人数最多、造成危害性最大的疾病。而目前惟一使用的结核病预防疫苗卡介苗保护效果不理想,近年来结核病的发病率一直居高不下且致死率高,蛋白亚单位疫苗作为新型抗结核疫苗的一种,具有其安全性优势,还可以特异性诱导CD4+T细胞和CD8+T淋巴细胞活化,是较为理想的疫苗之一[5]。
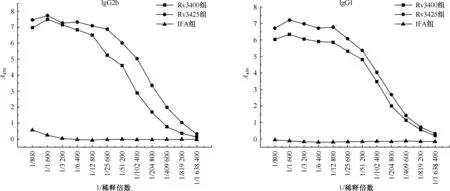
图6 用抗原Rv3400、Rv3425预包被ELISA 96孔板,对比稀释血清后血清中IgG2b、IgG1抗体水平的检测结果
结核分枝杆菌是一种胞内寄生菌,在结核分枝杆菌入侵时,宿主会启动第一道防线即天然免疫系统来抵抗结核分枝杆菌的感染,在天然免疫系统中,巨噬细胞、自然杀伤细胞等对于结核感染起重要作用[6]。结核分枝杆菌通过Toll样受体(TLR)等模式识别受体, 激活巨噬细胞的天然免疫反应, 清除细菌和调节获得性免疫反应。CD80、CD86是表达在抗原提呈细胞(APC)表面的重要协同刺激分子,是T细胞活化的必需共刺激信号。未受抗原刺激的APC几乎不表达CD80、CD86分子,但经活化后CD80、CD86的表达显著上调[7]。CD40可直接诱导共刺激分子CD80、CD86 的表达。有文献报道, 表达于巨噬细胞表面的CD40与T细胞表面CD40L结合能促使溶酶体与吞噬小体融合, 促进病原体的清除[8-10]。CD40是在抗原提呈细胞表面的共刺激因子,其可以通过NF-kB上调IL-6、黏附分子CD54和抗凋亡蛋白的表达, 促进细胞增殖。巨噬细胞通过调节其表面分子如CD80、CD86、MHCⅠ和MHCⅡ来激活 Toll样受体2通路,是机体激发固有免疫和适应性免疫的关键[11];MHCⅡ是免疫系统调节的重要组成部分,巨噬细胞表面MHCⅡ的表达是完成抗原提呈的必须条件,分子抗原与抗原多肽结合并将抗原呈递给CD4+T细胞,进而诱导其产生细胞因子[12]。
巨噬细胞在细胞免疫中还起到重要的效应器作用,在结核分枝杆菌和其他细胞因子的刺激下,能够产生多种细胞因子,如: IL-6、TNF-α等[13]。TNF-α对于机体包围感染部位防止扩散起到很重要的作用[14]。IL-6 和TNF-α、IL-1β一起启动早期炎症反应,增强T细胞和B细胞反应[15]。本研究用重组表达的抗原Rv3400蛋白体外刺激小鼠巨噬细胞系,显示Rv3400可以诱导巨噬细胞表面分子CD80、CD86、CD40、MHCⅡ表达增加,提高巨噬细胞的抗原提呈能力,参与T细胞的激活。同时Rv3400刺激巨噬细胞能够产生高水平的促炎因子IL-6和TNF-α的分泌。因此,结核杆菌特异性抗原Rv3400可以增强巨噬细胞的活性,更有效地激活T细胞,有利于机体识别结核分枝杆菌,抵抗结核分枝杆菌的早期感染。
本实验将Rv3400蛋白与佐剂混合后免疫小鼠,实验结果显示Rv3400蛋白能够有效诱导脾脏淋巴细胞产生特异性的IFN-γ和TNF-α, Rv3400组显著高于对照组IFA组(P<0.01),并且分泌水平显著高于诱导产生的IL-4的分泌水平,呈现显著的Th1型免疫应答趋势。结核分枝杆菌为胞内寄生菌,一般认为在控制结核分枝杆菌感染过程中以CD4+T 细胞产生IFN-γ为特征的Th1 型免疫应答起重要作用[13-14]。IFN-γ是控制结核分枝杆菌感染的关键性Ⅰ型细胞因子,可以诱导Th0细胞向Th1 细胞分化[16],从而激活巨噬细胞,参与免疫应答。TNF-α作为主要的Ⅰ型细胞因子在宿主结核肉芽肿的形成和维持过程中起着关键作用。Th0细胞在IL-4的诱导下分化成Th2细胞。Th2细胞通过分泌IL-4、IL-5、IL-6等促进B细胞的增殖分化和形成抗体,介导体液免疫应答。在IFN-γ的检测中,笔者运用了ELISPOT和ELISA两种检测方法,检测结果一致,都能很好地反映细胞产生IFN-γ的水平差异;ELISPOT作为ELISA的改良技术,更灵敏,结果更直观。
免疫记忆是评价疫苗的重要因素,T细胞中CD44highCD62Llow的表达是评价一个疫苗免疫记忆效应的重要指标。本实验表明,Rv3400/IFA免疫的小鼠脾淋巴细胞有更明显的CD4+CD44highCD62Llow、CD8+CD44highCD62Llow分群。CD44、CD62L 是效应型记忆T 细胞的表面标志[17]。一般来说,效应型记忆T细胞的表面表达CD44highCD62Llow表型。CD44是存在于淋巴细胞表面的蛋白,是淋巴细胞外渗到炎症部位的重要调节因子。受到刺激后其上调是所有记忆T细胞的标志[18]。CD62L是被认为的是初始T细胞(即未接触到特异性抗原的一类T细胞)表面的归巢受体。其在T细胞群被激活后是下调的[19]。有研究表明,受到感染后CD4+、CD8+T细胞表面分子CD62L表达下调,CD44表达上调[18]。因此,抗原Rv3400显示出很好的免疫记忆性。
本实验采用间接ELISA对小鼠血清中的抗体效价进行检测,Rv3400/IFA 组小鼠的抗体IgG滴度显著高于对照组IFA组,抗体IgG效价水平高达1∶409 600说明亚单位疫苗Rv3400/IFA 不仅可以刺激小鼠的细胞免疫反应,又可以使小鼠体内产生高滴度的抗体水平。IgG1是依赖Th2途径免疫应答的特征性标志, 而IgG2b是依赖Th1途径免疫应答的特征性标志。本研究中免疫小鼠免疫Rv3400/IFA后,其IgG2b水平高于IgG1,说明抗原Rv3400诱导小鼠Th1型免疫反应为主,且可以引起持久的Th1型免疫反应。
综上结果表明: 体外巨噬细胞实验显示, 抗原Rv3400能够诱导高水平IL-6 和TNF-α的分泌,增加巨噬细胞表面分子CD80、CD86、CD40、MHCⅡ的表达,提高巨噬细胞吞噬能力;抗原Rv3400联合不完全佐剂IFA免疫小鼠后增强小鼠TNF-α、IFN-γ分泌能力,引起抗原特异性的Th1 型细胞免疫应答;小鼠有明显的CD4+CD44highCD62Llow、CD8+CD44highCD62Llow分群,显示良好的免疫记忆性,同时促进血清IgG水平增加,可以引起强烈的体液免疫,Rv3400有望成为新的结核疫苗设计的候选抗原。
[1] World Health Organization.Global tuberculosis report 2015[R/OL]. Geneva: World Health Organization, 2015[2015-09-18]. http://www.who.int/tb/publications/global_report/en/.
[2] Aagaard C,Hoang T,Dietrich J,et al.A multistage tuberculosis vaccine that confers efficient protection before and after exposure.Nat Med,2011,17(2):189-194.
[3] 柴雪敏,黎友伦.结核分枝杆菌Ag85复合物相关疫苗研究进展.中国防痨杂志,2013,35(4):282-285.
[4] Takayama K,Wang C,Besra GS.Pathway to synthesis and processing of mycolic acids inMycobacteriumtuberculosis.Clin Microbiol Rev, 2005,18(1):81-101.
[5] Andersen P, Kaufmann SH. Novel vaccination strategies against tuberculosis.Cold Spring Harb Perspect Med,2014,4(6).pii:a018523.
[6] 沈洪波,陈维政.结核病疫苗研究进展.生命的化学,2014,34(1):39-45.
[7] Cantrell D.Signaling in lymphocyte activation.Cold Spring Harb Perspect Biol, 2015,7(6).pii:a018788.
[8] Atochina O,Harn D.LNFPⅢ/LeX-stimulated macrophages activate natural killer cells via CD40-CD40L interaction.Clin Diagn Lab Immunol,2005,12(9):1041-1049.
[9] Li H,Nord EP.CD40/CD154 ligation induced mononuclear cell adhesion to human renal proximal tubule cells via increased ICAM-1 expression.Am J Physiol Renal Physiol,2005,289(1):145-153.
[10] Poe JC,Wagner DH Jr,Miller RW,et al.IL-4 and IL-10 modulation of CD40-mediated signaling of monocyte IL-1 beta synthesis and rescue from apoptosis.J Immunol,1997,159(2):846-852.
[11] Kawai T,Akira S. Pathogen recognition with Toll-like receptors. Curr Opin Immunol,2005,17(4):338-344.
[12] Brennan MJ,Delogu G.The PE multigene family: a ‘molecular mantra’ for mycobacteria. Trends Microbiol,2002,10(5):246-249.
[13] George PJ, Anuradha R, Kumaran PP,et al. Modulation of mycobacterial-specific Th1 and Th17 cells in latent tuberculosis by coincident hookworm infection. J Immunol, 2013,190(10):5161-5168.
[14] Caccamo N, Guggino G, Joosten SA, et al.Multifunctional CD4(+) T cells correlate with activeMycobacteriumtuberculosisinfection. Eur J Immunol, 2010,40(8):2211-2220.
[15] Singh PP, Goyal A.Interleukin-6:a potent biomarker of mycobacterial infection.Springerplus,2013,2:686.
[16] Shaban K,Amoudy HA,Mustafa AS.Cellular immune responses to recombinant Mycobacterium bovis BCG constructs expressing major antigens of region of difference 1 ofMycobacteriumtuberculosis.Clin Vaccine Immunol,2013,20(8):1230-1237.
[17] Talat N,Shahid F,Perry S,et al.Th1/Th2 cytometric bead array can discriminate cytokine secretion from endogenously activated cells in pulmonary disease, recent and remote infection in tuberculosis. Cytokine,2011,54(2):136-143.
[18] DeGrendele HC, Estess P, Siegelman MH.Requirement for CD44 in activated T cell extravasation into an inflammatory site. Science,1997, 278(5338):672-675.
[19] Høgevold HE,Moen O, Fosse E, et al.Effects of heparin coating on the expression of CD11b, CD11c and CD62L by leucocytes in extracorporeal circulation in vitro.Perfusion,1997,12(1):9-20.
(本文编辑:薛爱华)
Immunologenicity of specific antigen Rv3400 ofMycobacteriumtuberculosis
ZHULin,XUYing,KONGCong,SUHai-bo,HUANGQi,ZHUSheng-ling,WANGHong-hai.
SchoolofLifeSciencesFudanUniversity,Shanghai200438,China
Correspondingauther:WANGHong-hai,Email:hhwang@fudan.edu.cn
Objective To construct a subunit vaccine (Rv3400-IFA) by combining specific antigen Rv3400 ofMycobacteriumtuberculosiswith incomplete Freund’s adjuvant (IFA), to assess its immune effects in C57BL/6 mice and by infecting the macrophages RAW264.7 with antigen Rv3400. Methods TheRv3400 gene fragment was amplified by PCR, and inserted into plasmid pET28a(+). The protein Rv3400 was expressed inE.coliBL21 (DE3) pLysS and purified. The macrophages RAW264.7 were divided into 3 groups including positive control group [treated with 1 μg/ml lipopolysaccharides (LPS)], test group (treated with 1 μg/ml Rv3400), negative control group (no treated), the expression of cell surface markers was examined by flow cytometry, and cell culture supernatant was collected and detected the cytokines secreted by ELISA. Rv3400 protein and IFA were equally mixed and emulsified. The C57BL/6 mice were randomly divided into 3 groups with each group 5 mice including test group (treated with Rv3400-IFA), positive control group (treated with Rv3425-IFA), negative control group (treated with IFA), immunized 3 times at 2 week interval. The humoral and cellular immune responses in mice were analysed by enzyme-linked immunospot assay (ELISPOT), ELISA and flow cytometry. Results (1) The Rv3400 protein was successfully expressed and purified. (2) The macrophages were stimulated with 1 μg/ml Rv3400 antigen, significantly improved the expression of surface markers CD80 [from (34.70±2.40)% to (90.45±7.71)%], CD86 [from (31.25±18.31)% to (90.10±4.10)%], CD40 [from (41.80±6.01)% to (89.97±7.79)%] and MHCⅡ [from (44.30±0.44)% to (85.13±5.12)%], and promoted pro-inflammatory cytokine production [TNF-α (49 217.0±390.61)pg/ml, IL-6 (1783.4±51.18)pg/ml]. (3) The spot forming cells (SFC) of IFN-γ in mice immunized with Rv3400-IFA was (136.20±95.09), significantly higher than that in IFA group (14.00±9.62) (t=2.859,P<0.01). The TNF-α and IFN-γ levels in spleen lymphocyte culture supernatants were (247.38±142.268)pg/ml and (325.45±75.19)pg/ml respectively, significantly higher than those in IFA group [(69.25±60.06)pg/ml and (2.22±1.28)pg/ml] (t=2.579,P<0.05;t=8.597,P<0.01). (4) The percentages of CD4+CD44high[(44.20±11.95)%], CD4+CD62Llow[(43.56±11.90)%], CD8+CD44high[(48.88±7.42)%] and CD8+CD62LlowT cells [(47.04±7.72)%] in Rv3400-IFA group were significantly higher than those in IFA group [(27.02±6.56)%,(62.60±4.73)%, (30.57±6.00)% and (58.48±6.06)%], (one-way ANOVA,F=18.460,F=8.108,F=32.194;F=4.080;P<0.05,P<0.01,P<0.01,P<0.05). (5) The serum IgG level in test group was as high as 1∶409 600. The level of IgG2b/IgG1 was 1.8. Conclusion The subunit vaccine Rv3400-IFA can induce strong humoral and cellular immune responses in C57BL/6 mice.MycobacteriumtuberculosisRv3400 protein may be a novel candidate antigen for designing the TB vaccine and diagnosing the TB.
Mycobacteriumtuberculosis; Rv3400; Subunit vaccine; Cellular immunity; Humoral immunity
10.3969/j.issn.1000-6621.2016.03.010
“十二五”国家科技重大专项(2012ZX10003008)
200438,上海,复旦大学生命科学学院
王洪海,Email:hhwang@fudan.edu.cn
2015-10-20)

