趋化因子5和趋化因子受体5基因多态性与肺结核易感性的关系
王慧琳 王伟 刘京铭 李传友 高孟秋
趋化因子5和趋化因子受体5基因多态性与肺结核易感性的关系
王慧琳 王伟 刘京铭 李传友 高孟秋
目的 探讨趋化因子5(CCL5)及趋化因子受体5(CCR5)基因多态性与肺结核(pulmonary tuberculosis, PTB)易感性的关系。方法 选取2014年2月至2015年4月首都医科大学附属北京胸科医院收治的PTB患者作为病例组,共494例;选取413名健康志愿者作为对照组。采集研究对象静脉血,使用竞争性等位基因特异性PCR方法检测其CCL5启动子区rs2107538和CCR5启动子区rs1799987基因型,计算病例组和对照组的基因型及等位基因频率,并对其分布情况进行比较,分析各基因多态性与PTB患病的相关性。结果 CCL5启动子区rs2107538基因-403位点GG、GA、AA基因型及等位基因G、A的频次和频率病例组分别为:202(41%)、224(45%)、68(14%)和628(64%)、360(36%);对照组分别为:152(38%)、209(51%)、52(13%)和513(62%)、313(38%),两组之间基因型分布和等位基因分布差异均无统计学意义(χ2值分别为2.50和0.35,P值均>0.05)。CCR5启动子区rs1799987基因-2459位点AA、AG、GG基因型及等位基因A、G的频次和频率病例组分别为:99(20%)、272(55%)、123(25%)和470(48%)、518(52%);对照组分别为:67(16%)、210(51%)、136(33%)和344(42%)、482(58%),两组之间基因型分布和等位基因分布差异均有统计学意义(χ2值分别为7.62和6.14,P值均<0.05)。携带该位点基因型GG和等位基因G可降低PTB患病风险[OR(95%CI)值分别为:0.68(0.50~0.91)、0.78(0.64~0.94)]。结论 CCL5启动子区rs2107538基因多态性与PTB患病无相关性;携带CCR5启动子区rs1799987基因-2459位点基因型GG和等位基因G可降低PTB患病风险。
趋化因子类; 多态性,单核苷酸; 结核,肺; 疾病易感性
肺结核(pulmonary tuberculosis, PTB)是Mtb感染引起的慢性传染性疾病。目前,全球约有1/3的人感染了Mtb,但仅有5%~10%发展为PTB[1],这表明PTB发病存在个体差异。Mtb感染引起免疫应答时,趋化因子及其受体调节免疫细胞到达感染部位。进一步研究发现,含有Mtb气溶胶吸入人体后,通过形成特征性肉芽肿及多种免疫细胞间的相互作用,可有效控制其感染[2],而这一过程中趋化因子5(CCL5)起重要作用。CCL5优先通过与受体趋化因子受体5(CCR5)结合[3],募集γ-干扰素(IFN-γ)、抗原特异性T细胞、中性粒细胞及单核细胞等到达炎症组织,促进肉芽肿形成[2]。CCL5启动子区rs2107538基因突变和CCR5启动子区rs1799987基因突变影响其转录活性[4-5],与PTB易感性可能存在一定关系。目前,以上2个基因位点多态性与PTB易感性相关性报道较少,值得进一步研究。本研究应用快速、简便的竞争性等位基因特异性PCR (kompetitive allele specific PCR,KASP)分型技术,探讨CCL5的rs2107538及CCR5的rs1799987基因型和等位基因在PTB人群与健康人群中分布情况,分析其基因多态性与PTB易感性的关系。
资料和方法
1.对象:选取2014年2月至2015年4月首都医科大学附属北京胸科医院收治的确诊PTB患者(有细菌学证据者)和临床诊断PTB患者(无细菌学证据,有影像学证据、可疑临床症状,并排除其他肺部疾病者)作为病例组,共494例。所有患者均符合诊断标准[6],排除癌症患者、糖尿病患者、长期使用免疫抑制剂者及HIV感染免疫功能低下者。选取2014年2月至2015年4月胸科医院查体确诊既往无结核病史,胸部X线摄片检查未见异常,结核菌素皮肤试验硬结平均直径小于5 mm,结核感染T细胞斑点试验(T-SPOT.TB)结果阴性的健康志愿者作为对照组,共413名。排除两组中存在血缘关系者。
研究对象中病例组494例,包括男300例(60.7%),女194例(39.3%);平均年龄为(35.0±15.0)岁,均为汉族;其中,确诊PTB患者213例,临床诊断PTB患者281例。对照组共413名,包括男240名(58.1%),女173名(41.9%);均为汉族,平均年龄为(33.9±12.8)岁。病例组和对照组年龄和性别构成差异无统计学意义(t=2.13,χ2=0.54,P值均>0.05),具有可比性。本研究已获得首都医科大学附属北京胸科医院科研伦理委员会批准,所有研究对象均签署知情同意书。
2.DNA提取:采集研究对象外周静脉血2 ml,应用全血试剂盒(购自北京百泰克生物技术有限公司)提取基因组DNA。DNA提取质量标准:紫外分光光度计吸光度值A260/280值在1.8~2.0之间。
3.基因分型:采用KASP试剂盒(购自英国LGC有限公司)。使用试剂盒推荐的PCR反应体系,应用ABI7500实时定量PCR进行基因分型。PCR反应条件:95 ℃预热15 min,10个循环的降落PCR(94 ℃ 20 s、65 ℃ 25 s、每个循环降落0.6 ℃)、26个循环的扩增PCR(94 ℃ 20 s、55 ℃ 60 s),若基因分型较分散,则通过增加循环数,优化实验条件进行调整。数据分析读取采用ABI7500系统软件。引物是由美国Invitrogen公司合成,序列见表1。使用ABI7500实时定量PCR仪读取基因分型结果。读取每个样本等位基因所对应的FAM和HEX荧光信号,形成等位基因分型图,从而判定待测样本基因型结果。

表1 趋化因子5启动子区rs2107538基因及趋化因子受体5启动子区rs1799987基因扩增引物序列
4.质量控制:在基因分型时,每96孔板中设置2个不同基因型已知样本作为阳性对照,1~2个阴性对照进行质量控制。阳性对照是由北京擎科新业生物技术有限公司测序,rs2107538测序结果如图1,rs1799987测序结果如图2。
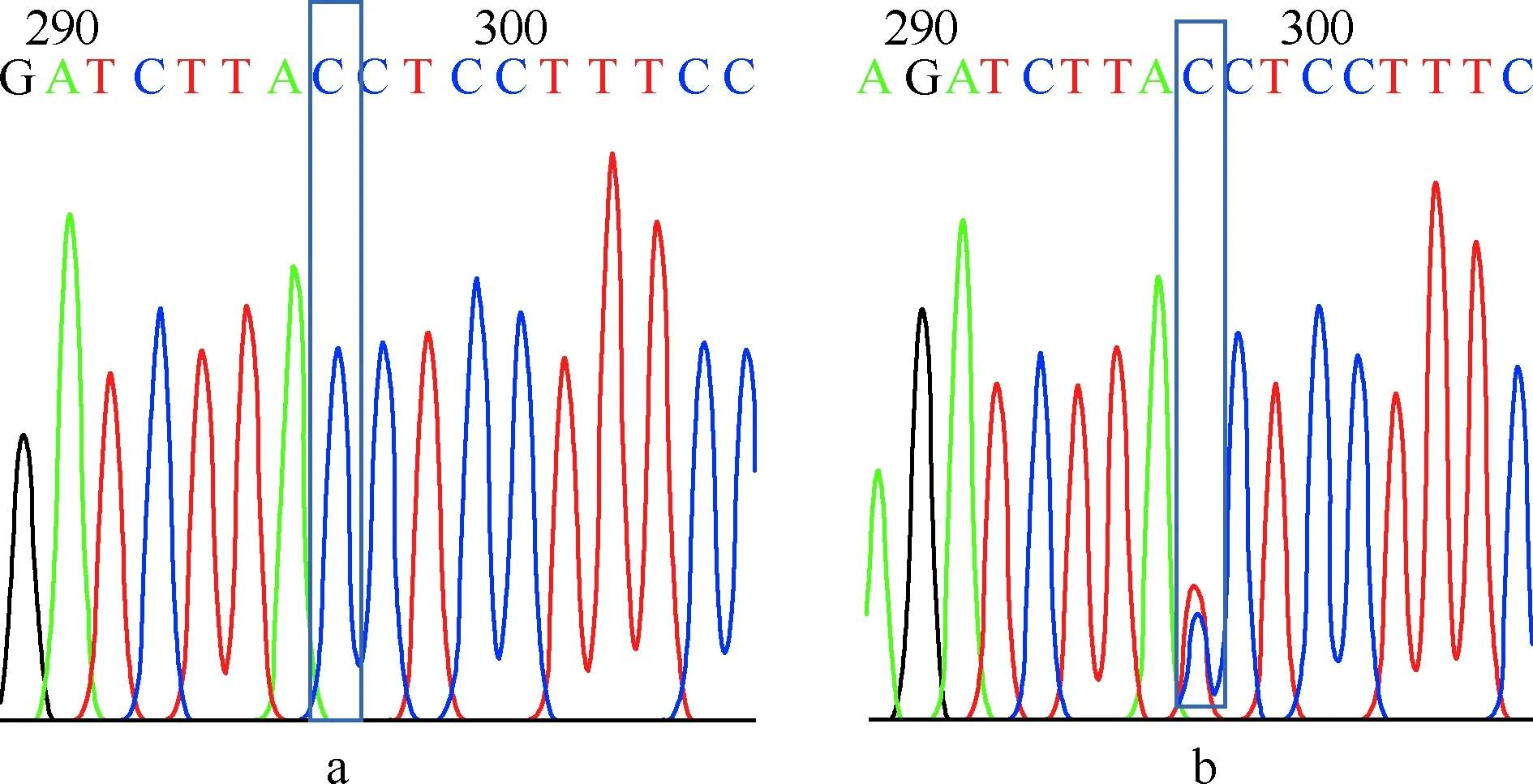
a为基因型CC;b为基因型CT图1 趋化因子5启动子区rs2107538基因扩增片段测序结果
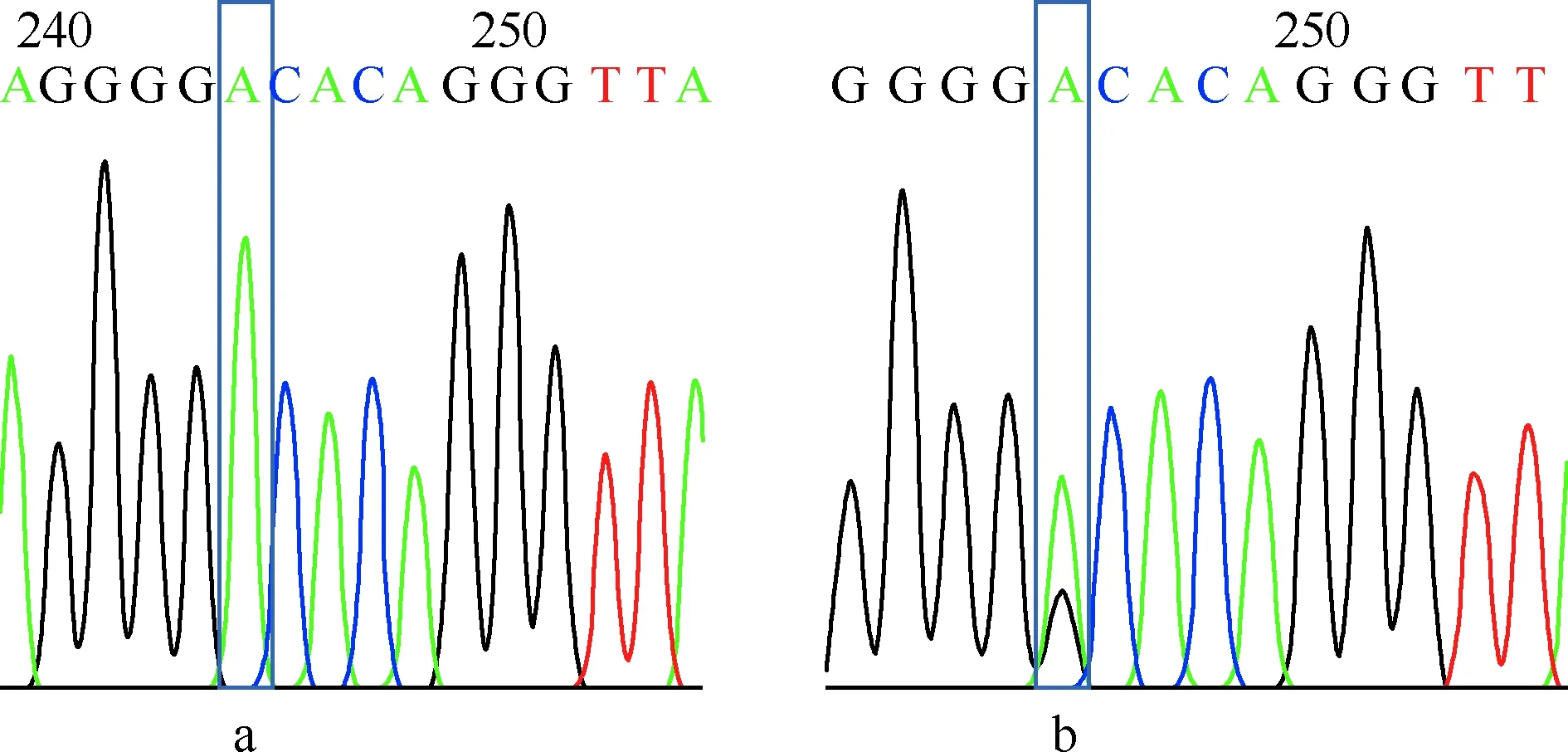
a为基因型AA;b为基因型AG图2 趋化因子受体5启动子区rs1799987基因扩增片段测序结果
5.统计学分析:应用R2.11.1软件进行分析。病例组与对照组研究对象年龄的比较采用两独立样本t检验;性别构成的比较采用χ2检验。分析各位点基因型频率是否符合Hardy-Weinberg(HWE)遗传平衡,计算病例组与对照组各基因型和等位基因的频数及频率,采用χ2检验进行组间差异的比较,并计算OR(95%CI)值。以P<0.05为差异有统计学意义。
结 果
1.Hardy-Weinberg平衡分析:使用R2.11.1软件中HWE计算公式对两个基因单核苷酸多态性(single nucleotide polymorphism, SNP)位点基因型频数进行计算,发现rs2107538和rs1799987基因型频率在对照组分布均符合遗传平衡(P>0.05),提示选取的对照组具有群体代表性。
2.基因多态性分析:结果发现,病例组和对照组CCL5启动子区rs2107538基因型频率与等位基因频率差异均无统计学意义;CCR5启动子区rs1799987等位基因频率和基因型频率差异均具有统计学意义,携带基因型GG和等位基因G可以降低PTB患病风险,而携带等位基因A则会增加PTB患病风险,见表2。

表2 趋化因子5启动子区rs2107538基因和趋化因子受体5启动子区rs1799987基因多态性分析结果
注 表中括号外数值为“频数”,括号内数值为“频率(%)”
讨 论
PTB是严重危害人类健康的全球公共卫生问题,也是我国重点防控的疾病之一。PTB发病是环境因素和宿主遗传因素共同作用的结果。以往研究发现,CCL5及其受体在抗Mtb感染过程中起重要作用:(1)CCL5与特征性肉芽肿形成有关。Chensue等[7]在感染Mtb的小鼠中发现高浓度的CCL5与肉芽肿形成有关,抗CCL5药物应用使肉芽肿成分改变和形成减少,CCL5敲除小鼠无抗原提呈细胞或趋化因子受体阳性T细胞到达肉芽肿组织[8]。(2)在体外实验中发现CCL5可以有效抑制Mtb在巨噬细胞内生长[9]。(3)CCL5趋化T细胞、单核细胞及巨噬细胞转移至炎症部位[9-10]。Mtb感染时,CCL5蛋白优先选择与CCR5受体结合发挥免疫学效应。Mtb感染CCR5敲除小鼠后,其早期抗菌能力较野生型小鼠明显下降[2],形成的肉芽肿中淋巴细胞、髓细胞数目增加,同时IFN-γ、诱导性一氧化氮合酶(NOS2)、重组人白细胞介素-12(IL-12)等细胞因子增加,这些成分可有效控制Mtb感染[11]。Pokkali和Das[3]发现,PTB患者细胞表面的CCR5水平明显高于健康组。CCL5蛋白表达基因位于17q11,长约8 kb,位于启动子区rs2107538的A等位基因与CCL5低表达呈正相关[12]。CCR5蛋白表达基因定为3q21.3,长约1.9 kb,包含4个外显子和2个内含子,启动子中-2459A/G突变调整其转录活性影响蛋白表达[5]。
本研究未发现CCL5启动子区rs2107538基因-403 G/A多态性与PTB易感性的相关,与相关报道一致[13-16]。有学者研究发现,在西班牙北部人群中,等位基因G是结核病保护性因素[17];在印度人群中,基因型AA是罹患结核病的危险因素[17]。不同地区研究结果不一致可能与种族、研究对象数量及纳入排除标准有关。推测本研究未发现相关性的原因可能是:(1)CCL5基因启动子含有多个调控基因,rs2107538可能是与其他调控基因共同调节。例如,在中国香港人群单独研究rs2107538、-28C/G和内含子Inl.1T/C时未发现其与PTB易感性的关系,而对其单倍体研究时发现A-C-T和G-C-C可增加结核病患病风险,且-28C/G和Inl.1T/C的基因型组合GA/TT和GG/TC与结核病易感性明显相关[13]。(2)机体通过复杂的免疫系统调控结核病,CCL5仅是其中一环,还可被其他趋化因子或通路代偿。在CCL5敲除小鼠实验中发现,CCL5表达缺乏未改变肉芽肿的形成,仅在早期影响了肉芽肿发展,中晚期CCL5敲除小鼠肺部形成的肉芽肿反而比野生型小鼠更大更多[8]。
同时,本研究发现CCR5启动子区rs1799987基因-2459 A/G多态性与PTB易感性相关。其中,携带基因型GG和等位基因G可以降低PTB患病风险。Mamtani等[19]在哥伦比亚成年人群中研究也发现,携带rs1799987 G等位基因的HH-单倍体群(包括-2733 A/G, -2554 G/T, -2459 G/A, -2135 T/C, -2132 C/T, -2086 A/G, and -1835 C/T)与PTB易感性相关。CCR5启动子区rs1799987基因在对照组中的突变频率为58%,与南美有色人种(52%)及非洲科萨人(62.5%)相似,远高于秘鲁人(34%)[20],说明此位点存在种族、地域差异,因此该位点基因多态性与PTB易感性在不同地区不同民族可能存在一定差异。
综上所述,本次研究未发现CCL5启动子区rs2107538基因多态性与中国汉族PTB发病相关,其基因多态性可能不是影响PTB发病的重要因素;发现CCR5启动子区rs1799987基因多态性与PTB发病易感性相关,携带基因型GG和等位基因G是PTB患病的保护基因,携带等位基因A是PTB患病的危险因素。CCR5基因多态性在PTB发生的具体调控机制、调控过程中是否与配体或受体相互作用还需进一步探讨。PTB的发病是多因素共同作用的结果,本研究受研究对象数量、地域、种族等多种因素影响,结果有待进一步验证。
[1] Murray CJ, Styblo K, Rouillon A. Tuberculosis in developing countries: burden, intervention and cost. Bull Int Union Tuber Lung Dis, 1990, 65(1):6-24.
[2] Vesosky B, Rottinghaus EK, Stromberg P, et al. CCL5 participates in early protection againstMycobacteriumtuberculosis. J Leukoc Biol, 2010, 87(6):1153-1165.
[3] Pokkali S, Das SD. Augmented chemokine levels and chemokine receptor expression on immune cells during pulmonary tuberculosis. Hum Immunol, 2009, 70 (2): 110-115.
[4] Tian M, Liu F, Wen GY, et al. Effect of variation in RANTES promoter on serum RANTES levels and risk of recurrent wheezing after RSV bronchiolitis in children from Han, Southern China. Eur J Pediatr, 2009, 168(8): 963-967.
[5] McDermott DH, Zimmerman PA, Guignard F, et al. CCR5 promoter polymorphism and HIV-1 disease progression.Multicenter AIDS Cohort Study (MACS). Lancet, 1998, 352(9131):866-870.
[6] 中华人民共和国卫生部.WS288—2008肺结核诊断标准.北京:人民卫生出版社,2008.
[7] Chensue SW, Warmington KS, Allenspach EJ, et al. Differential expression and cross-regulatory function of RANTES during mycobacterial (type 1) and schistosomal (type 2) antigen-elicited granulomatous inflammation. J Immunol, 1999, 163(1): 165-173.
[8] Kaufmann SHE. Protection against tuberculosis: cytokines, T cells, and macrophages. Ann Rheum Dis, 2002, 61(suppl 2):ii54-ii58.
[9] Saukkonen JJ, Bazydlo B, Thomas M, et al. Beta-chemokines are induced byMycobacteriumtuberculosisand inhibit its growth. Infect Immun, 2002, 70(4):1684-1693.
[10] Lima MF, Zhang Y, Villalta F. Beta-chemokines that inhibit HIV-1 infection of human macrophages stimulate uptake and promote destruction of Trypanosoma cruzi by human macrophages. Cell Mol Biol (Noisy-le-grand), 1999, 43(7):1067-1076.
[11] Algood HM, Flynn JL. CCR5-deficient mice controlMycobacteriumtuberculosisinfection despite increased pulmonary lymphocytic infiltration. J Immunol, 2004, 173(5):3287-3296.
[12] Jang Y, Chae JS, Hyun YJ, et al. The RANTES-403G/A promoter polymorphism in Korean men: association with serum RANTES concentration and coronary artery disease. Clin Sci (Lond), 2007, 113(8):349-356.
[13] Chu SF, Tam CM, Wong HS, et a1. Association between RANTES functional polymorphisms and tuberculosis in Hong Kong Chinese. Genes Immun, 2007, 8(6): 475-479.
[14] de Wit E, van der Merwe L, van Helden PD, et al. Gene-gene interaction between tuberculosis candidate genes in a South African population. Mamm Genome, 2011, 22(1-2): 100-110.
[15] Selvaraj P, Alagarasu K, Singh B, et al. CCL5 (RANTES) gene polymorphisms in pulmonary tuberculosis patients of south India. Int J Immunogenet, 2011, 38(5): 397-402.
[16] 韩锐, 綦辉, 孙琳, 等. CCR2、CCL5、CCR5和CCL1基因多态性与中国汉族儿童结核病易感性的关联研究. 标记免疫分析与临床, 2014, 21(2): 171-175.
[17] Sánchez-Castaón M, Baquero IC, Sánchez-Velasco P, et al. Polymorphisms in CCL5 promoter are associated with pulmonary tuberculosis in northern Spain. Int J Tuberc Lung Dis, 2009, 13(4):480-485.
[18] Mishra G, Poojary SS, Raj P, et al. Genetic polymorphisms ofCCL2,CCL5,CCR2 andCCR5 genes in Sahariya tribe of North Central India: an association study with pulmonary tuberculosis. Infect Genet Evol, 2012, 12(5): 1120-1127.
[19] Mamtani M, Mummidi S, Ramsuran V, et a1. Influence of variations inCCL3LlandCCR5 on tuberculosis in a northwestern Colombian population. J Infect Dis, 2011, 203(11): 1590-1594.
[20] Carpenter D, Taype C, Goulding J, et al.CCL3L1 copy number,CCR5 genotype and susceptibility to tuberculosis. BMC Med Genet, 2014, 15:5.
(本文编辑:李敬文)
Relationship between polymorphism of CCL5 gene and CCR5 gene and susceptibility of pulmonary tuberculosis
WAGNHui-lin,WANGWei,LIUJing-ming,LIChuan-you,GAOMeng-qiu.
BeijingChestHospital,CapitalMedicalUniversity;BeijingTuberculosisandThoracicTumorResearchInstitute;BacteriaImmunologyLaboratory,BeijingKeyLaboratoryofDrug-resistantTuberculosisResearch,Beijing101149,China
Correspongdingauthor:GAOMeng-qiu,Email:gaomqwdm@aliyun.com
Objective To study the relationship between CCL5, CCR5 gene polymorphism and susceptibility of pulmonary tuberculosis (PTB). Methods A total of 494 PTB patients from Beijing Chest Hospital, Capital Medical University from February 2014 to April 2015 were selected as case group. Of 413 healthy volunteers were selected as a control group. By collecting venous blood, the single nucleotide polymorphisms (SNPs) ofrs2107538 in CCL5 promoter region andrs1799987 in CCR5 promoter region were detected using competitive allele-specific PCR SNPline program. The genotype and allele frequencies for the SNPs were calculated for case group and control group separately in order to analyze the relationship between CCL5, CCR5 gene polymorphism and susceptibility of PTB. Results For the SNP ofrs2107538 in CCL5, the frequencies for genotype GG, GA, AA and allele G, A were 202 (41%), 224 (45%), 68 (14%), and 628 (64%), 360 (36%) in case group; 152 (38%), 209 (51%), 52 (13%), and 513 (62%), 313 (38%) in control group. There was no statistically significant difference in genotype and allele frequencies between the two groups (χ2=2.50, 0.35, allPvalues >0.05). For the SNP ofrs1799987 in CCR5, the genotype GG, GA, AA and allele G, A frequencies were 99 (20%), 272 (55%), 123 (25%) and 470 (48%), 518 (52%) in case group; 67 (16%), 210 (51%), 136 (33%) and 344 (42%), 482 (58%) in control group. The differences in genotype and allele frequencies between the two groups were statistically significant (χ2=7.62 for genotype frequencies,χ2=6.14 for allele frequencies, allPvalues <0.05). The GG genotype or G allele ofrs1799987 in CCR5 may reduce the risk of PTB (OR(95%CI):0.68 (0.50-0.91), 0.78(0.64-0.94)). Conclusion There was no correlation betweenrs2107538 polymorphism in CCL5 and susceptibility of PTB. The GG genotype or G allele ofrs1799987 in CCR5 promoter region may reduce the risk of PTB.
Chemotactic factors; Polymorphism, single nucleotide; Tuberculosis, pulmonary; Disease susceptibility
10.3969/j.issn.1000-6621.2016.03.008
北京市医院管理局临床医学发展专项(ZYLX201304)
101149 首都医科大学附属北京胸科医院 北京结核病胸部肿瘤研究所 耐药结核病研究北京市重点实验室细菌免疫学研究室(王慧琳、王伟、刘京铭、李传友);首都医科大学附属北京胸科医院结核二科(高孟秋)
高孟秋,Email:gaomqwdm@aliyun.com
2015-11-23)

