非小细胞肺癌患者胸水与外周血检测EGFR基因突变的比较
刘根贤,慕进勇,张守翠
(1.山东省日照市妇幼保健院检验科,山东日照 276826;2.山东省荣成市石岛人民医院检验科,
山东荣成 264309;3.山东省日照市中医院骨科,山东日照 276800)
·临床研究·
非小细胞肺癌患者胸水与外周血检测EGFR基因突变的比较
刘根贤1,慕进勇2,张守翠3
(1.山东省日照市妇幼保健院检验科,山东日照 276826;2.山东省荣成市石岛人民医院检验科,
山东荣成 264309;3.山东省日照市中医院骨科,山东日照 276800)
目的 比较外周血和胸水两种样本检测EGFR基因突变的情况,为临床选取合适的送检标本提供参考。方法 选取非小细胞肺癌(NSCLC)合并恶性胸腔积液病例65例,收集血液和胸水标本,分别抽取DNA,使用巢式PCR扩增检测。采用SPSS19.0软件进行数据处理。结果 65例NSCLC患者中有吸烟史的患者占44.6%。病理类型为腺癌的有53例,占81.5%;非腺癌12例,占18.5%。NSCLC分期为Ⅲb者有34例,占52.3%;Ⅳ31例,占47.7%。胸水总检出率(36.9%)高于血清总检出率(18.5%),两种样本中19号外显子突变检出率均高于21号外显子的。19号外显子的突变类型为删除突变,即DelE746-A750、DelE746-T751,胸水中多出一种DelL747-P753 insS。21号外显子的突变类型为点突变,即L858R和L861Q。结论 虽然外周血中的EGFR基因突变的检出率低于胸水中的,但是19和21外显子的突变情况在外周血和胸水标本中基本一致,循环DNA可以反映组织中DNA的变化。
非小细胞肺癌; 胸水; 外周血; EGFR基因突变
非小细胞肺癌(NSCLC)约占肺癌的80%,恶性程度高,发现时多数已经处于晚期。传统的治疗办法,如化疗、放疗和手术的疗效不尽如人意。随着对肺癌生物标志物的深入研究和致病机理的逐步阐明,分子靶向治疗已经成为肺癌综合治疗中的最新模式,受到广泛关注。目前NSCLC治疗的重要方向之一即以肿瘤细胞分化增殖相关的酶为靶点,其中以表皮生长因子受体(EGFR)为靶点的分子靶向治疗取得了较广泛的临床应用。EGFR基因突变主要发生在18~21外显子,其中19和21外显子突变占据约90%。大量临床研究显示检测EGFR基因突变可以筛查对靶向药敏感的患者,从而实现靶向个体化治疗[1-3]。但是EGFR基因突变样本往往由组织取样获得,创伤大,操作繁琐。近年来,NSCLC患者的外周血循环DNA分析可一定程度反映肿瘤情况,其检测得到了广泛关注[4]。胸水中可直接收集肿瘤脱落细胞,也是EGFR基因突变检测的常见样本来源[5]。本文比较了外周血和胸水两种样本检测EGFR基因突变的情况,为临床选取合适的送检标本提供参考。
1 资料与方法
1.1 一般资料 选取NSCLC合并恶性胸腔积液病例65例,其中男35例,女30例,年龄37~79岁,平均年龄62岁。所有血液样本均使用EDTA-K2真空采血管收集。采血后及时离心(3 500 r/min,10 min)分离血浆,取上清,获得无血细胞成分的血浆,用1.5 mL离心管分装。每例抽取胸水250~500 mL。
1.2 DNA抽提及巢式PCR扩增检测
1.2.1 外周血样本使用QIAamp DNA Blood Mini Kit (Qiagen)试剂盒抽提。胸水脱落细胞经石蜡包埋后,使用QIAamp DNA FFPE Tissue Kit (Qiagen)试剂盒抽提。抽提步骤按照试剂盒说明书进行。
1.2.2 巢式PCR扩增目的片段为EGFR基因19和21号外显子。引物参照文献设计[6],引物合成及测序由上海生工生物工程公司完成。反应条件为:94 ℃,5 min;94 ℃,40 s、58 ℃,45 s、72 ℃,1 min;35个循环;72 ℃延伸7 min。琼脂糖凝胶纯化回收试剂盒DR01(北京艾德莱生物科技有限公司)。
1.3 统计学处理 采用SPSS19.0软件进行数据处理,计量资料采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 入选患者临床资料 选取NSCLC合并恶性胸腔积液病例65例,男35例(阳性率71.4%),女30例(阳性率28.6%);年龄37~79岁,平均年龄62岁。有吸烟史的患者占44.6%。病理类型为腺癌的有53例,占81.5%;非腺癌12例,占18.5%。NSCLC分期为Ⅲb期有34例,占52.3%;Ⅳ期31例,占47.7%。
2.2 19和21外显子突变检出情况 65例NSCLC患者同时检测血清样本和胸水样本中的EGFR基因突变情况,胸水总检出率(36.9%)高于血清总检出率(18.5%),两者相比差异有统计学意义(P<0.05)。两种样本中19号外显子突变检出率均高于21号外显子的。19号外显子的突变类型为删除突变,即DelE746-A750、DelE746-T751,胸水中多出一种,即DelL747-P753 insS。19号外显子的突变类型为点突变,L858R、L861Q。

表1 目的基因及引物序列
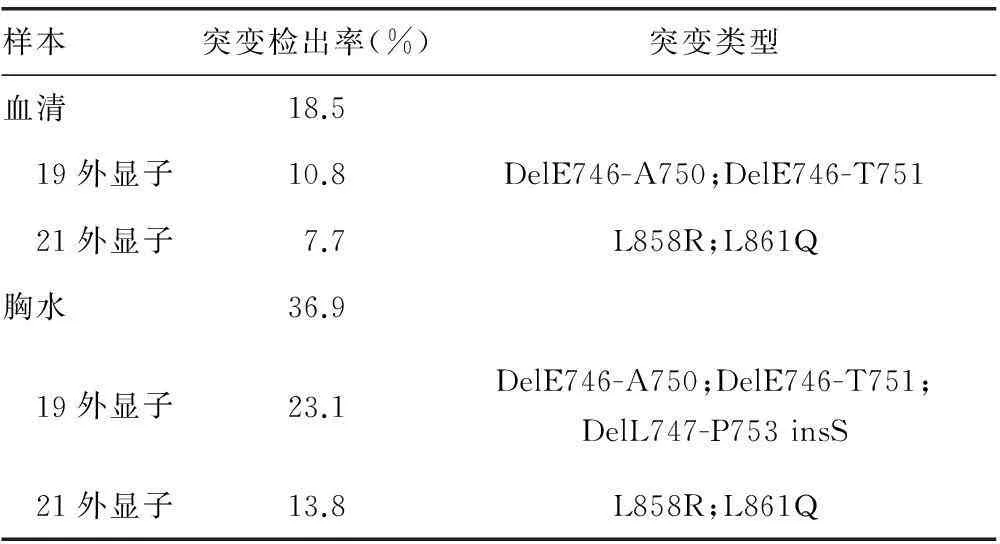
表2 血清和胸水标本EGFR突变检出情况比较
3 讨 论
EGFR属于受体酪氨酸激酶,存在于大部分正常上皮和部分间叶细胞,多种肿瘤组织中有过度表达,是肿瘤细胞增殖、浸润转移、血管生成等生物行为的重要调节因素。EGFR在正常肺组织中不表达或低表达,而在非小细胞肺癌中高表达,主要原因为过表达和基因扩增等,其表达与高分期、生存期缩短、淋巴结转移等相关。病理状态下,EGFR通路异常激活,EGFR酪氨酸激酶活性增强,下游信号通路随之激活,细胞生长无法抑制,造成肿瘤细胞增殖、侵袭、转移等生物学特性得以强化。由于EGFR酪氨酸激酶是信号传递的必要条件之一,因而成为NSCLC治疗的重要靶分子,阻断EGFR信号传递通路可以抑制肿瘤生长,使细胞停留在G1期,诱导肿瘤细胞凋亡。EGFR基因突变导致细胞内酪氨酸激酶区改变,使得治疗用药(小分子酪氨酸激酶抑制剂)更容易结合,从而增加药物的敏感性[7]。大量研究表明,酪氨酸激酶编码区的基因突变主要是19外显子的缺失和21外显子的L858R点突变[8-10]。因此,检测EGFR基因的19和21外显子的突变情况可以从NSCLC患者中筛选出合适的治疗对象进行有针对性的治疗,有助于提高药物疗效。
本研究发现,外周血中19号外显子的删除突变是由于第2 236~2 250核苷酸缺失或者第2 236~2 253核苷酸缺失,分别导致746位谷氨酸至750位丙氨酸缺失(DelE746-A750)或者746位谷氨酸至751位苏氨酸缺失(DelE746-T751)。胸水中19号外显子还发现另外一种,即第2 240~2 257核苷酸缺失,导致747位亮氨酸至753位苯丙氨酸缺失,并插入丝氨酸(DelL747-P753 insS)。外周血和胸水中的21号外显子突变情况相同,即第858位密码子出现T/G转换,导致编码产物由亮氨酸变为精氨酸(L858R)和第861位密码子出现T/A转换,导致编码产物由亮氨酸变为谷氨酰胺(L861Q)。
循环DNA来源于细胞凋亡(正常人群,长度185~200 bp)和细胞坏死(肿瘤患者,以长链DNA片段为主)。肺癌在演化的不同阶段会伴随特定基因的改变,这些改变了的DNA片段会进入循环中。因此循环DNA检测对于肿瘤的早期诊断和预防有重要意义。大量研究表明,循环DNA与肿瘤组织DNA的基因变化一致性较好,因此,国内外学者尝试对NSCLC外周血循环DNA分析发现肿瘤特异性标志物。为了寻找易获得的标本进行EGFR基因突变检测,近年来国内外研究者将注意力集中在了胸水和外周血上。恶性胸腔积液是晚期NSCLC患者的常见并发症,采用胸水标本有操作风险小、检出率高、与组织标本高度一致等优点。但是对于NSCLC早期EGFR基因突变检测,仍有待于进一步研究。外周血循环DNA是存在于血浆等体液中的游离DNA,NSCLC患者的肿瘤组织可通过细胞坏死、凋亡等方式释放出,其含量与肿瘤的进展、治疗及预后相关[2-3,11]。本研究对65例NSCLC患者的EGFR基因突变情况作一比较,发现外周血中的EGFR基因突变的检出率低于胸水中的,差异有统计学意义。但是19和21外显子的突变情况在外周血和胸水标本中基本一致,循环DNA可以反映组织中DNA的变化。随着外周血循环DNA检测技术的不断进步,检出率的不断提升,将更加便于临床的开展和实施,这将对肺癌患者的诊断、筛查、治疗和随访有重要的意义,为临床检测提供方便有效的诊断方法,便于临床的开展和实施,具有广阔的应用前景。
[1]高云,陈嘉昌,朱振宇,等.基因突变及其检测方法的研究进展[J].分子诊断与治疗杂志,2011,3(1):51-56.
[2]姜北,李晶,巩平.非小细胞肺癌患者血清EGFR基因突变循环DNA检测[J].中华肿瘤防治杂志,2014,21(1):29-33.
[3]周小昀,李龙芸,崔巍,等.检测肺癌患者血清游离DNA的EGFR基因点突变与EGFR-TKI疗效的相关性分析[J].癌症进展,2011,9(1):13-18.
[4]王开云,熊敏,徐城林,等.非小细胞肺癌患者血清EGFR基因突变循环DNA检测的临床研究[J].现代肿瘤医学,2015,23(3):332-334.
[5]Yeo CD,Kim JW,Kim KH,et al.Detection and comparison of EGFR mutations in matched tumor tissues,cell blocks,pleural effusions,and sera from patients with NSCLC with malignant pleural effusion,by PNA clamping and direct sequencing[J].Lung Cancer,2013,81(2):207-212.
[6]Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl J Med,2004,350(21):2129-2139.
[7]Li N,Li H,Su F,et al.Relationship between epidermal growth factor receptor (EGFR) mutation and serum cyclooxygenase-2 Level,and the synergistic effect of celecoxib and gefitinib on EGFR expression in non-small cell lung cancer cells[J].Int J Clin Exp Pathol,2015,8(80):9010-9020.
[8]Ono M,Kuwano M.Molecular mechanisms of epidermal growth factor receptor (EGFR) activation and response to gefitinib and other EGFR-targeting drugs[J].Clin Cancer Res,2006,12(24):7242-7251.
[9]Bar J,Onn A.Overcoming molecular mechanisms of resistance to first-generation epidermal growth factor receptor tyrosine kinase inhibitors[J].Clin Lung Cancer,2012,13(4):267-279.
[10]Pallis A,Briasoulis E,Linardou H,et al.Mechanisms of resistance to epidermal growth factor receptor tyrosine kinase inhibitors in patients with advanced non-small-cell lung cancer:clinical and molecular considerations[J].Curr Med Chem,2011,18(11):1613-1628.
[11]Heitzer E.Ulz P,Geigl JB.Circulating tumor DNA as a liquid biopsy for cancer[J].Clin Chem,2015,61(1):112-123.
10.3969/j.issn.1673-4130.2016.07.051 文献标识码:A 文章编号:1673-4130(2016)07-0985-03
2015-10-24)

