ICAT干扰慢病毒表达载体构建及稳转HL60细胞株的建立*
王晋蜀,王伟佳,王 婷,张 彦△
(1.重庆医科大学检验医学院/临床检验诊断学教育部重点实验室,重庆 400016;
2.中山市人民医院检验医学中心,广东中山 528403)
·论 著·
ICAT干扰慢病毒表达载体构建及稳转HL60细胞株的建立*
王晋蜀1,王伟佳2,王 婷1,张 彦1△
(1.重庆医科大学检验医学院/临床检验诊断学教育部重点实验室,重庆 400016;
2.中山市人民医院检验医学中心,广东中山 528403)
目的 构建ICAT基因的干扰慢病毒表达载体,建立稳定转染的HL60细胞系。方法 人工设计、合成针对ICAT基因干扰序列,退火后连接到PGLV3干扰载体上,与PG-p1-VSVG、PG-p1-REV、PG-p1-RRE共转染293T细胞,包装产生慢病毒颗粒并测定病毒滴度,感染HL60细胞,建立稳定细胞株;应用RT-PCR和Western Blot技术检测HL60稳定细胞中ICAT基因和蛋白表达情况,并与对照组进行比较。结果 成功构建了针对ICAT基因的RNAi慢病毒表达载体,病毒滴度为2×108TU/mL;建立稳定转染的HL60细胞株。有效干扰验证显示,shICAT能明显降低ICAT的mRNA及蛋白水平 (P<0.001)。结论 成功构建ICAT基因的shRNA慢病毒表达载体,建立稳定干扰ICAT表达的HL60细胞株。
ICAT基因; RNA干扰; HL60细胞
Wnt信号传导途径的调控失常是导致多种类型细胞发生癌变的主要原因之一,该途径成员之一beta-连环蛋白和T细胞因子4激活可发生癌变,而另一成员beta-连环蛋白和T细胞因子4抑制子(inhibitor of beta-catenin and TCF-4,ICAT)通过抑制beta-连环蛋白和T细胞因子4复合物的形成而对Wnt 信号传导途径进行负调控来发挥抑癌作用。
本研究构建针对ICAT基因的shRNA慢病毒干扰表达载体,感染HL60细胞,建立稳定干扰ICAT的细胞株,为进一步ICAT在白血病中的功能研究奠定基础。
1 材料与方法
1.1 细胞与试剂 人早幼粒细胞白血病细胞系HL60细胞购自中国科学院上海生命科学研究所细胞库;293T细胞为本实验室冻存;细胞培养采用IMDM、DMEM(Hyclone USA)和胎牛血清(Gibco USA);慢病毒载体系统:PGLV3、PG-p1-VSVG、PG-p1-REV、PG-p1-RRE为重庆威斯腾生物构建制备;DNA内切酶(BamHI、EcoRI)、DNA连接酶、DNA marker购至MBI Fermentas;RT-PCR试剂盒购至大连宝生物有限公司(Takara,Japan);兔抗人的ICAT抗体购自Abcam公司;cyclinD1、c-myc、TCF1抗体购于Santa Cruz公司;辣根过氧化物酶标记的山羊抗兔二抗、山羊抗鼠二抗、鼠抗人β-actin单抗购自北京中杉金桥生物技术有限公司。
1.2 ICAT siRNA靶序列的设计 针对 NCBI 上已经提交的ICAT基因序列并进行分析,遵循siRNA的设计原则,寻找合适的干扰靶点,将DNA oligo分别用TE(pH8.0)溶解,浓度为100 μmol/L。取相应的正义链和反义链oligo溶液。在PCR仪上按照如下程序进行退火处理:95 ℃ 5 min;85 ℃ 5 min;75 ℃ 5 min;70 ℃ 5 min;4 ℃保存。退火处理后得到浓度为10 μM的shRNA模板。将所得模板溶液稀释50倍,终浓度为200 nM,用于连接反应。
1.3 ICAT shRNA 和对照shNC 序列 ICAT shRNA 序列为5′-GCA GGT GTT CTG CTG ATA TCA-3′,正义链:5′-GAT CCG CAG GTG TTC TGC TGA TAT CAT TCA AGA GTG ATA TCA GCA GAA CAC CTG CTT TTT TG- 3′,反义链5′-AAT TCA AAA AAG CAG GTG TTC TGC TGA TAT CAT CTC TTG AAT GAT ATC AGC AGA ACA CCT GCG-3′,对照shNC:靶序列为:5′-TTC TCC GAA CGT GCA CGT- 3′,正义链:5′-GAT CCG TTC TCC GAA CGT GTC ACG TTT CAA GAG AAC GTG ACA CGT TCG GAG AAC TTT TTT G- 3′,反义链5′-AAT TCA AAA AAG TTC TCC GAA CGT GCA CGT TCT CTT GAA ACG TGA CAC GTT CGG AGA ACG-3′。
1.4 载体构建 慢病毒载体PGLV3经EcoRi和BamHi对目的基因片段进行酶切及片段回收,用T4DNA ligase连接双酶切得到的基因片段和线性化载体,22 ℃连接2 h,22 ℃ 1 h转化感受态细胞。将抽提好的质粒进行单酶切电泳鉴定,对阳性克隆进行测序做最后确认。
1.5 病毒包装及细胞感染 慢病毒包装细胞用蛋白酶消化对数生长期的293T细胞,重新接种于10 cm细胞培养皿,并在10 cm培养皿中培养至80%~90%融合时胰酶消化,加入2 mL含10%FBS的DMEM培养液,吹打使细胞形成单细胞悬液培养过夜。在一支无菌的5 mL离心管中加入1.5 mL无血清DMEM,按此比例加入含目的序列的穿梭质粒和包装质粒(PG-p1-VSVG、PG-p1-REV、PG-p1-RRE),混匀,取另一只无菌的15 mL离心管,加入1.5 mL无血清DMEM,再加入300 μL RNAi-Mate,混匀,室温放置5 min后将2管混合,室温放置25 min后除去培养液,再加入8 mL无血清的DMEM 培养液。将转染混合物逐滴加入15 cm 培养皿中,并在培养箱中温育4~6 h后吸弃转染液,加入10 mL含10% FBS 的DMEM 培养液,再继续培养72 h。将培养皿中细胞上清液吸到15 mL离心管中,低速离心后,将离心管上清液用0.45 μm过滤器过滤。随后采用10%FBS的DMEM培养液系列稀释慢病毒原液,感染293T细胞测定病毒滴度。
1.6 感染HL60细胞并筛选稳转细胞株 接种状态良好的HL60细胞到6孔板,每孔(2~4)×105个细胞,每孔加入polybrene多聚赖氨酸使终浓度为6 μg/mL,30 min后加入(4~6)×106/单位病毒;12 h后换液,培养96 h后在荧光观察,然后收集细胞悬液,调整细胞密度至(5~8)×106个/mL过滤细胞:将染色后的细胞悬液于300目无菌的滤网过滤,收集滤液,移入流式管,避光放置冰上送检。
1.7 ICAT干扰效果的RT-PCR和Western Blot的鉴定 RT-PCR:收集shNC对照组和shICAT组细胞,按照Invitrogen公司TRIzol产品说明书提取细胞总RNA。琼脂糖凝胶电泳确定RNA完整性,紫外分光光度计检测RNA的浓度和纯度(OD260/OD280:1.8~2.0);ICAT引物序列 5′-ATG AAC CGC GAG GGA GCA CC-3′,5′-CTA CTG CCT CCG GTC TTC CG-3′,250 bp;β-actin引物序列5′-CAC CAC ACC TTC TAC AAT GAG C-3′,5′-GTG ATC TCC TTC TGC ATC CTG T-3′,700 bp;逆转录后经过95 ℃ 5 min 预变性,循环内95 ℃ 30 s 变性,56 ℃退火30 s,32个循环扩增。产物经琼脂糖凝胶电泳,在BIO-RAD凝胶成像仪上观察并采用Quantity One 4.6.2 软件对 PCR 电泳结果进行灰度值分析,分析基因表达水平。Western Blot:同样的收集shNC对照组和shICAT组细胞用细胞裂解液进行裂解,提取总蛋白,用Bradford法进行蛋白定量。取100 μg蛋白进行15%SDS-PAGE凝胶电泳,蛋白分离后,湿转至聚偏二氟乙烯膜,用含 5% 小牛血清的封闭液封闭 2 h,加入一抗ICAT,稀释比例为1∶5 000;4 ℃过夜;洗膜,加入二抗,稀释比例为1∶5 000,37 ℃ 反应 1 h;洗膜,按照电化学发光试剂盒说明进行显影。采用Quantity One 4.6.2 软件对各组电泳条带进行灰度值分析。以目的蛋白与内参条带灰度值的比值反映各关键分子的蛋白相对表达水平。
1.8 统计学处理 结果通过统计软件SPSS11.5分析。均值间比较使用t检验分析,P<0.05为差异具有统计学意义。结果中的PCR和蛋白印迹灰度比为目的基因灰度值与各自内参灰度值之比。
2 结 果
2.1 ICAT shRNA 重组载体的酶切 LV3载体经BamHI、EcoRi酶酶切后电泳图(图1A),用BamHI和EcoRI对目的基因片段进行酶切,酶切完成后,进行目的片段回收;将酶切后的目的基因片段与线性化的载体进行连接后,PCR初步鉴定(图1B);将重组质粒进行单酶切鉴定,在目的条带大小对应区域有酶切得到的条带对应的克隆即为阳性克隆(图1C)。
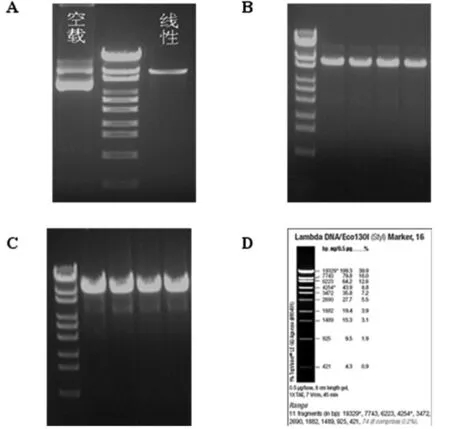
A:L3载体酶切;B:重组载体质粒图;C:重组载体的酶切鉴定图;D:Maker Lambda DNA/Eco130I。
图1 限制酶切分析结果
2.2 ICAT shRNA 重组载体的测序 通过上述的酶切结果表明,被EcoRI切开的可能是阳性克隆,将克隆进行测序鉴定,测序结果见图2,结果显示,序列正确。

A:shICAT重组载体的测序结果;B:shNC重组载体的测序结果。
图2 重组载体的测序
2.3 慢病毒包装和感染HL60细胞 制备编码慢病毒颗粒的重组病毒质粒及其3种辅助包装原件载体质粒,3种质粒载体分别进行高纯度无内毒素抽提,用转染试剂RNAi-Mate 进行共转染293T 细胞包装慢病毒,包装成功后感染HL60细胞,见图3。
2.4 ICAT shRNA稳定HL60细胞株干扰效果鉴定 Real-time PCR 检测结果显示,干扰组ICAT mRNA 的表达量(0.36±0.02)较对照组(1.57±0.11)明显下调(P<0.001,图4A、B)。Western Blot 结果显示,干扰组ICAT的蛋白表达(0.56±0.06)较对照组(1.44±0.045)明显下调(P<0.001,图4C、D),这说明所构建的慢病毒介导的ICAT shRNA能明显抑制ICAT基因水平和蛋白水平的表达。

A、B:白光下观察shNC组和shICAT组HL60细胞;C、D:荧光显微镜下的shNC组和shICAT组HL60细胞(20×)。
图3 转染细胞的荧光图片
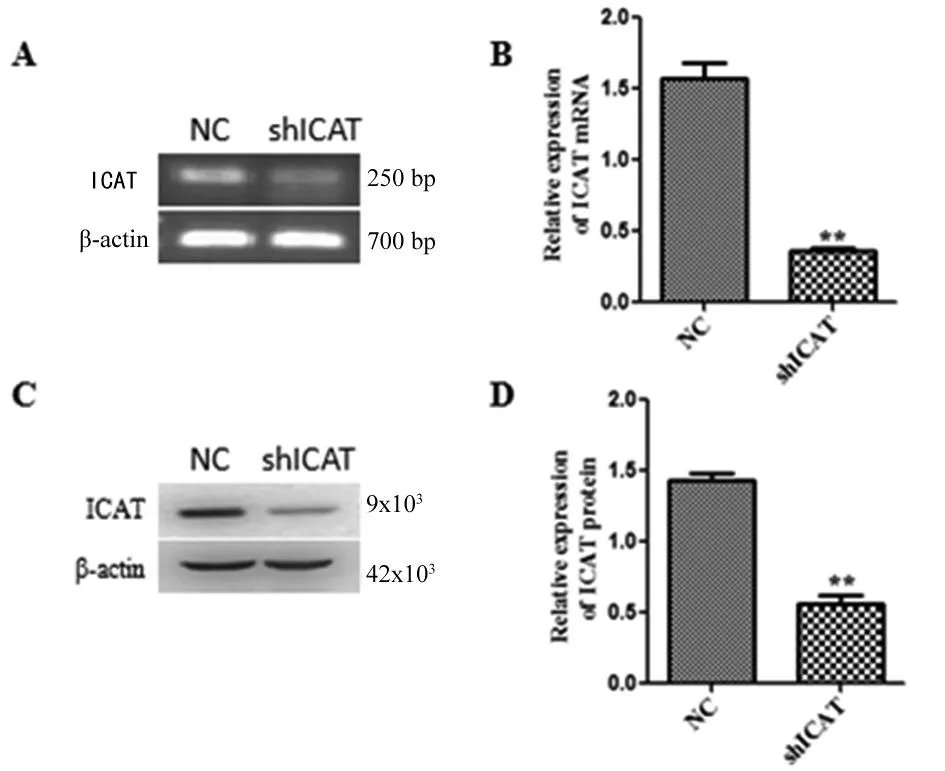
A、B:RT-PCR检测稳转 HL60细胞中ICAT基因的表达;C、D:Western Blot 检测稳转HL60细胞中ICAT蛋白的表达(**P<0.001)。
图4 稳定细胞株干扰效果验证
3 讨 论
ICAT是Tago 等[1]用酵母双杂交系统筛选鼠胚胎cDNA文库时发现的一个蛋白质基因,基因定位于染色体1P36.1-1P36.2D1S214H~D1S244之间。在鼠胚胎发育过程中,ICAT的mRNA表达相当恒定。ICAT是目前发现为数不多的能够直接负向调节beta-连环蛋白的基因。其cDNA序列分析显示,它编码一个含81个氨基酸残基,相对分子质量为9×103的蛋白质[1]。
ICAT的尾巴能与beta-连环蛋白结合并排斥后者与T细胞因子4结合,ICAT阻止beta-连环蛋白/T细胞因子4复合物形成的能力可能是它在细胞质中的主要的功能,而它的三螺旋束为结合beta-连环蛋白的结构域[2-4]。
ICAT作为beta-连环蛋白/T细胞因子4抑制子,在肿瘤当中的作用也有大量的报道,它可以通过抑制经典Wnt信号通路达到抑制肿瘤细胞的增殖[1];目前有报道ICAT高表达会促进黑色素瘤的转移和侵袭[5],但也有报道表明通过高表达ICAT能抑制Wnt/β-catenin信号通路活性从而抑制子宫肌瘤细胞的增殖[6]、抑制胶质母细胞瘤细胞的增殖与迁移等[7],ICAT与胰腺癌的发展也有密切联系[8]。通过这些文献报道可知ICAT在肿瘤细胞的发生发展中具有重要的作用。
RNA干扰(RNA interference,RNAi)是正常生物体内抑制特定基因表达的一种现象,是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象。这种现象发生在转录后水平,又称为转录后基因沉默(post-transcriptional gene silencing,PTGS)。双链RNA经酶切后会形成很多小片段,称为siRNA,这些小片段一旦与信使RNA(mRNA)中的同源序列互补结合,会导mRNA失去功能,即不能翻译产生蛋白质,也就是使基因“沉默”[9-10]。
本研究成功构建了ICAT shRNA表达载体,通过构建慢病毒干扰体,感染HL60细胞,建立了稳定细胞株。应用real-time PCR、Western Blot检测发现ICAT mRNA与蛋白水平表达均受抑制。为进一步研究ICAT基因对HL60 细胞功能的影响奠定基础。
[1]Tago K,Nakamura T,Nishita M,et al.Inhibition of Wnt signaling by ICAT,a novel beta-catenin-interacting protein[J].Genes Dev,2000,14(14):1741-1749.
[2]Graham TA,Clements WK,Kimelman D,et al.The crystal structure of the beta-catenin/ICAT complex reveals the inhibitory mechanism of ICAT[J].Mol Cell,2002,10(5):563-571.
[3]Daniels DL,Weis WI.ICAT inhibits beta-catenin binding to Tcf/Lef-family transcription factors and the general coactivator p300 using independent structural modules[J].Mol Cell,2002,10(5):573-584.
[4]Choi HJ,Huber AH,Weis WI.Thermodynamics of beta-catenin-ligand interactions:the roles of the N-and C-terminal tails in modulating binding affinity[J].J Biol Chem,2006,281(9):1027-1038.
[5]Domingues MJ,Rambow F,Job B,et al.Beta-catenin inhibitor ICAT modulates the invasive motility of melanoma cells[J].Cancer Res,2014,74(7):1983-1995.
[6]Ono M,Yin P,Navarro A,et al.Inhibition of canonical WNT signaling attenuates human leiomyoma cell growth[J].Fertil Steril,2014,101(5):1441-1449.
[7]Zhang K,Zhu S,Liu Y,et al.ICAT inhibits glioblastoma cell proliferation by suppressing Wnt/beta-catenin activity[J].Cancer Lett,2015,357(1):404-411.
[8]Campos ML,Sánchez-Arévalo Lobo VJ,Rodolosse A,et al.ICAT is a novel Ptf1a interactor that regulates pancreatic acinar differentiation and displays altered expression in tumours[J].Biochem J,2013,451(3):395-405.
[9]de la Fuente J,Kocan KM.RNA interference for the study and genetic manipulation of ticks[J].Trends Parasitol,2007,23(9):427-433.
[10]Yang M,Mattes J.Discovery,biology and therapeutic potential of RNA interference,microRNA and antagomirs[J].Pharmacol Ther,2008,117(1):94-104.
Construction of ICAT interference lentivirus expression vector and establishment of stable HL60 cell lin*
WangJinshu1,WangWeijia2,WangTing1,ZhangYan1△
(1.KeyLaboratoryofLaboratoryMedicalDiagnosticsofMinistryofEducation,SchoolofLaboratoryMedicine,ChongqingMedicalUniversity,Chongqing400016,China;2.LaboratoryMedicalCenterr,ZhongshanMunicipalPeople′sHospital,Zhongshan,Guangdong528403,China)
Objective To construct the ICAT gene interference lentivirus expression vector targeting and to establish stable transfected cell line HL60.Methods The interference sequence targeted at human ICAT gene was designed and synthesized,after annealing,which was connected to PGLV3 interference vector and with PG-p1-VSVG,PG-p1-REV,PG-p1-RRE were co-transfected into 293T cells The lentivirus particles were packaged and generated.The virus titer was detected.HL60 cells were transfected for establishing the stable cell line; RT-PCR and Western Blot techniques were used to detect ICAT gene and protein expression in stable HL60 cells,then the results were compared with those in the control group.Results The lentivirus expression vector targeted at ICAT was successfully constructed and the virus titer was 2×108U/mL.Stable transfected HL60 cell line was established.The effective interference verification revealed that shICAT could significantly reduce the mRNA and protein level of ICAT (P<0.001).Conclusion The shRNA lentiviral expression vector of ICAT gene is successfully constructed and the HL60 cell line stably interfering ICAT expression is established.
ICAT gene; RNA interference; HL60 cell
国家自然科学基金资助项目(81301492)。
2.中山市人民医院检验医学中心,广东中山 528403)
王晋蜀,女,初级(师),主要从事白血病药物机制研究。
2.中山市人民医院检验医学中心,广东中山 528403)
△
,E-mail:zy2753@hotmail.com。
10.3969/j.issn.1673-4130.2016.07.004 文献标识码:A 文章编号:1673-4130(2016)07-0875-03
2015-11-15)

