瓦屋山常绿阔叶次生林建群种扁刺栲的细根分布及其碳氮特征
彭 勇,陈冠陶,梁 政,李 顺,彭天驰,涂利华
(四川农业大学林学院,成都611130 )
瓦屋山常绿阔叶次生林建群种扁刺栲的细根分布及其碳氮特征
彭 勇,陈冠陶,梁 政,李 顺,彭天驰,涂利华*1
(四川农业大学林学院,成都611130 )
四川瓦屋山国家森林公园是我国西部的中亚热带湿性常绿阔叶林的典型代表,具有四川现存的较为完好的扁刺栲(Castanopsis platyacantha)-华木荷(Schima sinensis)群系,该研究利用土钻法探讨了该群系内主要建群种扁刺栲标准木的细根分布及其碳氮特征。结果表明:(1)扁刺栲细根总生物量为173.62 g·m−2,其中活根生物量为135.29 g·m−2。(2)随着土层深度的增加,扁刺栲细根生物量、根长密度、根系表面积和比根长呈下降趋势,0~30 cm土层所占比例分别为67.23%、69.53%、69.48%和57.20%;根长密度、根系表面积和比根长均随细根直径的增加而显著下降,直径小于1 mm的根系所占比例分别为58.84%、52.59%和51.36%。(3)扁刺栲细根生物量、根长和表面积消弱系数β均随根系直径的增加而增加。(4)根系C含量在第Ⅰ土层中随细根直径的增加而显著增加,在其他土层则无显著差异;直径小于2 mm的根系C含量在第Ⅰ土层中显著低于其他土层,大于2 mm的根系C含量在各土层间的差异不大。(5)根系N含量随根系直径和土层深度的增加而减少,C/N值则与之相反。该研究结果在一定程度上反映了该次生林地下细根的垂直分布及养分特征,为揭示该生态系统地下生态过程及今后在该生态系统研究环境变化对地下生态过程的影响提供了基础数据。
常绿阔叶林,扁刺栲,细根,碳含量,氮含量
根系是陆地生态系统的重要组成部分,不仅是植被地上部分的支撑者和植被从土壤中吸收水分和养分的主要器官(Hajek et al,2014;Ma et al,2014),而且能通过生成各种生物化合物来调节植物生长,同时在陆地生态系统碳分配与碳循环过程中具有核心地位(彭少麟等,2005)。根系形态和分布状况决定植被从土壤吸收水分和养分的能力,也反映林木对立地条件的利用状况(Liu et al,2011)。根系的发育主要受植物种类特征和环境因素如土壤水分和生物化学特性的影响(Lehmann,2003;Schenk,2008)。一般来说,根系更倾向于集中分布在表土层,并随土层深度的增加呈指数递减(Schenk,2008)。如Fortier et al(2013)对加拿大Québec南部不同树种和年龄的天然林的研究表明,0~20 cm土层根系占总根系生物量60%以上,其中铁杉(Tsuga chinensis)林达99%。在根系描述方面,Gale & Grigal(1987)提出的单一参数模型(Single Parameter Model)是目前国内外公认的描述根系垂直分布较理想的模型,并受到广泛应用(Gwenzi et al,2011;李鹏等,2005;云雷等,2010)。
近年来,我国中亚热带地区由于社会经济不断发展、人类需求不断扩大,加上土地利用变化等人为活动的干扰,该地区典型的地带性植被——常绿阔叶林受到严重破坏,取而代之的是大面积的次生林(王希华等,2005;李强等,2007;Xiang et al,2013)。不断增加的次生林已成为中国森林资源的主体(朱教君,2002)。这对水源涵养、水土保持、生物多样性保护和固碳等具有重要意义(Xiang et al,2013;Liu et al, 2008;王芸等,2012)。四川洪雅县南部的瓦屋山国家森林公园位于华西雨屏区中心地带(潘开文等,2000),是我国西部的中亚热带湿性常绿阔叶林的典型代表(包维楷等,2002),具有四川现存的较为完好的扁刺栲(Castanopsis platyacantha)-华木荷(Schima sinensis)群系(潘开文等,2003)。公园内次生林是在1956年大炼钢铁时期砍伐乔木层而遭到破坏后,在几乎无人为干扰的情况下自然恢复的(包维楷等,2000)。包维楷和刘照光(2002)对该区群落学特征的研究表明,扁刺栲在次生林中均占据着重要地位,重要值达21.126,是该区常绿阔叶次生林主要建群种。因此,扁刺栲的根系生长状态在该生态系统地下碳分配、养分循环等方面具有重要作用。
扁刺栲(Castanopsis platyacantha),又称扁刺锥或峨眉栲,为壳斗科(Fagaceae)栲属(Castanopsis)常绿乔木,主要分布于四川、贵州中部以西和云南东南部等海拔1 000~2 400 m的阔叶混交林中。扁刺栲作为中亚热带湿性常绿阔叶林区扁刺栲-华木荷群落中的优势乔木树种,同时也是该区域内一种发展前途很大的重要乡土阔叶树种,次生阔叶林中的快速生长期在10~14 a之间,胸径和树高生长最大值分别为0.85 cm和0.56 m(张远彬等,2003)。目前有关扁刺栲的报道基本以群落为基础(包维楷和刘照光,2002;潘开文等,2003),对树种本身还鲜有研究,对其细根的研究更是缺乏相应关注。本研究选择该区典型次生常绿阔叶林的主要建群种扁刺栲为研究对象,探讨其细根的分布和碳氮特征,为区域性森林地下生物量和碳氮分布特征提供基础依据。
1试验地概况及研究方法
试验地位于瓦屋山中山区的木姜岗林班(29°32′35″N,103°15′41″E),海拔1 600 m左右。该地段具有温和湿润、日照短、雨水多、云雾多、湿度大等特点,属中亚热带季风性湿润气候。年均温10℃左右,月均最高和最低温分别为22.5和−0.9℃,年日照时数330 h,年降水日278 d,年降雨量和蒸发量分别为2 323 mm和467 mm,年均相对空气湿度为85%~90%(潘开文等,2000)。该区成土母质是晚古生界二迭纪至元古界的砂岩、玄武岩、花岗岩等古老岩层风化的残积物,土壤类型为山地黄壤。该地段在破坏前均为顶极地带性常绿阔叶林扁刺栲+华木荷群落,1956年遭到砍伐破坏,遗留下一些幼树幼苗,后基本上无进一步的干扰破坏而得以自然恢复。目前已形成次生常绿阔叶成林,乔木层优势种为扁刺栲和华木荷;灌木层优势种为冬青(Ilex purpurea)和柃木(Eurya japonica)等;草本层主要是莎草(Cyperus rotundus),呈聚集分布(包维楷等,2000)。该样地林分结构为郁闭度(0.7)、密度每公顷为725株;平均胸径为林分23.5 cm、扁刺栲(Castanopsis platyacantha)23.8 cm、华木荷(Schina sinensis)25.4 cm。样地土壤基本理化性质见表1。

表1瓦屋山常绿阔叶次生林土壤理化性质(平均值±标准误)Table 1 Soil physicochemical properties of an evergreen broad-leaved secondary forest in Wawushan Mountain (Mean±SE)
1.1 样地设置和细根样品采集
2012年10 月,根据典型性和代表性原则在木姜岗林班设置10块20 m×20 m的样地,各样地间缓冲带大于20 m,坡向为北向,坡度0°~5°。2013年12月初,于各样地内按照平均标准木选择3株生长较好,相对独立的扁刺栲。采用土钻法采集扁刺栲细根样品(杨丽韫等,2007;罗东辉等,2010;王迪海等,2011)。在树干周围1/2冠幅的位置(到树干的距离约1 m)对称地选择两个样点,每样地6个样点,共60个样点。每样点用根钻(Ф= 7 cm)由上至下分4层(分别用Ⅰ、Ⅱ、Ⅲ、Ⅳ来表示,每一层垂直深度约为15 cm)钻取土芯样品。将取回的土芯样品放入0.2 mm筛中用流水浸泡冲洗,使根与大部分土壤分离后将根系挑出,并据根系形态和颜色区分扁刺栲的活根(Live roots)与死根(Dead roots)、灌木及杂草根系,并将灌木和杂草根系去除(杨丽韫等,2007)。最后将扁刺栲细根用去离子水冲洗干净后,低温冷冻保存。
1.2 细根形态和养分的测定
将扁刺栲活根按直径<1 mm(D<1)、1~2 mm (1≤D<2)、2~5 mm(2≤D<5)和≥5 mm(D≥5)分级。采用Epson数字化扫描仪(Expression 10000XL 1.0, Epson Electronics Inc., San Jose, USA)对分级后的根先进行扫描,再放入65℃烘箱中烘干至恒重,测定各级根系生物量干重(精确到0.000 1 g)。根系扫描图像用WinRHIZO (Pro 2004b)软件(Regent Instruments Inc., Quebec City, Canada)进行形态特征分析,主要指标包括各个根系直径、长度和体积。比根长(SRL: m·g−1)用总长度除以生物量计算得到。
全碳(Total carbon,TC)用重铬酸钾氧化-外加热法测定(LY/T 1237-1999);全氮(Total nitrogen,TN)用硫酸-高氯酸消煮,用半微量凯氏法测定(LY/T 1269-1999)。各指标均做3次平行测定。
1.3 数据分析与统计
用Gale & Grigal(1987)提出的根系垂直分布模型γ=1−βd,对不同直径的根系生物量、根系长度和根系表面积进行系数回归分析,式中,γ为从地表到一定深度的根系生物量、长度或表面积的累积百分比;d为土层深度(cm);β为根系消弱系数(root extinction coefficient)。β值越大,说明根系在深层土壤中分布的百分比越大;反之则说明根系主要集中分布在近表层土壤中。
采用SPSS16.0(SPSS Inc.,USA)中线性回归分析方法研究C/N与根系C和N含量变异的关系,并以根系直径和土层深度为因子对试验数据进行双因素方差分析(two-factors ANOVA)。利用Sigmaplot 10.0 (Systat software Inc.,USA)绘图。
2结果与分析
2.1 扁刺栲细根生物量分布特征
扁刺栲细根总生物量为173.62 g·m−2,其中活根生物量为135.29 g·m−2,占78%。方差分析结果表明,扁刺栲细根生物量主要分布在第Ⅰ土层,并随土层深度的增加呈极显著下降趋势,第Ⅰ、第Ⅱ、第Ⅲ、第Ⅳ土层细根生物量所占比例分别为39%、28%、19%和14%;扁刺栲细根生物量随直径的增加而显著减少,D<1的根系生物量占活根生物量的35.15%,是D≥5根系的2.4倍(图1,表2)。

图1 扁刺栲细根生物量的分布特征Fig. 1 Distribution patterns of fine root biomass of C. platyacantha
2.2 扁刺栲细根形态分布特征
扁刺栲细根总根长密度为2.51 m·m−2,总表面积为116.88 cm2·m−2。两者均随根系直径的增加而呈极显著减小趋势,随土层深度的增加而显著降低(图2:i, iii;表2)。其中,D<1根系的根长密度和表面积分别占54.30%和56.16%,D≥5的根系仅占7.88%和6.08%;第Ⅰ土层细根的根长密度和表面积分别占总细根根长密度和表面积的45.83%和47.38%,第Ⅳ土层占12.97%和12.90%。扁刺栲细根的比根长随根系直径增加而极显著减小,D<1根系的比根长

表2扁刺栲细根生物量和形态指标的方差分析Table 2 ANOVA of fine root biomass and morphology indicators of C. platyacantha
分别是1≤D<2、2≤D<5和D≥5根系的1.4、5.0 和60.9倍;随土层深度的增加而显著减小,第Ⅰ土层细根的比根长分别是第Ⅱ、第Ⅲ、第Ⅳ土层的1.1、1.3和1.6倍(图2:iii;表2)。
2.3 扁刺栲细根的垂直分布特征参数
表3显示,扁刺栲细根生物量、根长和表面积消弱系数β均随着根系直径的增加而增加,根据β所表达的意义,说明直径越大的根系在深层土壤中的分布比例越大,而直径越小的根系则越集中分布在近表层土壤中。调查结果显示,D<1和1≤D<2的根系生物量、长度和表面积在第Ⅰ土层中所占比例分别是42.80%和41.56%、47.97%和44.54%、47.99%和45.22%,而2
2.4 扁刺栲细根的碳氮分布特征
扁刺栲细根C储量为72.45 g·m−2,N储量为1.61 g·m−2。其中,活细根所占比例分别为76.71% 和72.81%,D<2 mm细根C、N含量分别为376.4 g·kg−2和9.4 g·kg−2,储量分别为27.49 g·m−2和0.68 g·m−2,分别占活根储量的49.5%和58.5%(图1,图3,表5)。第Ⅰ土层中,细根C含量随根系直径的增加而增加,总的来说不同直径和不同土层间细根C含量无显著差异(表4)。细根N含量随根系直径的增加而极显著减少,D<1的根系N含量较其他直径的根系高出24.55%~30.67%;垂直方向上,细根N含量随土层深度的增加而减少,第Ⅰ土层较其他土层高24.47%~41.81%(图3:ii;表4)。扁刺栲细根C/N值随土层深度和根系直径的增加而极显著增加,第Ⅰ土层中细根C/N值为其他土层的35.85%~69.28%,D<1的根系C/N值为其他细根的45.76%~87.43%(图3:iii;表4)。扁刺栲死细根C含量在不同土层间无显著差异,N含量随着土层的增加而显著减小,第Ⅰ土层中N含量比其他土层高出36.05%~52.00%。扁刺栲死细根C/N值随着土层的增加而显著增加,第Ⅰ土层根系C/N值为其他土层的51.59%~64.05%(表5)。

图2 扁刺栲细根形态指标的分布特征Fig. 2 Distribution patterns of fine root morphology of C. platyacantha

图3 扁刺栲细根碳氮分布特征Fig. 3 Distribution patterns of fine root carbon and nitrogen contents of C. platyacantha

表3扁刺栲细根生物量、根长和根系表面积消弱系数Table 3 Root extinction coefficient in fine root biomass, length and surface area of C. platyacantha

表4扁刺栲细根碳氮的方差分析Table 4 ANOVA of fine root carbon and nitrogen contents of C. platyacantha
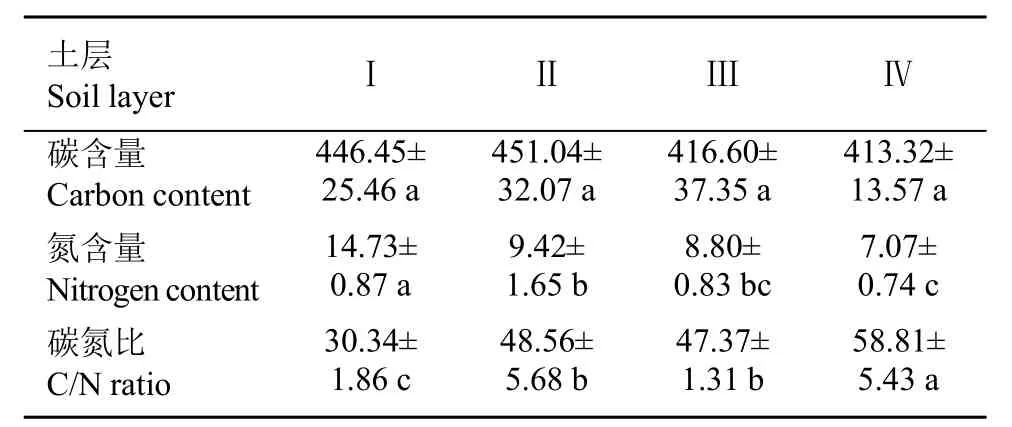
表5扁刺栲死细根碳氮分布特征Table 5 Distribution patterns of dead fine root carbon and nitrogen of C. platyacantha (g•kg−1)
3 讨论
根系作为植物生命活动中重要的生理器官,是植被与土壤界面进行物质和能量交换的主要通道,其形态和分布直接反映了林木对立地条件的利用状况,并对树木的生长起着决定性的作用。为保证植物生长所必需的水分和养分,根系生物量须维持在一定水平(梅莉等,2006)。本研究中扁刺栲总细根生物量为173.62 g·m−2,其中活根系总生物量为135.29 g·m−2。活细根中直径小于2 mm的细根生物量为73.04 g·m−2,所占比例为54.99%,与同处于中亚热带的青冈(Cyclobalanopsis glauca,54.4 g·m−2)和米槠(Castanopsis carlesii,85.5 g·m−2)接近,略低于拟赤杨(Alniphyllum fortune,104.1 g·m−2)、枫香(Liquidanbar acakycina,122.4 g·m−2)和细柄阿丁枫(Altingia gracilipes,122.6 g·m−2)(张雷,2009;黄锦学,2012),显著低于该区格氏栲(Castanopsis kawakamii)细根生物量(494.4 g·m−2)(杨玉盛,2003)。这说明与同气候带常绿阔叶林相比,该次生林扁刺栲细根生物量较大多数树种低。这可能与瓦屋山常绿阔叶次生林常年无人为管理,林内扁刺栲出现较多枯枝,甚至逐渐死亡有关。本研究还发现扁刺栲直径小于1 mm活细根根长密度、比根长和根系表面积所占比例分别达58.84%、51.36%和52.59%,说明直径小于1 mm的根系在扁刺栲根系中占主要地位,对其生理生态功能具有重要意义。Caldwell et al(1994)认为,根系动态主要是细根的动态,保持细根的吸收能力是维持细根生理生态功能的关键,这要求细根应具有较高的根长密度、比根长和表面积。因为这不仅能减少构建和维持单位长度细根的碳水化合物消耗,且有利于细根行使其吸收功能(Guo et al,2004)。
植物根系的生理生态功能除与其形态有关外,还与根系组织中一些元素,尤其是C和N含量密切相关(Eissenstat et al,1997)。本研究中,D<2 mm细根C、N含量分别为376.4和9.4 g·kg−2,均低于Jackson et al(1997)在全球尺度上对细根(直径小于2 mm)C、N含量的估计(488和11.7 g·kg−2)。扁刺栲细根C含量在不同土层和不同直径间无显著变化,而N含量随细根直径和土层深度的增加而下降。其中N含量随根系直径的变化趋势与Gordon & Jackso(2000)及Burton et al (2012)的研究一致;而C含量变化则有所不同,Gordon & Jackson(2000)综合前人的研究表明根系C含量随直径的增加而增加。扁刺栲细根N含量随直径变化的原因可能是:一方面直径越小的根系其生理代谢活动较为活跃,根尖细胞分裂旺盛(于立忠等,2009);另一方面直径较小的细根主要功能是吸收养分和水分,而根尖细胞的分裂及养分的吸收、同化和运输需消耗大量的能量(Lambers et al,1998);因此扁刺栲<1 mm的细根N含量最高。许旸等(2011)认为根系C、N含量的这种变化与根系维根比大小有关。维根比高低反映的是皮层厚度的相对大小,维根比高,说明皮层较薄,木质部占的比例较高(Guo et al,2008)。刘颖等(2010)的研究也证明,根系N含量随维根比增加而显著降低,C含量则显著升高。垂直方向上,随着土层深度的增加,该次生林土壤有机质和N、P等养分逐渐降低。Nadelhoffer(2000)研究认为,根系N含量与土壤资源有效性密切相关。杨振安等(2014)对华北落叶松(Larix principis-rupprechtii)人工林根系的研究在一定程度上说明了根系氮含量与土壤氮含量正相关。因此,扁刺栲细根氮含量随土壤深度增加而下降,约40%的细根氮储存在表层土壤中。这说明根系对养分的吸收主要是集中在土壤表层,同时也表明细根在生态系统养分循环中具有重要的作用(刘波等,2008)。扁刺栲细根C和N浓度的这种变化必然会导致其细根C/N值随直径的增加而增加,这与许多研究都是一致的(Gordon et al,2000;许旸等,2011)。
本研究表明,扁刺栲细根的分布随土层深度的增加而减少,超过67%的细根分布于0~30 cm土层,该区内细根的根长密度和根系表面积所占比例在70%以上;分布在0~15 cm土层的细根占39%,其根长密度和根系表面积所占比例分别达到46%和45%。可见,扁刺栲细根主要分布在表层土壤中,这与Macinnis-Ng et al(2010)对Cumberland平原的根系生物量分布和罗东辉等(2010)对我国西南山地喀斯特榕叶冬青(Ilex ficoidea)+西南米槠(Castanopsis carlesii)群落的研究结果相同。扁刺栲细根在不同土层间的这种分布模式可能与其生长的土壤养分含量和土壤容重随土层深度的变化有关。该次生林土壤C、N、P含量随土层深度的增加而减少,土壤容重则呈现出相反的趋势。一般而言,植物在较为肥沃的土层中会投入较多的光合产物、扩大根系表面积,从而尽可能多地吸收养分和水分,以满足自身的生理需求(Fransen et al,1998)。因此,本研究中扁刺栲细根会较多的分布在较为肥沃的表层,而在相对贫瘠的下层分布较少。梅莉等(2006)和Fortier et al(2013)的研究也说明不同土层间土壤资源有效性的差别是导致细根在表层分布较多的原因。另外,细根在土壤中更趋向于向阻力更小的方向生长。因此,在土壤容重较小的表层土壤中,细根生长受到的阻力较小,且由于土壤中养分充足,扁刺栲细根生长更快,表现为细根的根长密度、根系表面积和比根长较大,细根N含量也较高;而在土壤容重较大的下层土壤,由于细根生长受到的阻力较大,且分配得到的同化物质及土壤中可供吸收的养分较少,扁刺栲细根的分布极显著降低。可见,该次生林不同土层间土壤容重的变化也是导致扁刺栲细根在表层土壤中分布较多的原因之一。
综上所述,<1 mm的细根在扁刺栲根系中占有重要地位,由于其代谢活跃且具有吸收功能,N含量最高,C/N最小;为吸收养分和水分,扁刺栲<1 mm的细根生物量、根长、表面积和比根长均较高。这对发挥扁刺栲生理生态功能具有重要意义。由于该次生林不同土层间土壤理化性质不同,导致扁刺栲细根在肥沃疏松的表层分布较多、生长较快、N含量较高,而在贫瘠紧密的底层分布较少、N含量减小、C/N增加。这在一定程度上反映了该次生林地下细根垂直分布及养分特征,为揭示该生态系统地下生态过程及今后在该生态系统研究环境变化(如氮沉降)对地下生态过程的影响提供了基础数据。
BAO WK, LIU ZG, LIU CL, et al, 2000. Fifteen-year changes of tree layer in secondary Castanopsis Schima humid evergreen broad-leaves forest in central subtropics of Western China [J]. J Plant Ecol, 24(6): 702–709. [包维楷,刘照光,刘朝禄,等. 2000.中亚点苦湿性常绿阔叶次生林自然恢复15年来群落乔木层的动态变化[J].植物生态学报, 24(6): 702–709. ]
BAO WK, LIU ZG, 2002. Community features of the primary and naturally secondary evergreen broad-leaf forests in MT. Wawu in Sichuan, China [J]. Chin J Appl Environ Biol, 8(2): 120–126.[包维楷,刘照光. 2002.四川瓦屋山原生和次生常绿阔叶林的群落学特征[J].应用与环境生物学报, 8(2): 120–126.]
BURTON AJ, JARVEY JC, JARVI MP, 2012. Chronic N deposition alters root respiration–tissue N relationship in northern hardwood forests [J]. Glob Change Biol, 18(1): 258–266.
CALDWELL M, PEARCY R, 1994. Exploitation of environmental heterogeneity by plants: Ecophysiological processes above-and Belowground [M]. San Diego: Academic Press: 305–323.
EISSENSTAT DM, YANAI RD. 1997. The ecology of root lifespan [J]. Adv Ecol Res, 27: 1–60.
FORTIER J, TRUAX B, GAGNON D, et al, 2013. Root biomass and soil carbon distribution in hybrid poplar riparian buffers, herbaceous riparian buffers and natural riparian woodlots on farmland [J]. Springer Plus, 539(2):1–19.
FRANSEN B, DE KROON H, BERENDSE F, 1998. Root morphological plasticity and nutrient acquisition of perennial grass species from habitats of different nutrient availability [J]. Oecologia, 115(3): 351–358.
GALE MR, GRIGAL DF, 1987. Vertical root distributions of northern tree species in relation to successional status [J]. Can J For Res, 17(8): 829–834.
GORDON WS, JACKSON RB, 2000. Nutrient concentrations in fine roots [J]. Ecology, 81(1): 275–280.
GUO DL, MITCHELLl RJ, HENDRICKS JJ. 2004. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest [J]. Oecologia, 140(3): 450–457.
GUO DL, XIA MX, WEI X, et al, 2008. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species [J]. New Phytol, 180(3): 673–683.
GWENZI W, VENEKLAAS EJ, HOLMES KW, et al, 2011. Spatial analysis of fine root distribution on a recently constructed ecosystem in a water-limited environment [J]. Plant Soil, 348(1-2): 471–489.
HAJEK P, HERTEL D, LEUSCHNER C, 2014. Root order- and root age-dependent response of two poplar species to belowground competition [J]. Plant Soil, 377(1-2):337-355.
Huang JX, 2012. Estimating fine root production and mortality in subtropical Altingia grlilipes and Castanopsis carlesii forests [D]. Fuzhou: Fujian Normal University. [黄锦学. 2012.中亚热带细柄阿丁枫和米槠天然林群落细根生产和死亡动态研究[D].福州:福建师范大学.]
JACKSON RB, MOONEY HA, SCHULZE ED, 1997. A global budget for fine root biomass, surface area, and nutrient contents [J]. Proc Nat Acad Sci USA, 94(14): 7 362–7 366.
LAMBERS H, CHAPIN FS I, PONS TL, 1998. Plant Physiological Ecology [M]. New York: Springer-Verlag.
LEHMANN J. 2003. Subsoil root activity in tree-based cropping systems [J]. Plant Soil, 255(1): 319–331.
LI P, ZHAO Z, LI ZB, et al, 2005. Characters of root biomass spatial distribution of Robinia pseudoacacia in Weibei Loess areas[J]. Ecol Environ, 14(3): 405–409.[李鹏,赵忠,李占斌, 等. 2005.渭北黄土区刺槐根系空间分布特征研究[J].生态环境, 14(3): 405–409.]
LI Q, MA MD, LIU YJ, et al, 2007. Study on soil carbon and
nutrients pools of several evergreen broad—leaved forest types in Northwest Sichuan[J]. J Soil Water Conserv, 21(6): 114–125.[李强,马明东,刘跃建,等. 2007.川西北几种常绿阔叶林土壤碳库和养分库的比较[J].水土保持学报, 21(6): 114–125.] LIU B , YU YF , ZHANG YQ, et al, 2008. Fine root biomass and related nutrients in different aged stands of subtropical evergreen broad-leaved forest [J]. J Nanjing For Univ: Nat Sci Ed, 32(5): 81–84. [刘波,余艳峰,张贇齐,等. 2008.亚热带常绿阔叶林不同林龄细根生物量及其养分[J].南京林业大学学报·自然科学版, 32(5): 81–84.]
LIU J, LI S, OUYANG Z, et al, 2008. Ecological and socioeconomic effects of China's policies for ecosystem services [J]. Proc Nat Acad Sci, 105(28): 9 477–9 482.
LIU L, GAN Y, BUECKERT R, et al, 2011. Rooting systems of oilseed and pulse crops. II: Vertical distribution patterns across the soil profile [J]. Field Crop Res, 122(3): 248–255.
LIU Y, GU JC, WEI X, et al, 2010. Variations of morphology, anatomical structure and nitrogen content among first-order roots in different positions along branch orders in tree species [J]. J Plant Ecol, 34(11): 1 336–1 343. [刘颖,谷加存,卫星,等. 2010.树木不同着生位置1级根的形态,解剖结构和氮含量[J].植物生态学报, 34(11): 1 336–1 343.] LUO DH, XIA J, YUAN JW, et al, 2010. Root biomass of karst vegetation in a mountainous area of southwestern China [J]. J Plant Ecol, 34(05): 611–618.[罗东辉,夏婧,袁婧薇,等. 2010.我国西南山地喀斯特植被的根系生物量初探[J].植物生态学报, 34(05): 611–618.]
MA L, WU P, WANG X, 2014. Root distribution chronosequence of a dense dwarfed jujube plantation in the semiarid hilly region of the Chinese Loess Plateau [J]. J For Res, 19(1): 62–69.
MACINNIS-NG CMO, FUENTES S, O’GRADY AP, et al, 2010. Root biomass distribution and soil properties of an open woodland on a duplex soil [J]. Plant Soil, 327(1-2): 377–388.
MEI L, WANG ZQ, HAN YZ, et al, 2006. Distribution patterns of Fraxinus mandshurica root biomass, specific root length and root length density[J]. Chin J Appl Ecol, 17(1): 1–4. [梅莉,王政权,韩有志,等. 2006.水曲柳根系生物量、比根长和根长密度的分布格局[J].应用生态学报, 17(1): 1–4.]
NADELHOFFER KJ. 2000. The potential effects of nitrogen deposition on fine-root production in forest ecosystems [J]. New Phytol, 147(1): 131–139.
PAN KW, LIU CL, LIU ZG, et al, 2000. Climate resource and the utilization strategies in Wawushan Mountain Area [J]. J MT Sci, 18(2):122-128. [潘开文,刘朝禄,刘照光,等. 2000.四川瓦屋山地区气候资源特点与利用对策[J].山地学报18(2):122–128.]
PAN KW,ZHANG YB, 2003. Percentage of soil absolute moisture content at different succession stages of Castanopsis platyacantha-Schima sinensis formation in central subtropical zone of Sichuan Province [J]. Chin J App Ecol, 14(2): 165–169.[潘开文,张远彬. 2003.四川中亚热带扁刺栲-华木荷群系不同演替阶段土壤含水率的研究[J].应用生态学报14(2): 165–169.]
PENG SL, HAO YR, 2005. The dynamics of forest root and its distribution during succession[J]. Acta Sci Nat Univ Sunyatseni, 44(5): 65-69. [彭少麟,郝艳茹. 2005.森林演替过程中根系分布的动态变化[J].中山大学学报•自然科学版, 44(5): 65–69.]
SCHENK HJ, 2008. The shallowest possible water extraction profile: a null model for global root distributions [J]. Vadose Zone J, 7(3): 1 119–1 124.
WANG DH, ZHAO Z, LI J, 2010. Difference of surface area of fine roots of Robinia pseudoacacia in the different climate regions of Loess Plateau [J]. Sci Silv Sin, 46(5): 70–76. [王迪海,赵忠,李剑. 2010.黄土高原不同气候区刺槐细根表面积的差异[J].林业科学, 46(5): 70–76.]
WANG XH, YAN ER, YAN X, et al, 2005. Analysis of degraded evergreenbroad-leavedforestcommunitiesin Eastern Chinaandissues in forest restoration [J]. Acta Ecol Sin, 25(7): 1 796–1 803. [王希华,闫恩荣,严晓,等. 2005.中国东部常绿阔叶林退化群落分析及恢复重建研究的一些问题[J].生态学报,25(7):1796–1803.]
WANG Y, OUYANG ZY, ZHENG H, et al, 2012. Relationships between carbon source utilization of soil microbial communities and environmental factors in natural secondary forest in subtropical area, China[J]. Acta Ecol Sin, 32(6): 1 839-1 845. [王芸,欧阳志云,郑华,等. 2012.中国亚热带典型天然次生林土壤微生物碳源代谢功能影响因素[J].生态学报, 32(6):1 839–1 845.]
XIANG W, LIU S, LEI X, et al, 2013. Secondary forest floristic composition, structure, and spatial pattern in subtropical China [J]. J For Res, 18(1): 111–120.
XU Y, GU JC, DONG XY, et al, 2011. Fine root morphology, anatomy and tissue nitrogen and carbon contents of the first five orders in four tropical hardwood species in Hainan Island, China [J]. J Plant Ecol, 35(9): 955–964. [许旸,谷加存,董雪云,等. 2011.海南岛4个热带阔叶树种前5级细根的形态、解剖结构和组织碳氮含量[J].植物生态学报, 35(9): 955–964.]
YANG YL, LUO TX, WU ST, 2007. Fine root biomass and its depth distribution across the primitive Korean pine and broad-leaved forest and its secondary forests in Changbai Mountain, Northeast China[J]. Acta Ecol Sin, 27(9):3 609–3 617. [杨韫丽,罗天祥,吴松涛. 2007.长白山原始阔叶红松(Pinuskoraiensis)林及其次生林细根生物量与垂直分布特征[J].生态学报, 27(9):3 609–3 617.]
YANG YS, CHEN GS, LIN P, et al, 2003. Fine root distribution, seasonal pattern and production in a native forest and monoculture plantations in subtropical China [J]. Acta Ecol Sin, 23(9): 1 719–1 730. [杨玉盛,陈光水,林鹏,等. 2003.格氏栲天然林与人工林细根生物量、季节动态及净生产力[J].生态学报, 23(9):1 719–1 730.]
YANG ZA, SONG SF, LI J, et al, 2014. A study on root characteristics and nutrients of different aged Larix Principisrupprechtii Mayr. plantations [J]. Acta Bot Boreal-Occident Sin, 34(07): 1 432–1 442. [杨振安,宋双飞,李靖,等. 2014.不同林龄华北落叶松人工林根系特征和氮磷养分研究[J].西北植物学报, 34(07): 1 432–1 442.]
Distribution patterns and carbon and nitrogen contents of Castanopsis platyacantha fine roots, the constructive species of evergreen broad-leaved secondary forest in Wawushan Mountain of Sichuan Province
PENG Yong, CHEN Guan-Tao, LIANG Zheng, LI Shun, PENG Tian-Chi, TU Li-Hua*
( College of Forestry, Sichuan Agricultural University, Chengdu 611130, China )
The Wawushan Mountain National Forest Park in Sichuan Province, where there is relatively intact Castanopsis platyacantha-Schima sinensis formations, is a typical representative of the mid-subtropical moist evergreen broad-leaved forest in West China. Using the soil core method, this study investigated the fine root distribution and characteristics of carbon and nitrogen of sample C. platyacantha which is the main constructive species in this formation. The results were as follows: (1) The total fine root biomass of C. platyacantha was 173.62 g·m−2and the total biomass of live fine roots was 135.29 g·m−2. (2) The fine root biomass, root length density, root surface area and specific root length decreased with the increase of soil depth, and their proportions in 0-30 cm layers were 67.23%, 69.53%, 69.48% and 57.20%, respectively; root length density, root surface area and specific root length decreased significantly with increasing root diameter, and 58.84%, 52.59% and 51.36% of them were in the roots that diameter was less than 1 mm, respectively. (3) Root extinction coefficient in biomass, length and surface area of C. platyacantha fine root increased with the rise of the root diameter. (4) In the first soil layer, the roots C content increased significantly with the rising root diameter, but there was no significant difference in other soil layers; the C content of the roots whose diameter was less than 2 mm in the first soil layer was significantly lower than other soil layers, while the differences of roots C content of greater than 2 mm among soil layers was insignificant. (5) The roots N content decreased with the increase of soil depth and root diameter, while the C/N ratio value was opposite. These results reflected the vertical distribution of the secondary forest underground fine root system and nutrient characteristics, which would provided some basic data for revealing the subsurface ecological processes and the effects of environmental change on ecological processes in the underground in the ecosystem.
evergreen broad-leaved forest, Castanopsis platyacantha, fine root, carbon content, nitrogen content
Q948,S71
A
1000-3142(2016)02-0177-09
10.11931/guihaia.gxzw201510016
彭勇,陈冠陶,梁政,等.瓦屋山常绿阔叶次生林建群种扁刺栲的细根分布及其碳氮特征[J].广西植物,2016,36(2):177-185
PENG Y,CHEN GT,LIANG Z,et al. Distribution patterns and carbon and nitrogen contents of Castanopsis platyacantha fine roots,the constructive species of evergreen broad-leaved secondary forest in Wawushan Mountain of Sichuan Province[J]. Guihaia,2016,36(2):177-185
2015-10-14
2015-12-22
国家自然科学基金(31300522,31200474);国家教育部博士学科点专项基金(20125103120018);国家“十二五”科技支撑计划项目
(2011BAC09B05);四川省教育厅重点项目(12ZA118, 13ZA0246) [Supported by the National Natural Science Foundation of China (31300522, 31200474);the Specialized Research Foundation for the Doctoral Program of Higher Education (20125103120018);the National Key Technology Research and Development Program During the 12th Five-year Plan Period(2011BAC09B05);the Key Project of Sichuan Provincial Department of Education (12ZA118, 13ZA0246)]。
彭勇(1990-),男,四川叙永人,硕士研究生,主要从事森林生态学相关研究,(E-mail)penyom@163.com。
*通讯作者:涂利华,博士,副教授,主要从事森林生态、全球变化相关研究,(E-mail)iamtlh@163.com。

