三月竹开花前后几种重要代谢物差异研究
王双燕,李志宏,易同培,,史军义,甄 铧∗
(1.四川农业大学,成都611130;2.四川黑竹沟国家级自然保护区管理局,四川乐山614300;3.中国林业科学研究院西南花卉研究开发中心,昆明650224)
三月竹开花前后几种重要代谢物差异研究
王双燕1,李志宏2,易同培1,3,史军义3,甄 铧1∗
(1.四川农业大学,成都611130;2.四川黑竹沟国家级自然保护区管理局,四川乐山614300;3.中国林业科学研究院西南花卉研究开发中心,昆明650224)
三月竹(Chimonobambusa opienensis)为禾本科竹亚科寒竹属植物,是国家一级保护动物大熊猫主食竹种,也是当地农民和笋竹加工企业的一大重要经济来源。该研究以开花与未开花三月竹为材料,采用吸光光度法、差量法、苯酚硫酸法、考马斯亮蓝G-250染色法、愈创木酚显色法、邻苯三酚自氧化法,对三月竹开花前后各部位多种重要代谢物进行测定,并用统计方法进行差异分析。结果表明:三月竹开花后,叶与次生枝叶绿素含量分别下降14.42 和71.39 (P<0.05);次生枝与主枝油脂含量分别下降20.93 和26.04 (P<0.05);叶与次生枝可溶性糖含量分别上升21.04 和17.81 ,淀粉上升8.33 和8.21 ,纤维素上升17.62 和8.52 (P< 0.05);叶与次生枝可溶性蛋白质含量分别下降30.07 和37.31 (P<0.05);上叶POD活性上升122.01 (P< 0.05)。这说明三月竹开花与多种有机营养和生化指标的变化关联,可通过监测叶与次生枝叶绿素含量,次生枝与主枝油脂含量,叶与次生枝可溶性糖、淀粉、纤维素含量,叶与次生枝可溶性蛋白质含量,上叶POD活性来实现对三月竹生长的管理调控。该研究结果可为进一步研究三月竹开花衰老机理和延期开花提供参考。
三月竹,竹子开花,有机营养,生化指标
三月竹(Chimonobambusa opienensis)是禾本科竹亚科寒竹属植物(易同培和蒋学礼,2010),主产于四川峨边,马边、甘洛等地也有少量分布,生于海拔1 500~2 200 m之间,总面积约40 000 hm2(蒋学礼等,2011)。每年4-5月中旬为三月竹产笋高峰期,其笋质细嫩,笋味鲜美,备受广大消费者喜爱,是当地农民及笋竹加工企业的重要经济来源。三月竹也是国家一级保护动物大熊猫重要主食竹种(蒋学礼等,2011)。据报道和实地调查,三月竹自2010年春末夏初开始开花,至2013年5月止的4 a时间里,峨边的三月竹因在不同地段开花死亡面积已达90 ,给当地笋农和企业带来了较大经济损失,同时对野生大熊猫生存造成一定威胁(欧军,2013)。
竹子为多年生一次开花植物,多数竹类遵循集体开花死亡的生长规律(何瑛,2004)。竹子开花是一种复杂的生理生化过程,也是其生长繁殖不可避免的一个环节(柴振林等,2006),开花过程必然导致其主要物质含量及代谢特征的改变,也有开花信号物质即决定成花转变的关键性物质产生(王小红,2013)。关于竹子开花原因的研究,目前主要是从开花现象的观察和国内外史料的统计分析着手,提出许多有关竹类开花的学说,如生长周期说、营养说、外因说、自由基理论、病理学说、个体突变学说等(柴振林等,2006)。为了更深入地研究竹子开花,部分学者(张春霞等,2003;何奇江等,2005;王小红和周祖基,2008;谢寅峰等,2009)对开花竹的物质代谢进行了研究,但目前无论是对开花代谢关键物质的筛选确定,还是开花期间生理代谢机制基本规律的研究仍未取得实质性进展。本研究根据三月竹形态结构特征,优化了部分指标测定方法,将开花竹与未开花竹主要有机营养和生化指标进行比较,其结果将为进一步探明三月竹开花机理提供参考。
1 材料与方法
1.1 材料采集、预处理
三月竹原发表时无花、果的记载,蒋学礼等(2011)对其花果进行了补充描述,其模式标本采自峨边县新林乡。自2010年以来,三月竹在峨边县不同地点陆续开花。作者在2013年4-5月间分两次在产地随机挑选长势良好、病虫害、海拔高度和林相等均一致的成片正在开花与尚未开花三月竹林进行分析样本采集。开花和未开花的各采3株带地下茎的完整测试样本竹,去泥土后分株、分段后置于塑料袋中并密封运输至化学分析地。清洗干净,以开花和未开花植株样本,分别按地下茎、秆茎、主枝(由秆茎节抽出的枝条)、次生枝(由主枝节上抽出的枝条)、叶和花序分类(胡尚连等,2012),其秆、主枝、次生枝、叶和花序等均从秆上、中、下三个部位采取,混合后,经105℃烘箱杀青,75℃烘至恒重,粉碎过60目筛,密封保存,以备各项相关指标测定之用。
1.2 测定指标及方法
叶绿素含量测定按李合生(2003)的分光光度法;油脂(游离脂类)含量测定用差量法;过氧化物酶(POD)活性测定用愈创木酚显色法(张志良和瞿伟著,2003),以每1 min OD值变化0.01为一个酶活性单位。超氧化物歧化酶(SOD)活性测定用邻苯三酚自氧化法,可溶性蛋白质含量测定用考马斯亮蓝G-250法(李合生,2000)。可溶性糖、淀粉、纤维素采用联合提取与测定:沸水浴提取可溶性糖,苯酚硫酸比色法(侯五爱等,2013)测定含量;提取可溶性糖后的固形物用高氯酸法提取淀粉,苯酚硫酸比色法测定含量;提取淀粉后的固形物用浓硫酸消解法提取纤维素,苯酚硫酸比色法测含量。采用完全随机区组设计,开花与未开花竹各3株,各部位各指标的测定均设3次重复,得到数据取均值。
1.3 数据处理
用DPS v7.05软件进行数据分析,用双样本平均数差异检验法进行统计,用Excel 2003软件作图。

表1 开花竹与未开花竹叶绿素含量差异分析Table 1 Difference analysis of chlorophyll contents in flowering and non-flowering Chimonobambusa opienensis
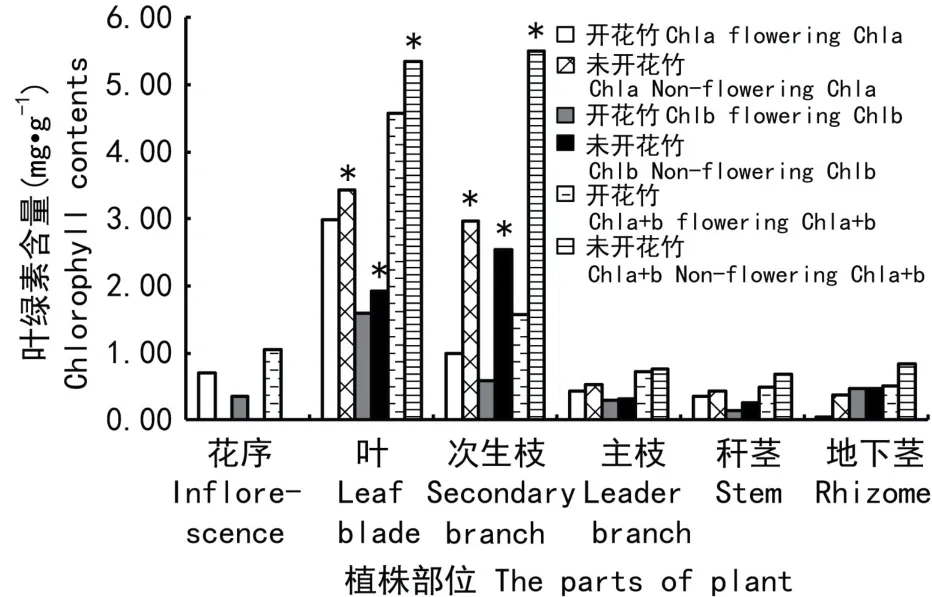
图1 开花竹与未开花竹叶绿素含量测定结果Fig.1 Result of chlorophyll contents in flowering and non-flowering C.opienensis
2 结果与分析
2.1 叶绿素含量比较分析
开花竹和未开花竹的不同部位Chla、Chlb和总叶绿素(Chla+b)含量的DPS差异分析、测定结果见表1、图1。从表1和图1结果可知,开花竹和未开花竹叶与次生枝Chla、Chlb、Chla+b含量较其他部位较高。开花竹叶与次生枝Chla、Chlb、Chla+b含量与未开花竹比较,Chla含量分别下降了12.81 和66.46 ,Chlb含量分别下降了17.32 和77.20 ,Chla+b含量分别下降了14.42 和71.39 (P<0.05)。这说明三月竹开花后,叶与次生枝叶绿素含量显著降低,光合作用的光能吸收减弱,有机物合成大量减少,加上需要大量营养物质用于开花结实,从而加速植株的衰老死亡。竹类秆茎、枝、叶位于地上,叶绿素在阳光下变为绿色,叶绿素减少,叶片颜色变淡甚至变为黄色,肉眼可以观察到,但地下茎叶绿素含量减少肉眼是观察不到的,必须用化学分析方法才能知晓。开花竹地下茎叶绿素含量的大量减少,或许为竹类开花研究提供了新资料。
2.2 油脂含量比较分析
开花与未开花三月竹的不同部位油脂含量的DPS差异分析、测定结果见表2、图2。表2和图2结果显示:开花竹的花序和叶与未开花竹的叶油脂含量较高,表明油脂代谢部位以花序和叶片最为活跃,且开花竹叶片油脂含量较未开花竹上升了19.12 (P<0.05);开花竹各部位(除叶与花序外)油脂含量均低于未开花竹,且次生枝与主枝含量较未开花竹分别下降了20.93 ,26.04 (P<0.05)。三月竹开花期,叶片与花序成为油脂代谢的主要场所,表明其油脂含量的变化与三月竹开花衰老关系密切。
2.3可溶性糖含量比较分析
开花与未开花三月竹的不同部位可溶性糖含量的DPS差异分析、测定结果见表3、图3。表3和图3结果显示:开花竹各部位可溶性糖含量均高于未开花竹,花序含量最高,叶、次生枝、主枝、秆茎和地下茎较未开花竹分别上升了21.04 ,17.81 ,24.46 ,24.59 ,10.65 (P<0.05)。表明三月竹开花期,植株各部位可溶性糖代谢较未开花竹活跃,三月竹开花与可溶性糖含量增加关系密切。

表2 开花竹与未开花竹油脂含量差异分析Table 2 Difference analysis of fat contents in flowering and non-flowering C.opienensis

图2 开花竹与未开花竹油脂含量测定结果Fig.2 Result of fat contents in flowering and non-flowering C.opienensis

表3 开花竹与未开花竹可溶性糖含量差异分析Table 3 Difference analysis of soluble sugar contents in flowering and non-flowering C.opienensis
2.4 淀粉含量比较分析
开花与未开花三月竹的不同部位淀粉含量的DPS差异分析、测定结果见表4、图4。表4和图4结果显示:开花竹各部位淀粉含量均高于未开花竹且开花竹叶与次生枝淀粉含量较未开花竹分别上升了8.33 ,8.21 (P<0.05,P<0.01)。据此推测,三月竹开花期,叶与次生枝淀粉代谢较未开花竹活跃,其淀粉含量的变化与三月竹开花衰老相关。众多研究也表明,碳水化合物等营养物质含量的变化与花芽分化进程呈一定相关,进而引起植物开花。

图3 开花竹与未开花竹可溶性糖含量测定结果Fig.3 Result of soluble sugar contents in flowering and non-flowering C.opienensis

表4 开花竹与未开花竹淀粉含量差异分析Table 4 Difference analysis of starch contents in flowering and non-flowering C.opienensis
2.5 纤维素含量比较分析
开花与未开花三月竹的不同部位纤维素含量的DPS差异分析、测定结果见表5、图5。表5和图5结果显示:开花竹叶、次生枝和主枝纤维素含量较未开花竹分别上升了17.62 ,8.52 ,18.45 (P< 0.05),表明开花竹叶、次生枝与主枝纤维化升高。表明三月竹开花期,叶、次生枝与主枝纤维素含量的变化与三月竹开花衰老相关。
2.6 可溶性蛋白质含量比较分析
植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,测其含量是了解植物总代谢的一个重要指标。开花与未开花三月竹的不同部位可溶性蛋白质含量的DPS差异分析、测定结果见表6、图6。表6和图6结果显示:开花竹的花序和叶与未开花竹的叶可溶性蛋白质含量显著高于其他部位,表明可溶性蛋白质代谢部位以花序和叶最为活跃;开花竹叶与次生枝可溶性蛋白质含量较未开花竹分别下降了30.07 ,37.31 (P<0.05)。据此推测,三月竹开花期叶与次生枝可溶性蛋白质代谢显著降低,其含量的变化与三月竹开花衰老相关。

图4 开花竹与未开花竹淀粉含量测定结果Fig.4 Result of starch contents in flowering and non-flowering C.opienensis

表5 开花竹与未开花竹纤维素含量差异分析Table 5 Difference analysis of cellulose contents in flowering and non-flowering C.opienensis
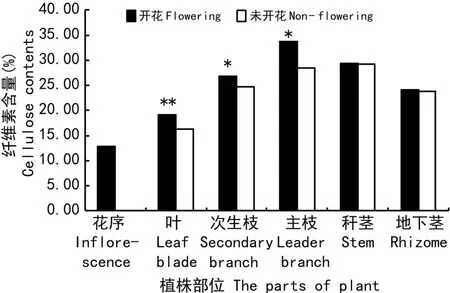
图5 开花竹与未开花竹纤维素含量测定结果Fig.5 Result of cellulose contents in flowering and non-flowering C.opienensis
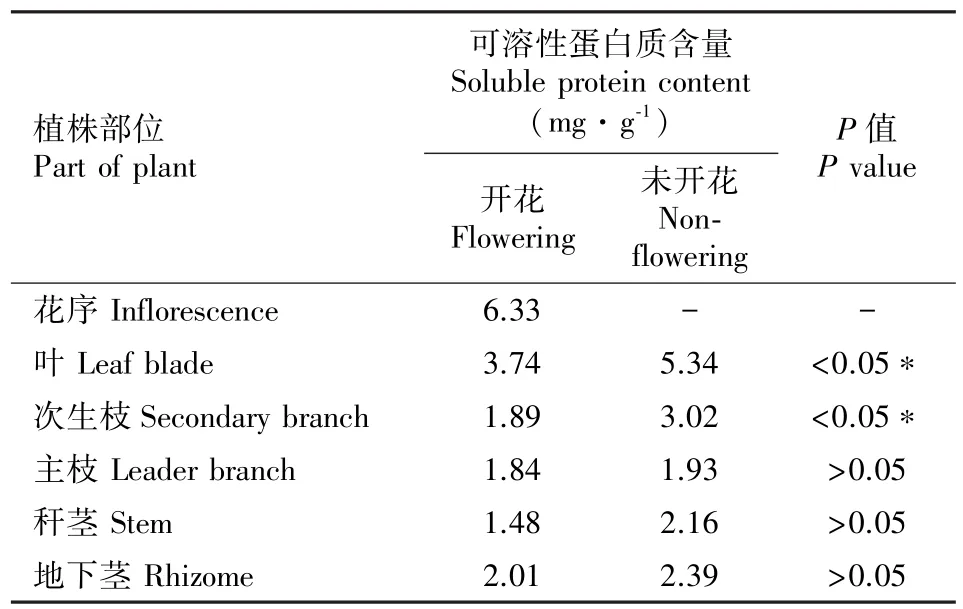
表6 开花竹与未开花竹可溶性蛋白质含量差异分析Table 6 Difference analysis of soluble protein contents in flowering and non-flowering C.opienensis

图6 开花竹与未开花竹可溶性蛋白质含量测定结果Fig.6 Result of soluble protein contents in flowering and non-flowering C.opienensis
2.7 过氧化物酶(POD)、超氧化物岐化酶(SOD)活性比较分析
开花与未开花三月竹的不同部位POD、SOD活性差异的DPS分析见表7。表7结果显示:开花竹上叶、中叶、下叶(秆上部、中部和下部枝条上的叶) POD活性较未开花竹相应部位分别上升了122.01 ,6.01 ,9.58 (P<0.05),SOD活性较未开花竹相应部位分别上升了5.84 ,3.45 ,6.47 (P<0.05),表明三月竹开花后自身防御能力的降低和自由基含量的上升。三月竹的开花现象不同于其它非竹类植物,其开花后即枯萎死亡也说明其抗氧化酶类的上升不及体内自由基的上升,随着开花的进一步发展,自由基积累加剧引起植株最终枯萎死亡。
由花序,上叶,中叶到下叶,开花与未开花三月竹的POD,SOD活性均呈现出逐渐上升趋势,其与一般老化组织中POD活性较高,幼嫩组织中活性较弱,与Lewis&Yamamoto(1990)相一致。

表7 开花竹与未开花竹POD、SOD活性差异分析Table 7 Difference analysis of POD and SOD activities in flowering and non-flowering Chimonobambusa opienensis
3 讨论与结论
3.1 叶绿素含量、过氧化物酶(POD)、超氧化物岐化酶(SOD)活性比较结果分析
高等植物叶绿素主要有叶绿素a(Chla)和叶绿素b(Chlb)两种,广泛存在于绿色植物组织中,参与光合作用的光能吸收,叶绿素含量是衡量植株生长衰老情况的主要因素之一(张春霞等,2003)。叶绿素在绿色植物中的降解途径至少有两类:一是包括叶绿素酶等在内的“PaO”途径降解;另一条是由一系列氧化酶作用的叶绿素“漂白”过程,叶绿素的降解受多种因素的影响,其作用机制也有不同(杨晓棠等,2005)。本研究表明,开花三月竹次生枝叶绿素含量较未开花竹下降了71.39 ,生产上可通过监测次生枝叶绿素含量变化来实现对三月竹生长的管理调控。本研究所得三月竹开花后其地下茎可溶性糖含量显著上升而叶绿素含量下降的结果,表明糖信号可调控三月竹的衰老,表现为开花三月竹叶绿素含量降低。开花三月竹地下茎叶绿素含量的大量减少或许为竹类开花研究提供新资料。
POD是植株抗氧化酶系统中的一种酶,在胁迫条件下,POD能够把由自由基生成的H2O2转化为对植物体不造成危害的H2O,从而保持自由基和H2O2的平衡(方慧等,2012)。SOD是含金属的抗氧化酶,保护机体不受O-2ű攻击,在植物界普遍存在且具多种类型,高等植物以Cu/ZnSOD为主(袁勤生,2007)。它们和其他一些生物活性物质组成了生物体内清除活性氧自由基的多酶复合体,具有抗自由基的配合、协同作用。三月竹开花后体内POD、SOD活性增强,活性氧含量快速上升,蒋明义等(1994)的研究表明活性氧可加速叶绿素的降解。由此可推测,引起开花三月竹地下茎叶绿素含量大量减少可能与活性氧变化有关,其具体作用机制有待进一步研究。事实是无论所采开花竹材是否属于同一无性系基株,一旦开花程序启动,因大量的营养物质被用于花序和种子的发育,必然影响其他器官的代谢成分发生相应的变化,所以引起开花三月竹地下茎叶绿素含量大量减少的因素是多方面的。
3.2可溶性糖、淀粉、纤维素含量比较结果分析
糖能够以类似植物激素的方式作为一种信号分子存在,在植物的生长发育、成熟和衰老等许多过程中发挥调控作用(Koch et al,2000;张云和刘青林,2003)。植物可溶性糖是植物花芽形态分化进程中所需营养物质最多之一(钟晓红等,1999)。淀粉一般以淀粉粒形式存在于植物细胞中,是植物体内最主要的多糖,制造淀粉是植物贮存能量的一种方式(陆大雷等,2009)。三月竹开花后,叶与次生枝的可溶性糖、淀粉、纤维素含量均较未开花竹显著上升,主枝、秆茎、地下茎的可溶性糖含量和主枝纤维素含量也较未开花竹显著上升,表明高碳水化合物水平与植物衰老进程关系密切(Parrott et al,2005)。开花三月竹花序的可溶性糖、淀粉含量较植株各部位为最高,花序代谢活动旺盛,需要消耗大量的营养物质,叶片等营养器官就作为“源”向其供应,使得叶片等营养器官含量低于花序,表现为生殖生长大于营养生长,叶片等营养器官加速衰老。本研究表明,开花三月竹叶与次生枝可溶性糖含量的上升量(21.04 ,17.81 )大于淀粉上升量(8.33 ,8.21 ),可能其中储存的淀粉等碳水化合物转化为蔗糖等可溶性糖。
3.3 可溶性蛋白质含量比较结果分析
本研究开花竹叶与次生枝可溶性蛋白质含量较未开花竹分别下降了30.07 ,37.31 ,表明可溶性蛋白质含量变化与三月竹开花衰老关系密切,这与何奇江等(2005)对雷竹开花期研究结果一致。生产上可通过监测叶与次生枝可溶性蛋白质含量变化来实现对三月竹生长的管理调控。开花三月竹花序可溶性蛋白质含量是所有部位中最高,花序氮代谢增强而营养部位降低,刘连涛等(2007)的研究认为氮素营养的缺乏将导致植株整体叶绿素、可溶性蛋白质含量的下降,加速植株衰老。
部分学者对竹开花期间碳氮代谢进行了研究,如王小红和周祖基(2008)的研究得出,水竹开花后机体碳代谢增强而氮代谢显著降低,预示水竹从营养生长向生殖生长的转变。谢寅峰等(2009)的研究得出,鹅毛竹开花叶片的可溶性糖与蛋白质之比随着开花的进展呈显著增加,花后叶片衰老加速。本研究开花与未开花三月竹可溶性糖、淀粉、纤维素和可溶性蛋白质的含量变化图表中也揭示三月竹开花后碳代谢增强,预示氮代谢降低,植株表现出加速衰老。在植物生长发育过程中,碳代谢与氮代谢之间常是相互竞争、相互作用。水竹开花、鹅毛竹开花、雷竹开花和三月竹开花在这方面的研究结果呈现共性。
开花三月竹上叶POD活性较未开花竹上升幅度大(122.01 ),生产上可通过监测上叶POD活性变化来实现对三月竹生长的管理调控。本研究测定的油脂属于游离脂类,包括脂肪、游离脂肪酸、磷脂、固醇、芳香油及某些色素,又称为粗脂肪。研究表明,油脂含量的变化与三月竹开花衰老关系密切,其具体作用机制还有待进一步研究。
CHAI ZL,QIN YC,HUA XQ,et al,2006.Advance of studies on bamboo flowering causes[J].J Zhejiang For Sci Technol,26 (2):53-57. [柴振林,秦玉川,华锡奇,等,2006.竹子开花原因研究进展[J].浙江林业科技,26(2):53-57.]
FANG H,ZOU Q,HE Y,et al,2012.Detection of activity of POD in tomato leaves based on hyperspectral imaging technology [J].Spectrosc Spect Anal,32(8):2 228-2 233. [方慧,邹强,何勇,等,2012.基于高光谱的番茄叶片过氧化物酶活力测定[J].光谱学与光谱分析,32(8):2 228-2 233]
HE QJ,WANG KH,HUA XQ,et al,2005.Change of endogenous hor-mones,amino-acid and nutrition in flowering stage of phyllostachys praecox f.Prevernalis[J].Sci Silv Sin,41(2):169-173. [何奇江,汪奎宏,华锡奇,等,2005.雷竹开花期内源激素、氨基酸和营养成分含量变化[J].林业科学,41(2):169-173.]
HE Y,2004.Half of the bamboo around the world on the edge of extinction[J].SW Pulp Pap,33(3):18. [何瑛,2004.全世界半数竹类濒临灭绝[J].西南造纸,33(3):18.]
HOU WA,YUE ZJ,2013.Determination of polysaccharide from as-tragalus mushroom by phenol-sulfuric acid method[J].Chin J Spectrosc Lab,30(5):2 475-2 477. [侯五爱,岳志劲,2013.苯酚-硫酸法测定北芪菇多糖的含量[J].光谱实验室,30(5):2 475-2 477.]
HU SL,CHEN QB,SUN X,et al,2012.Physio-biochemical charac-teristics and genetic improvement in sympodial bamboo [M].Beijing:Science Press:1-3. [胡尚连,陈其兵,孙霞,等,2012.丛生竹生理生化特性与遗传改良[M].北京:科学出版社:1-3.]
JIANG MY,YANG WY,XU J,et al,1994.Active oxygen damage effect of chlorophyll degradation in rice seedlings under osmotic stress[J].J Integr Plant Biol,36(4):289-294. [蒋明义,杨文英,徐江,等,1994.渗透胁迫下水稻幼苗中叶绿素降解的活性氧损伤作用[J].植物学报,36(4):289-294.]
JIANG XL,YI TP,LI ZH,et al,2011.Supplementary description of the flower and fruit of Qiongzhuea opienensis Hueh et Yi[J].J Sichuan For Sci Technol,32(2):13-15. [蒋学礼,易同培,李志宏,等,2011.关于三月竹Qiongzhuea opienensis Hsueh et Yi花果的补充描述[J].四川林业科技,32(2):13-15.]
KOCH KE,YING Z,WU Y,et al,2000.Multiple paths of sugarsensing and a sugar/oxygen overlap for genes of sucrose and eth-anol metabolism[J].J Exp Bot,51(1):417-427.
LEWIS N G,YAMAMOTO E.1990.Lignin:occurrence,biogenesis and biodegradation[J].Ann Rev Plant Physiol Plant Mol Biol,41:455-496.
LI HS,2003.Experimental guidance of plant physiology[M].Bei-jing:Higher Education Press:134-137. [李合生,2003.植物生理学实验指导[M].北京:高等教育出版社:134-137.]
LIU LT,LI CD,SUN HC,et al,2007.Physiological effects of nitrogen nutrition on the senescence of cotton leaves at different positions [J].P1ant Nutr Fert Sci,13(5):910-914. [刘连涛,李存东,孙红春,等,2007.氮素营养水平对棉花不同部位叶片衰老的生理效应[J].植物营养与肥料学报,13(5):910-914.]
LU DL,WANG DC,ZHAO JR,et al,2009.Crystalline structure and pasting properties of starch in eight waxy corn cultivars grown in spring and autumn[J].Acta Agron Sin,35(3):499-505. [陆大雷,王德成,赵久然,等,2009.生长季节对糯玉米淀粉晶体结构和糊化特性的影响[J].作物学报,35(3):499-505.]
OU J,2013.The hundreds of thousands of Chimonobambusa opienensis Hsueh et Yi’s flowering and dying in ebian has affected the harvest[N].Sanjiang Daily:5-11. [欧军,2013.峨边数十万亩三月竹开花死亡笋农绝收[N].三江都市报:5-11.]
PARROTT D,YANG L,SHAMA L,et al,2005.Senescence is ac-celerated,and several proteases are induced by carbon“feast”conditions in barley(Hordeum vulgare L. )leaves[J].Planta,222(6):989-1 000.
WANG XH,2013.Advance in research of bamboo flowering [J].Chin For Sci Technol,27(5):10-14. [王小红,2013.竹子开花研究概述[J].林业科技开发,27(5):10-14.]
WANG XH,ZHOU ZJ,2008.Characteristics of carbon and nitrogen metabolism of phyllostachys heteroclada at flowering stage [J].Sci Silv Sin,44(4):35-40. [王小红,周祖基,2008.水竹开花期间碳氮代谢特性[J].林业科学,44(4):35-40.]
XIE YF,LIN H,ZHANG QQ,et al,2009.Physiological characteristics
(Continue on page 199)(Continue from page 252)
of leaf senescence in Shibataea chinensis after anthesis[J].J Nanjing For Univ:Nat Sci Ed,33(6):39-43. [谢寅峰,林侯,张千千,等,2009.鹅毛竹花后叶片衰老生理特性[J].南京林业大学学报ű自然科学版,33(6):39-43.]
YANG XT,ZHANG ZQ,PANG XQ,2005.Effect of chlorophyll deg-radation on post-harvest quality of fruits and vegetables[J].J Fruit Sci,22(6):691-696. [杨晓棠,张昭其,庞学群,2005.果蔬采后叶绿素降解与品质变化的关系[J].果树学报,22(6): 691-696.]
YI TP,SHI JY,MA LS,et al,2008.Bamboo flora of China illustra-tions[M].Beijing:Science Press:293. [易同培,史军义,马丽莎,等,2008.中国竹类图志[M].北京:科学出版社:293.]
YUAN QS,2007.Modern enzymology[M].Shanghai:East China U-niversity of Science and Technology Press:183. [袁勤生,2007.现代酶学[M].上海:华东理工大学出版社:183.]
ZHANG CX,XIE YF,DING YL.2003.The studies of leaf senescence of pseudosasa amabilis var.convexa during flowering and seeding stage[J].J Nanjing For Univ:Nat Sci Ed,27(2):59 -61. [张春霞,谢寅峰,丁雨龙,2003.福建茶杆竹开花结实期间的叶片衰老[J].南京林业大学学报ű自然科学版,27(2): 59-61.]
ZHANG Y,LIU QL,2003.Proceedings on molecular mechanism of plant flower development[J].Chin Bull Bot,20(5):589-601. [张云,刘青林,2003.植物花发育的分子机理研究进展[J].植物学通报,20(5):589-601.]
ZHONG XH,LUO XS,CHEN AH,1999.A study on nai plum’s flower bud differentiation and its major content of metabolic pro-duction[J].J Hunan Agric Univ,25(1):31-35. [钟晓红,罗先实,陈爱华,1999.李花芽分化与体内主要代谢产物含量的关系[J].湖南农业大学学报,25(1):31-35.]
ZHANG ZL,QU WJ,2003.Experimental guidance of plant physiology[M].Beijing:Higher Education Press. [张志良,瞿伟菁,2003.植物生理学实验指导[M].北京:高等教育出版社.]
Difference of some important metabolites of flowering and non-flowering Chimonobambusa opienensis
WANG Shuang-Yan1,LI Zhi-Hong2,YI Tong-Pei1,3,SHI Jun-Yi3,ZHEN Hua1∗
(1.Sichuan Agricultural University,Chengdu 611130,China;2.Sichuan Heizhugou National Nature Reserve Management Bureau,Leshan 614300,China;3.Flower Research and Development Center of Southwest China,Chinese Academy of Forestry,Kunming 650224,China)
Chimonobambusa opienensis belongs to Gramineae Bambusoideae,growing in E’bian,Mabian,Ganluo Coun-ties in Sichuan Province,distributed in the altitude 1 500-2 200 m,the total area 40 000 hm2.The death area of C.opienensis reached at 90 in different sections in E’bian from 2010 to 2013 which made great financial loss for the local famers and at the same time threat on wild pandas.The bamboo shoots are not only important sources of income for local farmer and industry,but also staple food for first-grade state protection animal,panda.Multiple biochemical inde-xes were measured and analyzed in flowering and non-flowering plants of C.opienensis.With the help of the difference re-search Chlorophyll contents(by Absorption Photometry),fat contents(by null method of measurement),soluble sugars, starch and cellulose contents(by phenol-sulfuric acid method),soluble protein contents(by Coomassie Brilliant Blue G-250 staining),peroxidase(POD)liveness(by guaiacol colorimetric method),super-oxide dismutase(SOD) liveness(by pyrogallol autoxidation method)were determined.The results showed that the chlorophyll contents in the leaf and secondary branch decline were respectively 14.42 and 71.39 (P<0.05);the oil contents in the secondary branch and bough dropped 20.93 and 26.04 (P<0.05);the contents of soluble protein in the leaf and secondary branch fell 30.07 and 37.31 (P<0.05);but the contents of soluble sugar in the leaf and secondary branch went up 21.04 and 17.81 ,starch rose 8.33 and 8.21 and cellulose increased by 17.62 and 8.52 (P<0.05);POD liveness in upper leaves went up 122.01 (P<0.05)in the flowering and non-flowering C.opienensis.The result illustra-ted that the blossoming of C.opienensis was associated with the change of organotrophy and biochemical indexes.The management control of bamboo growth in March could be realized by monitoring the chlorophyll contents in the leaf and secondary branch,the oil contents in the secondary branch and bough,the contents of soluble sugar,starch and cellu-lose in the leaf and secondary branch,the contents of soluble protein in the leaf and secondary branch and POD liveness in upper leaves.These would provide the references for further studying the C.opienensis flowering mechanism and post-pone the flowering date.
Chimonobambusa opienensis,bamboo flowering,organotrophy,biochemical indexes
Q946
A
1000-3142(2016)02-0246-07
10.11931/guihaia.gxzw201501002
王双燕,李志宏,易同培,等.三月竹开花前后几种重要代谢物差异研究[J].广西植物,2016,36(2):246-252
WANG SY,LI ZH,YI TP,et al.Difference of some important metabolites of flowering and non-flowering Chimonobambusa opienensis[J].Guihaia,2016,36(2):246-252
2015-04-26
2015-05-04
国家林业局大熊猫国际合作项目(2011-285);中国林业科学研究院西南花卉研究开发中心竹子专项(2014-003)[Supported by the State Forestry Administration Project for Panda Cooperation(2011-285);Chinese Academy of Forestry Special Fund for Banboo of Flower Research Center in Southwest China(2014-003)]。
王双燕(1988-),女,陕西西安人,硕士研究生,主要从事植物化学成分研究,(E-mail)1251654953@qq.com。
∗通讯作者:甄铧,教授,硕士生导师,主要从事植物化学成分研究,(E-mail)zhenhua@sicau.edu.cn。

