十万大山地区典型次生阔叶林土壤微生物数量及酶活性的季节动态
张德楠,徐广平,张中峰,曾丹娟,顾大形,周翠鸣,黄玉清,何成新
(广西喀斯特植物保育与恢复生态学重点实验室,广西壮族自治区中国科学院广西植物研究所,广西桂林541006)
十万大山地区典型次生阔叶林土壤微生物数量及酶活性的季节动态
张德楠,徐广平,张中峰,曾丹娟,顾大形,周翠鸣,黄玉清,何成新∗
(广西喀斯特植物保育与恢复生态学重点实验室,广西壮族自治区中国科学院广西植物研究所,广西桂林541006)
为了评价广西十万大山南麓次生阔叶林土壤质量的变化,该研究以广西十万大山南麓典型季雨林中的次生阔叶林土壤为对象,采用实地调查与实验分析相结合的方法,对其土壤微生物数量和土壤蔗糖酶、脲酶、磷酸酶、过氧化氢酶的季节动态规律进行研究。结果表明:土壤过氧化氢酶、脲酶、蔗糖酶和酸性磷酸酶在垂直分布上均表现为0~10 cm土层高于10~20、20~30 cm土层,差异显著(P<0.05);随季节性水热状况的变化,各种土壤酶活性有明显的季节性变化,其中0~10、10~20和20~30 cm土层中过氧化氢酶活性呈双峰模式,高峰出现在春季和秋季;土壤脲酶、酸性磷酸酶活性均呈单峰模式,高峰均出现在夏季;而蔗糖酶活性呈现秋季>夏季>春季>冬季趋势。土壤细菌、放线菌和真菌含量均随着土壤深度的增加而减小,差异显著(P< 0.05);细菌、放线菌和真菌数量的季节变化大小顺序呈夏季>秋季>春季>冬季的变化趋势。相对于旱季,在十万大山南麓地区,典型次生阔叶林土壤微生物数量及酶活性季节性变化对高温多降水的雨季响应更明显。关键词:土壤微生物数量,土壤酶活性,次生阔叶林,十万大山
土壤酶来源于土壤中的微生物、动物、植物根系分泌和动植物残体分解(Bandick&Dick,1999;Ba-diane et al,2001),通常被用来评价土壤质量变化的敏感指标(Jimenez et al,2002;Zimmermann&Frey,2002),与植被生长密切相关(关松荫,1986;周礼恺,1989;琳娜等,2010)。土壤酶是土壤生化过程的积极参与者和活动者,在森林生态系统的能量流动和物质循环过程中具有非常重要的作用(周礼恺,1989),森林有机物质转化所需能量的90%以上来自微生物的分解作用(Heal&Madean,1975),同时,土壤酶对于维系森林生态系统的能量流动、物质循环以及提高森林土壤肥力等方面也具有重要的促进作用(杨万勤等,2004);其中,土壤脲酶、蔗糖酶和酸性磷酸酶等水解性酶能够表征土壤C、N等养分的循环状况,而且土壤酶活性对森林生态系统的能量流动、物质转化及土壤肥力形成具有非常重要的作用,与土壤理化性质和环境条件密切相关。由于土壤酶对环境和管理因素引起的变化具有比较强的敏感性以及易于测定等优点,所以通常作为反映土壤质量较为理想的综合度量指标(Badiane et al,2001;Saviozzi et al,2001;Schloter et al,2003;曹慧等,2003)。
土壤酶活性和微生物数量共同影响土壤肥力、土壤养分、碳氮磷循环和森林植被类群,它们与季节性气候温度变化、植被类型和不同土壤层深度等因子密切相关。土壤微生物是陆地生态系统的主要调节者和分解者,参与生态系统的能量流动、物质循环及转化,是维护森林生态系统可持续发展的重要组成部分(Wardle et al,2004;Lou et al,2011),对动植物残体的分解发挥了重要作用,是植物养分转化、有机碳代谢、污染物降解的驱动力,在土壤的能量循环、养分转移以及运输中具有重要意义(王杏芬等,1998)。
广西十万大山是我国大陆最南的一座山系,地处云贵高原的东南部,为热带北缘和南亚热带交汇的中心地带。该地区气候温热,雨量充沛,具有热带季雨林特征,是广西南部地区主要的水源涵养林,十万大山地区也是我国16个生物多样性保护的热点地区之一。近几年,许多学者研究了广西十万大山地区的植物区系(和太平,2007)、特有珍惜濒危植物多样性(和太平等,2007)、外来物种入侵(韦原莲等,2006;叶铎等,2008),以及十万大山真菌垂直分布(吴兴亮等,2009)等,但对十万大山土壤微生物数量和土壤酶活性的研究很少见报道。我们前期研究结果表明,在广西十万大山地区不同植被类型间,次生阔叶林呈现了较高的土壤微生物活性特征(孙英杰等,2014,2015)。在全球气候变化背景下,受气温升高和雨水分配不均的影响,十万大山地区森林土壤微生物和酶活性均发生不同的变化。我们在不同季节调查了十万大山南麓典型次生阔叶林土壤,研究其土壤生物活性对水热季节变化的响应,探讨北热带广西十万大山地区典型次生林土壤酶活性和土壤微生物数量的季节特征,了解十万大山地区典型次生阔叶林土壤质量现状,对于合理利用林地土壤、防止地力衰退等具有重要意义,可为科学营林以及自然保护区建设提供科学依据。
1 材料与方法
1.1 研究区概况
广西十万大山自然保护区位于广西壮族自治区防城港市的上思县与防城区交界处,地处中越边境地区,濒临北部湾,东西最长74.41 km,南北最宽45 km,总面积58 277.1 hm2,边界总长度达352.7 km。研究区域选择在防城港市的广西防城金花茶国家级自然保护区境内,位于108°07′04″~108°07′25″E、21°45′04″~21°45′15″N,总面积9 195.l hm2,其中核心区、缓冲区和实验区分别为729.4、4 139.5和 4 326.2 hm2;地处十万大山南面的蓝山支脉,有山地、丘陵等不同地貌类型,属北热带季风气候区域,年日照较高,时数为1 525 h,年均气温21.9℃,年均降雨量在2 900 mm以上;地带性土壤有红壤、砖红壤及黄壤,主要成土母岩有花岗岩、砂岩和页岩;其中海拔300 m以下为砖红壤,300~800 m为山地红壤,800 m及以上为山地黄壤(黄瑞斌等,2007)。保护区内,地带性植被为北热带常绿季雨林,森林植被物种繁多,以大戟科(Euphorbiaceae)、橄榄科(Burseraceae)、桑科(Moraceae)等热带适应性较强的科属为主(韦霄等,2008)。研究区土壤背景值特征见表1。
长时间的人为干扰导致该区域原生林退化较严重,天然植被大部分为次生阔叶林及灌草丛,而人工林植被面积虽大却多呈镶嵌状分布。本实验研究的取样区土壤为砖红壤,次生阔叶林主要由大棋子豆(Archidendron eberhardtii)、紫荆木(Madhuca pasqui-eri)、血胶树(Eberhardtia aurata)、米老排(Mytilaria laosensis)等组成。人工林为肉桂(Cinnamomum cas-sia)林、马尾松(Pinus massonian)林、杉木(Cunning-hamia lanceolata)林、八角(Illicium verum)林等;灌草丛则由桃金娘(Rhodomyrtus tomentosa)、毛秆野古草(Arundinella hirta)、铁芒箕(Dicranopteris dichotoma)等小半灌木及一年或多年生草本植物组成。
1.2 试验方法
在野外详细踏查的基础上,选择防城典型实验区域内次生阔叶林作为取样点,于冬季(2012年1 月)、春季(2012年4月)、夏季(2012年7月)和秋季(2012年10月),设置3块海拔、坡向和坡度相近的样地作为重复,每个样地面积约20 m×20 m,在样地内按照“S”形选取5个代表性的样点,用土钻分层(0~10、10~20、20~30 cm)采集土壤样品,同时,在这5个样点的不同分层中用铝盒采集一份土样用于测定土壤含水量;5个等层次混匀为1个混合样,用无菌保鲜袋包好,并做好标记,用保温密封瓶封装后带回室内实验室处理;将取回的土样分成两部分,一部分置于室内自然风干后过筛用于土壤酶活性、土壤养分的测定;另一部分则保存于4℃冰箱中以备土壤微生物数量的测定。
土壤有机碳(SOC)测定利用TOC仪进行(岛津5000A,日本),土壤全氮(TN)、全磷(TP)和全钾(TK)的含量分别采用Vario EL III元素分析仪(德国)、浓硫酸-高氯酸消煮钼锑抗比色法(Agilent 8453紫外-可见分光光度计,美国)和火焰分光光度法进行测定;速效氮(AN)、速效磷(AP)和速效钾(AK)分别采用碱解扩散法、碳酸氢钠浸提-钼锑抗比色法和乙酸铵浸提-原子吸收法(鲁如坤,1999)。
土壤含水量测定采用烘干法(张晓虎&李新平,2008)进行测定。土壤微生物数量依照«土壤微生物分析方法手册»(许光辉&郑洪元,1986)进行测定,通过稀释平板计数法进行真菌、细菌、放线菌数量的测定,培养基分别为马丁(Martin)孟加拉红-链霉素(链霉素30 mgűL-1)培养基、牛肉膏蛋白胨培养基、改良高氏一号(苯酚500 mgűL-1)培养基。计算方法如下:每克土壤样品的菌数=同一稀释度N次重复的菌落平均数×稀释倍数。
土壤脲酶活性、磷酸酶活性、过氧化氢酶活、蔗糖酶活性性分别用靛酚蓝比色法、磷酸苯二钠比色法、高锰酸钾滴定法、硫代硫酸钠滴定法进行测定(关松荫,1986)。
1.3 数据分析
利用SPSS 19.0软件进行单因子方差分析(One way ANOVA),利用Excel 2010制作图表。
2 结果与分析
2.1 土壤含水量的季节变化
由表2可知,土壤含水量因季节和土层深度而异。其中,土壤含水量在0~10、10~20和20~30 cm土层中含量最大值均出现在夏季,夏季高温多雨是出现这样结果的主要原因;随秋季的到来,土壤中水分含量在这3个土层中逐渐减少,秋季次之,春季更甚,冬季最少;0~10 cm土壤含水量最高,不同季节之间土壤含水量差异显著(P<0.05);随土层深度的增加,土壤含水量呈递减趋势。
2.2 次生阔叶林土壤酶活性的季节变化
由图1:A,B,C,D可知,0~10 cm的过氧化氢酶、脲酶、蔗糖酶和酸性磷酸酶活性显著高于10~20 和20~30 cm。各土壤酶活性的季节变化明显,其中,0~10、10~20和20~30 cm的过氧化氢酶活性呈双峰模式,大峰值均出现在春季,而在秋季出现另一个小高峰,且不同层次过氧化氢酶活性的季节变化规律一致,春季>秋季>冬季>夏季(图1:A);0~10、10~20和20~30 cm的脲酶和酸性磷酸酶活性呈单峰模式特征,高峰均出现在夏季,0~10 cm脲酶和酸性磷酸酶活性显著高于10~20和20~30 cm,且各层次的酶活性变化规律相近,表现为夏季>秋季>春季>冬季(图1:B),酸性磷酸酶活性呈现出夏季>春季>秋季>冬季(图1:D);蔗糖酶活性呈现出由冬-春-夏-秋呈现出逐级递增趋势,各土层高峰出现在秋季(2012年10月),各层次土壤蔗糖酶活性差异显著(P<0.05)(图1:C)。

表1 样地土壤特征(平均值±标准偏差)Table 1 Soil properties of experiment plots(mean±SD)
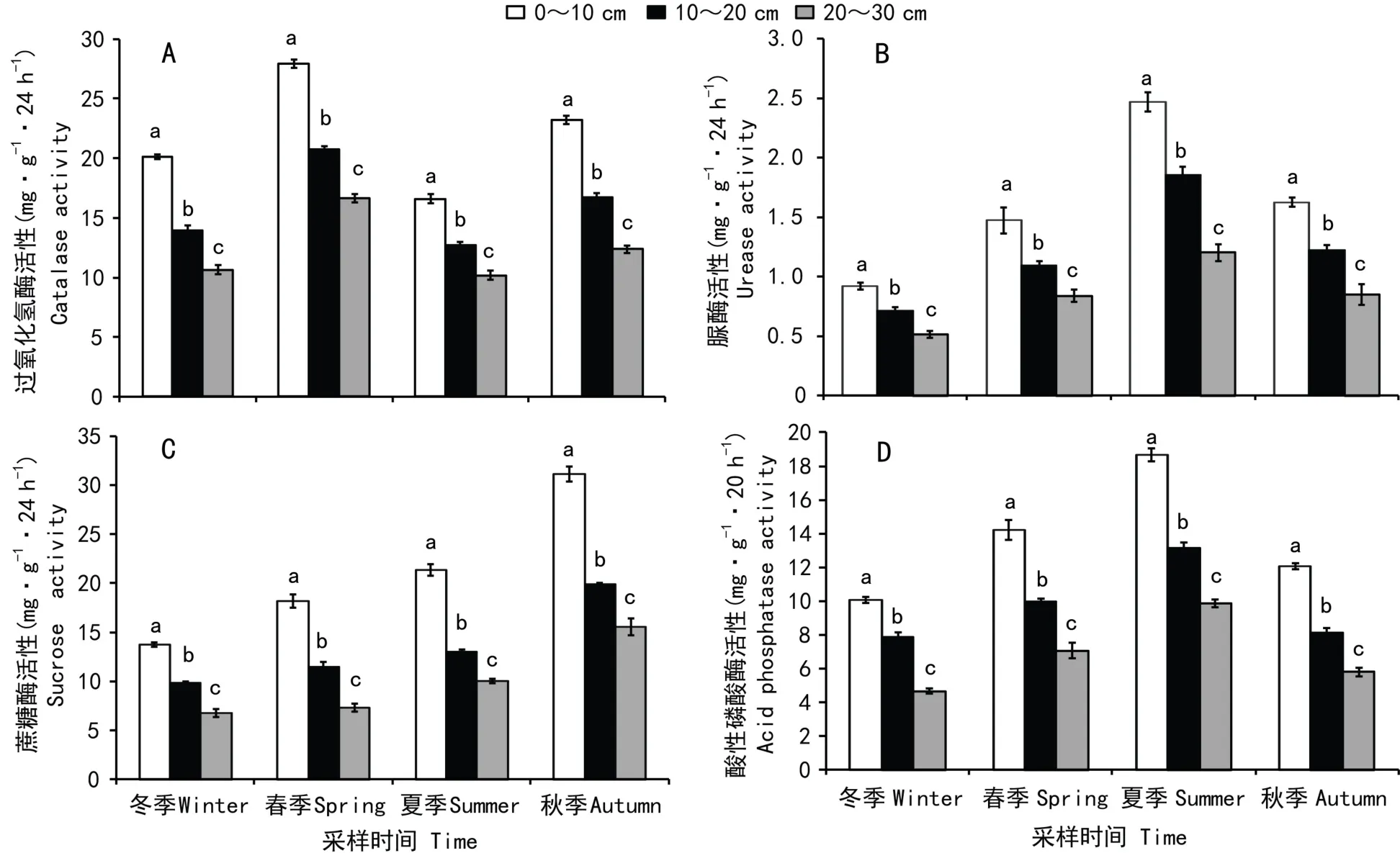
图1 不同土层深度土壤酶活性的季节变化 不同字母表示有显著差异(P<0.05)。Fig.1 Seasonal dynamics of soil enzyme activities in different soil depths Different letters above the columns indicate significant differences among three groups(P<0.05).
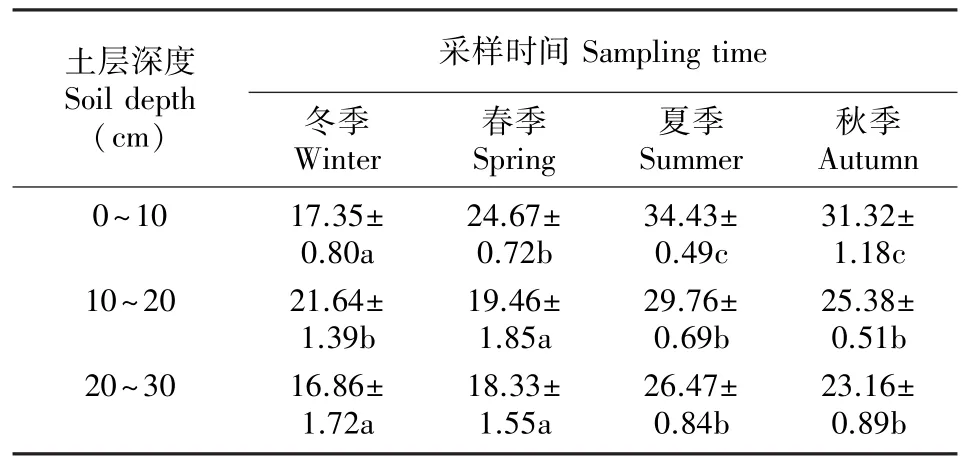
表2 样地土壤含水量(平均值±标准偏差,%)Table 2 Soil moisture contents of experiment plots(mean±SD,%)
2.3 次生阔叶林土壤微生物数量的季节变化
由表3可知,土壤中微生物数量因季节和土层深度而异。其中,细菌、放线菌和真菌在0~10、10~ 20和20~30 cm土层中含量的最大值均出现在夏季,其可能的原因是夏季高温潮湿为微生物快速生长提供了有利的温湿条件,随着秋冬季到来,温度和湿度的逐渐减低,土壤微生物数量随之减少,秋季次之,春季更甚,冬季最少;0~10 cm土壤微生物数量最高,因表层土壤中含有大量凋落物分解的有机质、丰富的无机物环境、水环境、氧气和热量,为微生物的生长提供了充足的能量供给,随着土层加深土壤微生物数量逐渐减少,其原因可能是由于土层越深,适宜微生物生长和繁殖的条件变得越来越苛刻,不利于微生物生长;土壤微生物数量在不同深度的土层中含量除冬季采集的0~10和10~20 cm土壤中细菌含量无差异外,其他时间段采集的土壤,不同土层土壤细菌含量均差异显著(P<0.05),在土壤微生物数量最高的夏季,0~10 cm土层细菌含量分别是10~20、20~30 cm的1.45倍和2.59倍;放线菌在不同土层中含量除冬季采集的0~10、10~20 cm和春季采集的10~20、20~30 cm无差异外,其他采样时间段不同土层放线菌含量两两之间差异性显著,0~ 10 cm土层放线菌含量分别为10~20、20~30 cm的1.91倍和3.04倍;土壤中真菌含量表现出与放线菌含量相似的特点,其中,0~10 cm土层分别为10~ 20、20~30 cm的2.41倍和2.89倍。

表3 不同土层深度土壤微生物数量季节变化Table 3 Seasonal dynamics of the number of soil microorganism in different soil depths
2.4 土壤酶活性和土壤化学性质的相关性
表1中样地土壤特征结果表明:土壤有机碳、全氮、全磷、全钾、速效氮、速效磷和速效钾均在0~10 cm土层含量最大,10~20 cm次之,20~30 cm最小,充足的养分为植被的生长繁衍提供了条件;土壤中复杂的生物化学反应和物质循环,包括土壤养分转化需要土壤酶的参与(宋海燕等,2007)。
相关分析结果表明(表4),脲酶与蔗糖酶的活性与土壤有机碳、全氮、全磷、全钾、速效氮、速效磷和速效钾呈显著正相关;酸性磷酸酶及过氧化氢酶活性与土壤有机碳、全氮、全磷、全钾、速效氮、速效磷和速效钾呈极显著正相关;脲酶、蔗糖酶、酸性磷酸酶和过氧化氢酶活性与土壤养分指标均有较强的相关性,因此,它们可作为评价土壤质量的生物学指标(Puglisi et al,2006)。
2.5 土壤微生物数量与土壤化学性质的相关性
从表5可知,土壤中放线菌数量与土壤有机碳、全磷、全钾、速效氮、速效磷以及速效钾呈显著正相关关系,说明放线菌在样地土壤养分变化中起着积极重要作用;而细菌及真菌与土壤有机碳、全氮、全磷、全钾、速效氮、速效磷和速效钾存在一定的相关性,但相关性不明显。
2.6 土壤微生物数量和土壤酶活性的相关性
相关性分析表明(表6),土壤脲酶及酸性磷酸酶活性都与细菌、放线菌、真菌数量呈极显著正相关,说明脲酶及酸性磷酸酶活性越强细菌、放线菌、真菌数量越多;另外,蔗糖酶活性与细菌、放线菌、真菌数量呈显著正相关关系,说明蔗糖酶活性的强弱影响细菌、放线菌、真菌数量的增减;而过氧化氢酶活性与细菌、放线菌、真菌数量未表现出相关性,说明过氧化氢酶活性的强弱对细菌、放线菌、真菌数量多少影响不明显。
3 讨论与结论
3.1 次生阔叶林土壤酶活性
本研究结果表明,广西十万大山地区典型次生阔叶林土壤过氧化氢酶、脲酶、蔗糖酶和酸性磷酸酶活性均随土壤层次深度的增加而显著降低,这与Garca-Gil et al(2000),Taylor et al(2002)和宋学贵等(2009)的研究结果相似,即在未受到扰动的生态系统中,土壤酶活性随土壤深度增加而降低,与我们在广西十万大山地区不同植被类型间的相关研究结果相一致(孙英杰等,2014)。其原因是土壤上层(0~10 cm)覆盖有大量凋落物,凋落物能涵养大量水分且通气性良好,其分解形成的大量碳及营养元素能使上层土壤具有良好的理化性质(表1),而中层(10~20 cm)、下层(20~30 cm)则逐渐减小。

表4 土壤酶活性与土壤化学性质之间的相关系数Table 4 Correlation coefficients among soil enzyme activities,soil chemical properties(n=12)

表5 土壤微生物数量与土壤化学性质之间的相关系数Table 5 Correlation coefficients among soil microbe,soil chemical properties(n=12)

表6 土壤微生物数量与土壤酶活性的相关系数Table 6 The correlation coefficients among soil microbe,soil enzyme activities(n=12)
本研究中,十万大山地区典型次生阔叶林各种土壤酶活性的季节变化明显,但变化趋势却有各自的特点。其中,土壤过氧化氢酶活性春季均最高、秋季次之,这与宋学贵等(2009)在川南研究结果并不一致,而与杨万勤等(1999)在缙云山的研究结果基本相同,其原因可能是植物群落物种组成差异性和气候差异性所致。蔗糖酶活性最大值均出现在秋季,夏季次之,其可能的原因是十万大山属北热带季风气候区,夏秋季节高温,植物快速生长,植物根系和土壤微生物活性依然强劲,从而蔗糖酶活性保持在最高位;土壤脲酶活性表现出夏季最高、秋季次之的特点,其原因可能是夏秋季节交替,部分次生阔叶林开始有落叶,增强了与土壤脲酶分泌有关的微生物活性;土壤酸性磷酸酶活性表现出夏季最高、春季次之、冬季最低的特征。本研究表明,夏季土壤水热充足,微生物大量繁殖,有利于酶活性的提高。土壤酶活性高峰主要出现在温度、湿度较高的季节,与森林土壤理化性质、土壤微生物数量和植物多样性等密切相关,这与其他研究结果相类似(Sinsabaugh et al,1993;Burger&Kelting,1999;Criquet et al,2000)。
3.2 次生阔叶林土壤微生物数量
十万大山地区典型次生阔叶林土壤细菌、放线菌和真菌含量集中在表层土(0~10 cm),并随土层深度增加而减少(表3),这与刘爽和王传宽(2010)、李灵等(2007)对阔叶林和黄宗胜等(2012)的研究结果类似,也与我们在广西十万大山地区不同植被类型间的相关研究结果相一致(孙英杰等,2014,2015)。土壤微生物数量的空间变异是生态系统特性和环境因子综合作用的结果,而林型是重要影响因素之一,土壤微生物数量与林型中的凋落物数量和组成有关,凋落物的数量和质量通过影响微生物的分解底物及其分解难易程度影响微生物的生长和繁殖(Wardle et al,1992;Scheu&Parkinson,1995)。
在十万大山地区,4-9月间降雨量占年降雨量的75%,雨季恰好与热季重叠(韦振锋等,2013)。本研究中,土壤微生物中细菌数量占绝对优势,放线菌次之,真菌最少,说明十万大山地区典型次生阔叶林土壤细菌的繁殖力、竞争力、土壤养分转化能力较强,放线菌与真菌虽然数量上不及细菌,但其绝对数量也较多,对于物质循环和系统稳定具有重要的促进作用。土壤中的细菌、放线菌和真菌含量季节变化的特征一致,表现为夏季>秋季>春季>冬季,对土壤水分含量变化比较敏感,这与土壤含水量的季节变化相一致,说明季节变化对土壤微生物的数量有一定影响(李梓正等,2010),其原因与地处北热带季风气候的十万大山夏季高温多雨更适合微生物生长有关,这与Devi&Yadava(2006)的研究结果一致;秋季大量凋落物输入为微生物的生长提供了大量底物,利于微生物生长;冬季温度相对较低,一定程度上抑制微生物的生长繁殖,导致微生物数量急剧下降;待翌年春季到来,气温逐渐升高,气候回暖土壤微生物的活性逐渐增强,土壤中微生物含量增加。
广西十万大山地区是典型次生阔叶林,土壤具有较高的土壤微生物数量和土壤酶活性,有利于碳氮磷转化和提高土壤质量;同时,典型次生阔叶林土壤微生物数量和土壤酶活性存在显著的季节变化格局,与水热等环境因子密切相关,温度和季节性降雨可能是主要的驱动因素。相对于旱季,在十万大山南麓地区,典型次生阔叶林土壤微生物数量及酶活性季节性变化对高温多降水的雨季响应更明显。由于次生阔叶林物种组成和群落结构的不同导致凋落物分解的差异,引起土壤微生物的群落组成、结构及土壤酶活性发生变化,进而影响土壤中微生物数量和土壤酶活性波动,将来应减少对保护区植被的人为干扰活动,而随着不同演替阶段,土壤微生物数量,土壤酶活性,土壤微生物群落功能多样性等变化特征,及其与土壤养分的耦合关系等,还有待进一步深入研究。
致谢 感谢广西防城金花茶国家级自然保护区管理处吴儒华、潘子平等同志给予的工作协助。参考文献:
BADIANE NNY,CHOTTE JI,PATE E,et al,2001.Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semi-arid tropical regions[J].Appl Soil Ecol,18: 229-238.
BANDICK AK,DICK RP,1999.Field management effects on soil enzyme activities[J].Soil Biol Biochem,31:1 471-1 479.
BURGER JA,KELTING DL,1999.Using soil quality indicators to assess forest stand management[J].For Ecol Manag,122: 155-166.
CAO H,SUN H,YANG H,et al,2003.A Reviewsoil enzyme activity and its indication for soil quality[J].Chin J Appl Envi-ron Biol,9(1):105-109. [曹慧,孙辉,杨浩,等,2003.土壤酶活性及其对土壤质量的指示研究进展[J].应用与环境生物学报,9(1):105-109.]
CRIQUET S,FARNET AM,TAGGER S,et al,2000.Annual vari- ations of phenol oxidase activities in an evergreen oak litter in fluency of certain biotic and abiotic factors[J].Soil Biol Bio-chem,32:1 505-1 513.
DEVI NB,YADAVA PS,2006.Seasonal dynamics in soil microbial biomass C,N and P in a mixed-oak forest ecosystem of Manipur,North-east India[J].Appl Soil Ecol,31(3):220-227.
GARCA-GILL JC,PLAZA C,SOLWE-ROVIRA P,et al,2000. Long-term effects of municipal solid waste compost application on soil enzyme activities and microbial biomass[J].Soil Biol Biochem,32:1 907-1 913.
GUAN SY,1986.Soil Enzyme and its research methods[M].Bei-jing:Agricultural Press. [关松荫,1986.土壤酶及其研究方法[M].北京:农业出版社.]
HE TP,TAN WF,WEN YG,et al,2007.Diversity of rare and endan-gered plants in Shiwandashan Mountain National Natural Reserve [J].J Guangxi Agric Biol Sci,26(2):125-131. [和太平,谭伟福,温远光,等,2007.十万大山国家级自然保护区珍惜濒危植物的多样性[J].广西农业生物科学,26(2):125-131.]
HE TP,2007.Research on plant flora of Shiwandashan Mountain National Natural Reserve in Guangxi[J].J NW A&F Univ: Nat Sci Ed,35(7):75-89. [和太平,2007.广西十万大山国家级自然保护区植物区系研究[J].西北农林科技大学学报ű自然科学版,35(7):75-89.]
HEAL OW,MADEAN SF,1975.Comparative productivity in eco-system-secondaryproductivity[M]//VAN DOBBEN WH,MEL-ON NELL PHL.Unifying concepts in ecology.Hague:The Hague Holland Press House:89-108.
HUANG RB,HE TP,ZHUANG J,et al,2007.Plant resource and it’s conservational countermeasure of sect.Chrysantha Chang in Fangchenggang[J].J Guangxi Agric Biol Sci,26(Suppl):32-37. [黄瑞斌,和太平,庄嘉,等,2007.广西防城港市金花茶组植物资源及其保育对策[J].广西农业生物科学,26(增刊):32-37.]
HUANG ZS,FU YH,YU LF,et al,2012.Characteristics of soil mi-crobial biomass carbon and soil water soluble organic carbon in the process of natural restoration of karst forest[J].Chin J Appl Ecol,23(10):2 715-2 720. [黄宗胜,符裕红,喻理飞,等,2012.喀斯特森林自然恢复中土壤微生物生物量碳与水溶性有机碳特征[J].应用生态学报,23(10):2 715-2 720.]
IPCC(Intergovernmental Panel on Climate Change),2007.Climate Change:summary for policymakers[C].Valencia,Spain.
JIMENEZ MP,HORRA AM,PRUZZO L,et al,2002.Soil quality A new index based on microbiological and biochemical parameters [J].Biol Fert Soil,35:302-306.
LI L,ZHANG Y,WANG LB,et al,2007.Vertical changes of the soil microbial biomass and the correlation analysis in different forests[J].J Centr S Univ For&Technol,27(2):52-60. [李灵,张玉,王利宝,等,2007.不同林地土壤微生物生物量垂直分布及其相关性分析[J].中南林业科技大学学报,27 (2):52-60.]
LI ZZ,ZHU FB,LIN YC,et al,2010.Seasonal variation of soil bacterial community under different degrees of degradation of Hulunbuir grassland[J].Acta Ecol Sin,30(11):2 883-2 889. [李梓正,朱立博,林叶春,等,2010.呼伦贝尔草原不同退化梯度土壤细菌多样性季节变化[J].生态学报,30 (11):2 883-2 889.]
LIN N,LIU Y,LI GL,et al,2010.Reserch progress on forest soil enzyme[J].World For Res,23(4):21-25. [林娜,刘勇,李国雷,等,2010.森林土壤酶研究进展[J].世界林业研究,23 (4):21-25.]
LIU S,WANG CK,2010.Spatio-temporal patterns of soil microbial biomass carbon and nitrogen in five temperate forest ecosystems [J].Acta Ecol Sin,30(12):3 135-3 143. [刘爽,王传宽,2010.五种温带森林土壤微生物生物量碳氮的时空格局[J].生态学报,30(12):3 135-3 143.]
LOU YL,LIANG WJ,XU MG,et al,2011.Straw coverage alleviates seasonal variability of the topsoil microbial biomass and activity [J].Catena,86(2):117-120.
LU RK,1999.The analysis method of soil agricultural chemistry [M].Beijing:Chinese Agricultural Science and Technology Press. [鲁如坤,1999.土壤农业化学分析方法[M].北京:中国农业科技出版社.]
PUGLISI E,DEL AM,RAO MA,et al,2006.Development and vali-dation of numerical indexes integrating enzyme activities of soils [J].Soil Biol Biochem,38:1 673-1 681.
SAVIOZZI A,LEVI-MINZI R,CARDELLI R,et al,2001.A com-parison of soil quality in adjacent cultivated,forest and native grassland soils[J].Plant Soil,233(2):251-259.
SCHEU S,PARKINSON D,1995.Successional changes in microbi-albiomass,respiration and nutrient status during litter decompo-sition in an aspen and pine forest[J].Biol Fert Soils,19(4): 337-332.
SCHLOTER M,DILLY O,MUNCH JC,2003.Indicators for evaluating soil quality[J].Agric Ecosyst Environ,98(1-3):255-262.
SINSABAUGH RL,ANTIBUS RK,LINKINS AE,et al,1993.Wood decomposition:nitrogen and phosphorus dynamics in relation to extracellular enzyme activity[J].Ecology,74:1 586-1 593.
SONG HY,LI CR,XU JW,et al,2007.Correlations of soil enzyme activity and microbes,nutrients in soil of jujube orchard in coastal saline land[J].Sci Silv Sin,43(10):28-32. [宋海燕,李传荣,许景伟,等,2007.滨海盐碱地枣园土壤酶活性与土壤养分、微生物的关系[J].林业科学,43(10):28-32.]
SONG XG,HU TX,XIAN JR,et al,2009.Soil enzyme activities and its response to simulated nitrogen deposition in an evergreen broad-leaved forest,southern Sichuan[J].Acta Ecol Sin,29 (3):1 234-1 340. [宋学贵,胡庭兴,鲜骏仁,等,2009.川南天然常绿阔叶林土壤酶活性特征及其对模拟N沉降的响应[J].生态学报,29(3):1 234-1 340.]
SUN YJ,HE CX,XU GP,et al,2014.Soil enzyme activities among different vegetation types in the south of shiwan mountain,Guangxi[J].Chin Agric Sci Bull,30(31):33-40. [孙英杰,何成新,徐广平,等,2014.广西十万大山南麓不同植被类型土壤酶活性[J].中国农学通报,30(31):33-40.]
SUN YJ,HE CX,XU GP,et al,2015.Soil microbial properties under different vegetation types in shiwan mountain,Guangxi [J].Chin J Ecol,34(2):352-359. [孙英杰,何成新,徐广平,等,2015.广西十万大山地区不同植被类型土壤微生物特征[J].生态学杂志,34(2):352-359.]
TAYLOR JP,WILSON B,MILLS MS,et al,2002.Comparison of microbial numbers and enzymatic activities in surface soils and subsoil’s using various techniques[J].Soil Biol Biochem,34: 387-401.
WANG XF,LI SY,BAI KZ,et al,1998.Influence of doubled CO2on plant growth and soil microbial biomass C and N[J].Acta Bot Sin,40(12):1 169-1 172. [汪杏芬,李世仪,白克智,等,1998.CO2倍增对植物生长和土壤微生物生物量碳、氮的影响[J].植物学报,40(12):1 169-1 172.]
WARDLE DA,BARDGETT RD,KLIRONOMOS JN,et al,2004.Ecological linkages between aboveground and belowground biota[J].Science,304(5 677):1 629-1 633.
WARDLE DA,1992.A comparative assessment of factors which in-fluence microbial biomass carbon and nitrogen levels in soil [J].Biol Rev,67(3):321-358.
WEI X,JIANG YS,TANG H,et al,2008.Phytocoenological feature of the rare and endangered plant Camellia nitidissima [J].Guihaia,28(2):183-190. [韦霄,蒋运生,唐辉,等,2008.珍稀濒危植物金花茶的群落学特征[J].广西植物,28(2):183-190.]
WEI YL,YE D,WEN YG,et al,2006.Invasive plant species in Shi-wandashan Mountain National Natural Reserve,Guangxi,China [J].Chin For Sci Technol,20(6):23-26. [韦原莲,叶铎,温远光,等,2006.广西十万大山自然保护区外来入侵植物研究[J].林业科技开发,20(6):23-26.]
WEI ZF,REN ZY,ZHANG C,2013.Research on vegetation re-sponse to temperature and precipitation in Guangxi in recent 12 years[J].Res Soil Wat Cons,20(5):33-44. [韦振峰,任志远,张翀,2013.近12年广西植被覆盖与降水和气温的时空响应特征[J].水土保持研究,20(5):33-44.]
WU XL,LI TH,TAN WF,et al,2009.The vertical zones of macro fungi in the Shiwandashan Nature Reserve of Guangxi,China [J].Guizhou Sci,27(1):22-25. [吴兴亮,李泰辉,谭伟福,等,2009.广西十万大山国家级自然保护区大型真菌垂直分布[J].贵州科学,27(1):22-25.]
XU GH,ZHENG HY,1986.Handbook of soil microbiology analysis method[M].Beijing:Agriculture Press. [许光辉,郑洪元,1986.土壤微生物分析方法手册[M].北京:农业出版社.]
YANG WQ,WANG KY,2004.Advances in forest soil enzymology [J].Sci Sil Sin,40(2):152-159. [杨万勤,王开运,2004.森林土壤酶的研究进展[J].林业科学,40(2):152-159.]
YANG WQ,ZHONG ZC,HAN YP,1999.Study on the distribution characteristics and seasonal dynamics of forest soil enzymatic ac-tivities and its relations with Gordonia Acuminate on Mt.Jinyun [J].J SW Chin Norm Univ:Nat Sci Ed,24(3):318-324. [杨万勤,钟章成,韩玉萍,1999.缙云山森林土壤酶活性的分布特征、季节动态及其与四川大头茶的关系研究[J].西南师范大学学报ű自然科学版,24(3):318-324.]
YE D,LI XK,WEN YG,et al,2008.Alien plant species in Shiwan-dashan Mountain Natural Reserve,Guangxi,China[J].J Guangxi Agric Biol Sci,27(4):445-450. [叶铎,李先琨,温远光,等,2008.广西十万大山自然保护区外来植物的初步研究[J].广西农业生物科学,27(4):445-450.]
ZHANG XH,LI XP,2008.Research progress in determination methods of several common soil water content[J].Shaanxi J Agric Sci,(6):114-117. [张晓虎,李新平,2008.几种常用土壤含水量测定方法的研究进展[J].陕西农林科学,(6):114-117.]
ZHOU LK,1989.Soil Enzymology[M]:Beijing:Science Press. [周礼恺,1989.土壤酶学[M]:北京:科学出版社.]
ZIMMERMANN S,FREY B,2002.Soil respiration and microbial properties in an acid forest soil[J].E Wood Ash Soil Biol Bio-chem,34:1 727-1 737.
Seasonal dynamics of soil enzymes and microbial activities in a typical secondary broad-leaved forest at Shiwan Mountain,South China
ZHANG De-Nan,XU Guang-Ping,ZHANG Zhong-Feng,ZENG Dan-Juan,GU Da-Xing,ZHOU Cui-Ming,HUANG Yu-Qing,HE Cheng-Xin∗
(Guangxi Key Laboratory of Plant Conservation and Restoration Ecology in Karst Terrain,Guangxi Institute of Botany,Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences,Guilin 541006,China)
Soil enzyme and microbial activities regulate organic matter decomposition and nutrient release,which in turn control nutrient status of forest soils.We conducted field survey and complimentary laboratory analysis of soils of a sec-ondary broad-leaved forest in Shiwan Mountain,Guangxi,China,in 2012.We quantified soil urease,sucrose,acid phosphatase and catalase activities and assessed bacterial,actinomycetes and fungal community in 0-10,10-20 and 20-30 cm soil layers.We also determined moisture contents of these soils.Soil enzyme activities of catalase,urease,su-crase and acid phosphatase were significantly higher(P<0.05)in 0-10 cm soil than those in 10-20 cm and 20-30 cm soils.We found two peaks of catalase activities,in spring and in autumn at all three depths.In contrast,urease and su-crase activities showed one peak in summer at all depths.Activities of acid phosphatase followed a decreasing trend from autumn to winter:autumn>summer>spring>winter.Bacteria,actinomycetes and fungi decreased significantly(P<0.05) with increasing soil depth and their activities decreased from summer to winter as follows summer>autumn>spring> winter.Seasonal changes in rainfall and soil moisture were attributable to the changes in soil enzyme and microbial activi-ties in this forest.
soil microorganism,soil enzyme,secondary broad-leaved forest,Shiwan Mountain
Q948.113,Q142.3
A
1000-3142(2016)02-0200-08
10.11931/guihaia.gxzw201410034
张德楠,徐广平,张中峰,等.十万大山地区典型次生阔叶林土壤微生物数量及酶活性的季节动态[J].广西植物,2016,36(2):200-207
ZHANG DN,XU GP,ZHANG ZF,et al.Seasonal dynamics of soil enzymes and microbial activities in a typical secondary broad-leaved forest at Shiwan Mountain,South China[J].Guihaia,2016,36(2):200-207
2014-10-21
2015-05-19
广西自然科学基金(2010GXNSFE013002;2012GXNSFBA053074);中国科学院“西部之光”人才培养计划项目(科发人教字[2011]180 号);广西植物研究所基本业务费(桂植业11001);国家自然科学基金(41361057) [Supported by the Natural Science Foundation of Guangxi (2010GXNSFE013002;2012GXNSFBA053074);West Light Foundation of the Chinese Academy of Science([2011]180);Science Research Foundation of Guangxi Insititute of Botany(11001);National Natural Science Foundation of China(41361057)]。
张德楠(1984-),研习员,主要从事植物生态学研究,(E-mail)denanzhang@126.com。
∗通讯作者:何成新,研究员,主要从事植物生态学研究,(E-mail)hecx@gxib.cn。

