猪繁殖与呼吸综合征病毒CD163受体功能域鉴定
曹宗喜,焦培荣,林哲敏,亓文宝,张桂红*(.海南省农业科学院畜牧兽医研究所海南省热带动物繁育与疫病研究重点实验室,海口 5700;.华南农业大学农业部兽用疫苗创制重点实验室,广州 5064)
猪繁殖与呼吸综合征病毒CD163受体功能域鉴定
曹宗喜1,2,焦培荣2,林哲敏1,亓文宝2,张桂红2*
(1.海南省农业科学院畜牧兽医研究所海南省热带动物繁育与疫病研究重点实验室,海口571100;2.华南农业大学农业部兽用疫苗创制重点实验室,广州510642)
摘要:猪繁殖与呼吸综合征是危害养猪业重要传染病之一,CD163是猪繁殖与呼吸综合征病毒(PRRSV)感染易感细胞受体。研究表明CD163受体的前2个SRCR区域与PRRSV感染无关。为确定PRRSV感染细胞过程中CD163受体关键SRCR区域,构建表达野生型CD163受体和缺失不同个数SRCR区域的CD163受体突变体质粒。将质粒转染BHK-21细胞24 h后,XH-GD株PRRSV感染细胞,进行间接免疫荧光(IFA)观察。结果显示,CD163前4个SRCR重复区缺失不影响PRRSV感染,SRCR5是PRRSV感染细胞所必须。为进一步研究CD163受体在PRRSV感染Marc-145细胞过程中的作用及与其他受体之间相互关系提供试验基础。
关键词:猪繁殖与呼吸综合征病毒;Marc-145细胞;CD163;功能域;鉴定
曹宗喜,焦培荣,林哲敏,等.猪繁殖与呼吸综合征病毒CD163受体功能域鉴定[J].东北农业大学学报,2016,47(3):23-30.
Cao Zongxi,Jiao Peirong,Lin Zhemin,et al.Identification of the CD163 receptor domains related to porcine reproductive and respiratory syndrome virus infection[J].Journal of Northeast Agricultural University,2016,47(3):23-30.(in Chinese with English abstract)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome Virus,PRRSV)感染所致的急性传染病。该病以妊娠母猪流产、死产、弱胎、木乃伊胎等繁殖障碍、各年龄阶段猪呼吸道症状、哺乳仔猪高死亡率、免疫抑制和持续性感染等为主要特征[1],高致病性PRRSV 2006年在我国首次出现[2-3],其致病能力显著增强。
PRRSV通过结合细胞受体感染易感细胞,CD163是猪繁殖与呼吸综合征病毒感染易感细胞受体之一。Calvert等研究表明前2个SRCR区缺失对CD163受体的功能无影响[4]。Van Gorp等利用CD163-L1(与CD163同属于清道夫受体超家族B群,且与CD163结构相似,但在PRRSV病毒复制过程中不发挥受体作用)相关区域对CD163嵌合突变发现,SRCR5是CD163与PRRSV相互作用关键功能域[5]。冯亚琼等通过特异性抗体封闭PAM细胞上清道夫受体CD163不同的结构域,用PRRSV处理已封闭的PAM细胞,CD163的SRCR5-6区在PRRSV或感染性免疫复合物感染宿主细胞过程中发挥作用[6-7]。本研究以Marc-145细胞的CD163基因为研究对象,通过构建缺失不同SRCR区的CD163表达质粒,确定CD163有效功能域,为进一步阐明病毒吸附与内化机制及受体蛋白与病毒结合的功能表位,CD163受体与其他受体的协同作用,全方位揭示PRRSV的分子致病机理奠定基础。
1 材料与方法
1.1材料
pcDNA3.1-Myc-His、TRIzol Reagent和Lipofectamine 2000购自Invitrogen公司;THUNDERBIRD SYBR qPCR Mix购自TOYOBO公司;T4DNA连接酶购自NEB公司;E.Z.N.A.Endo- Free Plasmid Mini Kit I购自OMEGA公司;HindⅢ和XhoⅠ、DNase I(RNase-free)和Reverse Transcriptase M-MLV (RNase H-)购自TaKaRa公司;Anti-His Antibody购自天根生化科技(北京)有限公司;Anti-Pig IgG (whole molecule)-FITC antibody produced in rabbit购自Sigma公司。
1.2引物设计
参照CD163受体基因序列设计引物,扩增CD163的胞外区部分基因(见图1),引物序列见表1。为便于基因的克隆及构建表达载体等,在上、下游引物5'端分别加入HindⅢ和XhoⅠ位点(引物序列中划线部分),由上海英潍捷基生物技术有限公司合成。

图1 CD163受体及其功能域缺失构建模式Fig.1 CD163 deletion constructs were used to identify which SRCRs in CD163 are involved in function

表1 CD163受体及其功能域缺失构建的引物Table 1 Primers used to amplify the full-length CD163 or CD163 deletion constructs
1.3真核表达质粒构建
以前期研究[8]得到的重组质粒pMD20-CD163为模板,用引物M163-Dx(x=0~8)和M163-DR对CD163受体或其不同SRCR区域缺失CD163受体PCR扩增,并设空白对照。PCR扩增条件:94℃2 min,1个循环;94℃30 s,55℃30 s,68℃3 min 30 s,35个循环;最后72℃延伸7 min。PCR扩增产物经琼脂糖凝胶电泳后回收。再将载体pcDNA3.1-Myc-His和PCR回收产物均用HindⅢ和XhoⅠ双酶切,连接电泳回收产物,连接产物转化至感受态细胞DH5α。经质粒抽提、酶切鉴定正确后送Invitrogen公司测序,测序重组质粒命名为pcDNA3.1-Dx CD163。
1.4真核表达质粒mRNA水平上的表达鉴定
以得到重组质粒pcDNA3.1-Dx CD163转染BHK-21细胞,采用lipofectamine 2000脂质体转染。取转染后48 h BHK-21细胞,参照Invitrogen公司TRIzol Reagent使用说明书提取总RNA。检测合格的RNA 经DNase I(RNase-free)消化后反转录,再以M163-D0和M163-DR为引物进行RT-PCR,从mRNA水平检测各真核表达质粒表达情况。
1.5真核表达质粒蛋白质水平上的表达鉴定
以得到重组质粒pcDNA3.1- Dx CD163转染BHK-21细胞,取转染后48 h BHK-21细胞,Anti-His Antibody为一抗,参考文献[9]进行IFA,检测重组表达质粒表达情况。
1.6 CD163功能域的初步筛选
以1.3得到重组质粒pcDNA3.1-Dx CD163转染BHK-21细胞,取转染后48 h BHK-21细胞,用PRRSV阳性血清为一抗,参考文献[9]进行IFA,根据病毒感染情况初步筛选CD163受体的有效功能域。
BHK-21细胞转染真核表达质粒pcDNA3.1-D0 CD163或pcDNA3.1-D4 CD163 24 h后,弃上清,PBS洗细胞3次;加入104TCID50的PRRSV XHGD株37℃吸附1 h;弃病毒液,PBS洗细胞3次,加入含2%血清的DMEM,37℃分别培养1、6、12、24和48 h后,收获细胞。冻融3次后,7 000 r·min-1室温离心7 min,取上清,对其进行TCID50测定。
2 结果与分析
2.1 CD163基因片段扩增和克隆
以重组质粒pMD20-T-CD163为模板,用引物M163-Dx(x=0~8)和M163-DR对CD163受体或其不同SRCR区域缺失CD163受体进行PCR扩增,各扩增产物分别标记为Dx CD163(x=0~8)。经1%琼脂糖凝胶电泳,可见相应目的条带,Dx CD163(x=0~ 8)基因扩增产物长度分别约为3.4、3.0、2.7、2.3、2.0、1.7、1.3、1.0或0.7 kb,与预期长度相符(见图2)。
2.2质粒pcDNA3.1-Dx酶切鉴定
用T4DNA连接酶对载体pcDNA3.1-Myc-His和PCR回收产物的双酶切产物进行连接反应,转化至感受态细胞DH5α。灭菌牙签挑取可疑菌落于含氨苄青霉素的LB液体培养基中,37℃振荡培养16 h,质粒提取,并酶切鉴定。结果显示,重组质粒pcDNA3.1-Dx CD163(x=0~8)经HindⅢ和XhoⅠ双酶切获得分别约为5.4 kb片段(载体pcDNA3.1-Myc-His的双酶切条带)和3.4、3.0、2.6、2.3、2.0、1.7、1.3、1.0或0.6 kb片段(Dx CD163(x=0~ 8)的双酶切条带),与预期相符(见图3)。酶切鉴定为阳性的菌液于上海英潍捷基生物技术有限公司序列测定,测序正确的重组质粒命名为pcDNA3.1-Dx CD163(x=0~8)。
2.3真核表达质粒mRNA水平上的表达鉴定
将得到真核表达质粒pcDNA3.1-Dx CD163(x= 0~8)转染BHK-21细胞。转染48 h的BHK-21细胞,经总RNA提取,测浓度并取1 μg的RNA电泳检测,结果显示RNA呈现出3条rRNA带,分别是28S、18S和5S rRNA带;28S亮度约是18S亮度的2倍,可进行下游试验(见图4a)。
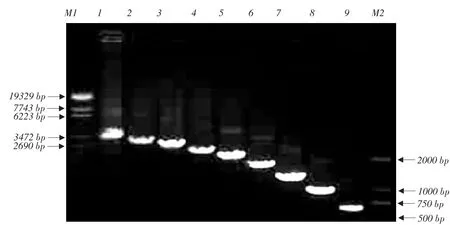
图2 Dx CD163PCR扩增Fig.2 PCR amplification of Dx CD163
为避免DNA对下游试验产生影响,经检测合格的RNA取5 μg进行DNase I(RNase-free)消化,得到的RNA再次进行浓度测定和电泳检测,电泳显示经DNase I(RNase-free)消化的RNA检测合格,可用于下游试验(见图4b)。
得到的RNA经RT-PCR后,电泳观察可见相应目的条带,转染pcDNA3.1-Dx CD163(x=0~8)质粒的细胞RT-PCR扩增条带分别约为3.4、3.0、2.7、2.3、2.0、1.7、1.3、1.0或0.7 kb,与预期相符(见图4c)。
2.4真核表达质粒蛋白质水平上的表达鉴定
取转染48 h的BHK-21细胞,进行IFA分析,荧光显微镜下观察,野生型CD163受体和各SRCR区域突变的CD163受体质粒在BHK-21细胞上均可正常表达(见图5)。
2.5 CD163功能域初步筛选
BHK-21细胞转染24 h且感染PRRSV 24 h后,进行IFA分析,转染pcDNA3.1-Dx CD163(x=0~4)的BHK-21细胞检测到病毒,而转染pcDNA3.1-Dx CD163(x=5~8)的BHK-21细胞却未检测到病毒(见图6),根据病毒感染情况初步证明CD163受体的前4个SRCR区域缺失不影响PRRSV感染。
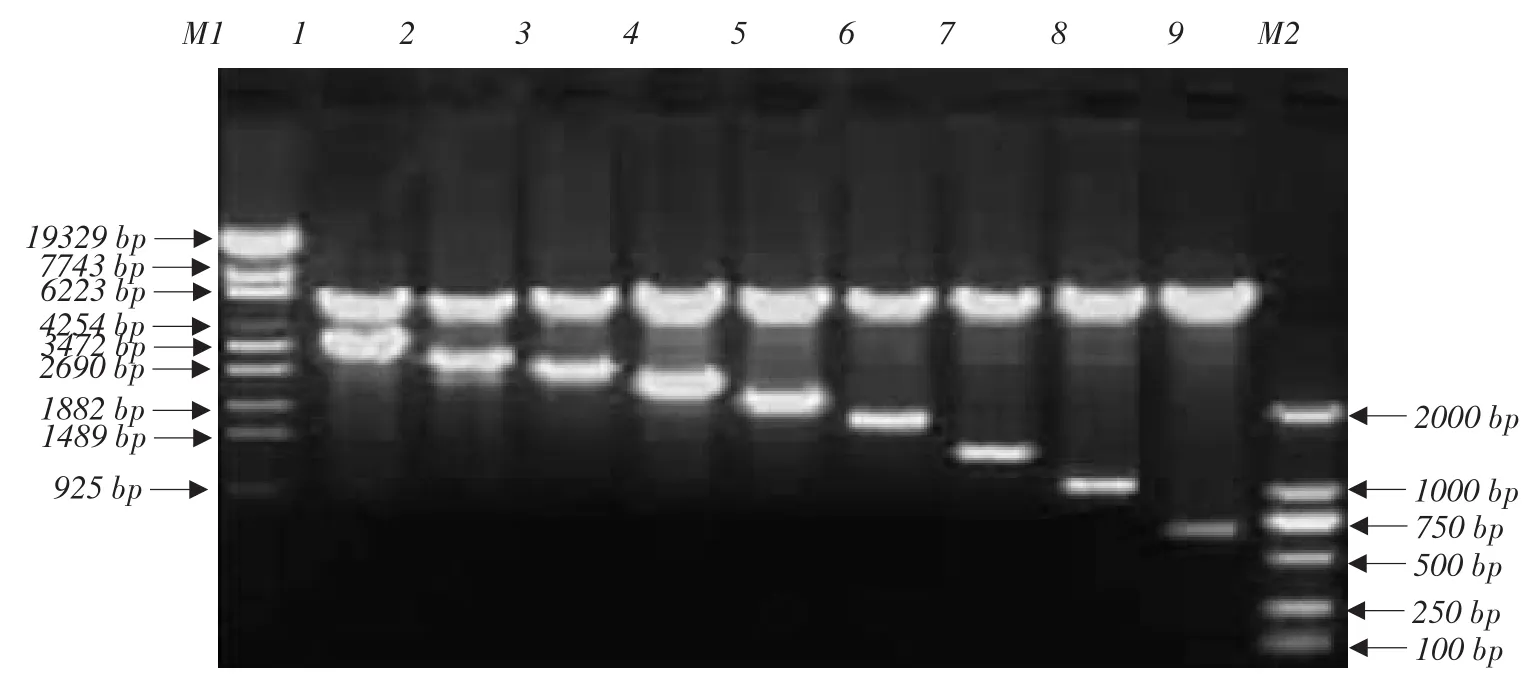
图3 pcDNA3.1-Dx CD163酶切鉴定图Fig.3 Restricted enzymes digestion of pcDNA3.1-Dx CD163
图4 真核表达质粒mRNA水平上的表达鉴定Fig.4 RT-PCR results showing the mRNAs from BHK-21 cell transfected with pcDNA3.1-Dx CD163(x=0~8)
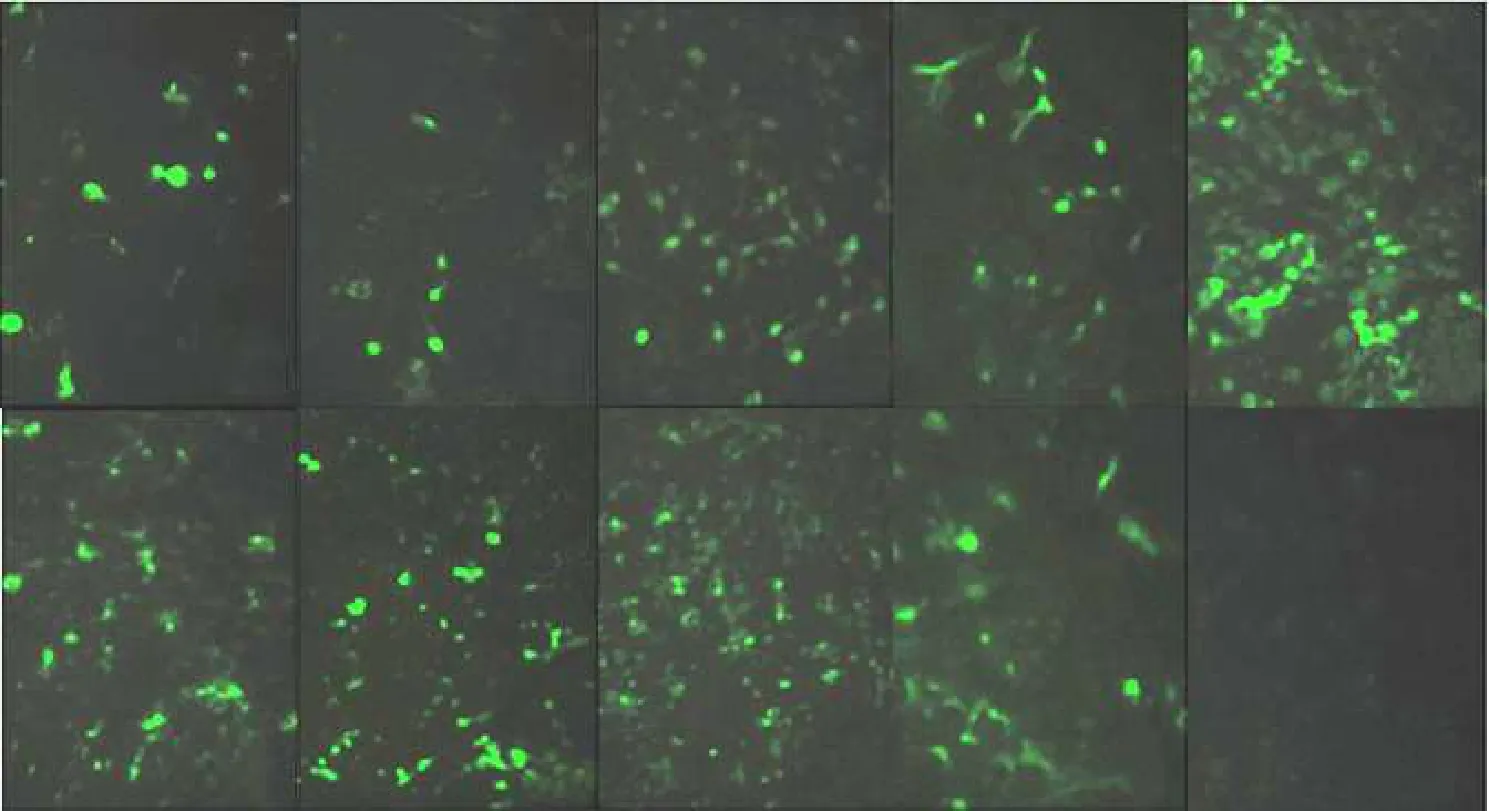
图5 不同突变体CD163真核表达质粒转染后IFA鉴定(×100)Fig.5 IFA analysis of BHK-21 cells were transfected with pcDNA3.1-Dx CD163(x=0~8)(×100)
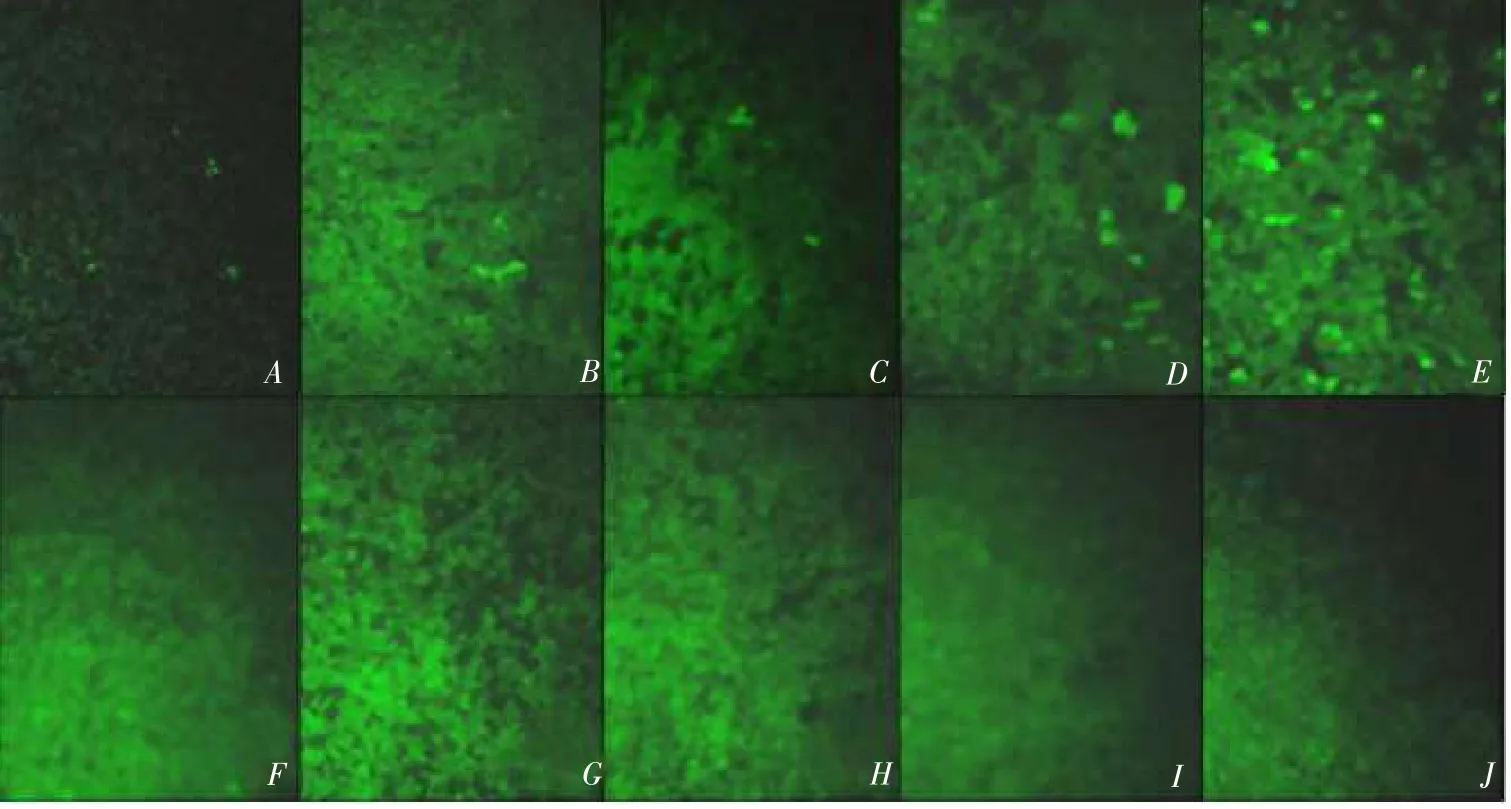
图6 CD163作用域的初步筛选(×100)Fig.6 IFA analysis to identify which SRCRs in CD163 are involved in function(×100)
BHK-21细胞转染真核表达质粒pcDNA3.1-D0 CD163或pcDNA3.1-D4 CD163,分别感染PRRSV 1、6、12、24和48 h后,收获细胞,进行TCID50测定。从图7可知,在病毒感染BHK-21细胞(表达缺失前4个SRCR区域的突变型CD163受体或野生型的CD163受体)后不同时间点,细胞内病毒量差异不显著;病毒感染细胞后12 h内,野生型CD163受体更有利于病毒的增殖,而12 h后,缺失前4个SRCR区域的突变型CD163受体较野生型CD163受体有利于病毒增殖。

图7 野生型CD163受体D0 CD163和突变型CD163受体D4 CD163比较Fig.7 Kinetics of PRRSV infection in BHK cells CD163 expressing or D4 CD163
3 讨论与结论
PRRSV通过结合细胞受体感染易感细胞,CD163是PRRSV感染细胞受体之一[4]。对猪CD163基因克隆、序列分析、原核部分表达和真核表达等展开研究[14-19],该CD163基因源于猪肺泡巨噬细胞(PAM);Marc-145细胞与PAM细胞相比无Sn,而CD163和Sn在PRRSV感染过程中具有协同作用[20]。因此,本研究以Marc-145细胞CD163受体为对象,分析其在PRRSV感染Marc-145细胞过程中作用,可避开Sn影响。
Calvert等发现前2个SRCR区缺失对CD163受体功能无影响[4]。因此假设前X(X≥2)个SRCR区域缺失不影响CD163作为PRRSV感染细胞的受体功能。构建一系列真核表达质粒,分别表达不同个数的SRCR区缺失CD163受体突变体,再将这些质粒转染非允许细胞BHK细胞,经PRRSV感染后,IFA检测病毒感染情况。由结果可知,转染pcDNA3.1-Dx CD163(x=0~4)的BHK细胞中检测出病毒,说明前4个SRCR区域缺失不影响PRRSV进入细胞。
通过比较野生型和突变型猪CD163受体,发现在缺失SRCR区域前有14个氨基酸相同。这段序列可能与CD163受体的转录或蛋白翻译后的加工修饰有关。因此,在构建各SRCR区域缺失的CD163受体突变体时,在每个质粒的SRCR重复区前加14个氨基酸序列。
为进一步解CD163受体和D4 CD163受体差别及其对病毒生长影响,将转染真核表达质粒pcDNA3.1- D0 CD163或pcDNA3.1- D4 CD163的BHK细胞分别感染PRRSV 1、6、12、24和48 h后,收获细胞,由TCID50结果可知,缺失前4个SRCR区域的突变型CD163受体和野生型的CD163受体相比,对PRRSV感染细胞及病毒生长无明显影响。说明SRCR5对CD163受体PRRSV的感染具有重要作用,与Van Gorp研究结果一致[5]。
Van Gorp等和冯亚琼等分别通过SRCR区嵌合突变和抗体阻断方法研究CD163的关键功能域[5-7]。本试验通过SRCR区逐一缺失的方法研究Marc-145细胞的CD163受体功能域,通过抗体阻断方法进一步验证。Marc-145细胞CD163受体在PRRSV机制中作用尚待深入研究。
[参考文献]
[1]Renukaradhya G J,Meng X J,Calvert J G,et al.Inactivated and subunit vaccines against porcine reproductive and respiratory syndrome:Current status and future direction[J].Vaccine,2015,33(27):3065-3072.
[2]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].Plos One,2007,2(6):526.
[3]Tong G Z,Zhou Y J,Hao X F,et al.Highly pathogenic porcine reproductive and respiratory syndrome,China[J].Emerg Infect Dis,2007,13(9):1434-1435.
[4]Calvert J G,Slade D E,Shields S L,et al.CD163 expression confers susceptibility to porcine reproductive and respiratory syndrome viruses[J].JVirol,2007,81(14):7371-7379.
[5] Van Gorp H,Van Breedam W,Van Doorsselaere J,et al.Identification of the CD163 protein domains involved in infection of the porcine reproductive and respiratory syndrome virus[J].J Virol,2010,84(6):3101-3105.
[6]冯亚琼,杜东颖,王冬梅,等.猪CD163分子在PRRSV感染PAM细胞中的作用研究[J].免疫学杂志,2015,31(1):22-26.
[7]冯亚琼,崔春晓,夏禹豪,等.CD163分子在PRRSV免疫复合物感染PAM细胞过程中的作用[J].免疫学杂志,2015,31(9):757-761.
[8]曹宗喜,焦培荣,林哲敏,等.Marc-145细胞CD163基因克隆及其真核表达质粒构建[J].东北农业大学学报,2013,44(6):28-31.
[9]Cao Z X,Zhao F R,Jia K,et al.Effect of compounds on the purification and antibody preparation of the extracellular domain fragment of the receptor CD163[J].Virology Journal,2011(8):144.
[10]曹宗喜,潘全会,张原江,等.猪繁殖与呼吸综合征病毒各结构蛋白的融合表达[J].中国预防兽医学报,2009,31(2):85-88.
[11]Keffaber K K.Reproductive failure of unknown etiology[J].Am Assoc Swine Pract Newsl,1989(1):1-10.
[12]Wensvoort G,Terpstra C,Pol J M,et al.Mystery swine disease in The Netherlands:the isolation of Lelystad virus[J].Vet Q,1991,13(3):121-130.
[13]郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国畜禽传染病,1996(2):3-7.
[14]李红,易建中.PRRSV受体CD163原核分段表达[J].生物技术进展,2012,2(6):417-422,465.
[15]Gao L,Guo X K,Wang L,et al.MicroRNA 181 suppresses porcine reproductive and respiratory syndrome virus(PRRSV)infection by targeting PRRSV receptor CD163[J].J Virol,2013,87(15):8808-8812.
[16]Zhu L,Song H,Zhang X,et al.Inhibition of porcine reproductive and respiratory syndrome virus infection by recombinant adenovirus-and/or exosome-delivered the artificial microRNAs targeting sialoadhesin and CD163 receptors[J].Virol J,2014,19(11):225.
[17]Chen Y,Guo R,He S,et al.Additive inhibition of porcine reproductive and respiratory syndrome virus infection with the soluble sialoadhesin and CD163 receptors[J].Virus Res,2014,179:85-92.
[18]Shi C,Liu Y,Ding Y,et al.PRRSV receptors and their roles in virus infection[J].Arch Microbiol,2015,197(4):503-512.
[19]Li H,Zhou EM,Liu CQ et al.Function of CD163 fragments in porcine reproductive and respiratory syndrome virus infection[J].Int JClin Exp Med,2015,8(9):15373-15382.
[20]Van Gorp H,Van Breedam W,Delputte P L,et al.Sialoadhesin and CD163 join forces during entry of the porcine reproductive and respiratory syndrome virus[J].J Gen Virol,2008,89(12):2943-2953.
Identification of the CD163 receptor domains related to porcine reproductive and respiratory syndrome virus infection
CAO Zongxi1,2,JIAO Peirong2,LIN Zhemin1,QI Wenbao2,ZHANG Guihong2(1.Hainan Provincial Key Laboratory of Tropical Animal Reproduction and Breeding and Veterinary Medicine,Institute of Animal Husbandry and Veterinary Medicine,Hainan Academy of Agricultural Sciences,Haikou 571100,China; 2.MOA Key laboratory for Animal Vaccine Development,South China Agricultural University,Guangzhou 510642,China)
Abstract:Porcine reproductive and respiratory syndrome virus(PRRSV)had been acknowledged as one of the most important agents affecting swine industry.The scavenger receptor CD163 was one of the important entry mediators for PRRSV infection.To identify which SRCRs in CD163 were involved in this function,CD163 or Dx CD163 deletion mutants were cloned to eukaryotic expression vector pcDNA3.1-Myc-His,then the pcDNA3.1-Dx CD163(x=0-8)plasmid were transfected into BHK-21 cells using Lipofectamine 2000.The plasmid transfected cells at 24 h post-transfection were infected with XHGD strain of PRRSV.After 1 h adsorption period,inocula were removed and cells were washed with PBS.After an additional incubation for 24 h at 37℃,cell monolayers were observed and analysed by IFA.The result showed that the first four SRCR repeats of CD163 were not required for PRRSVbook=24,ebook=29receptor activity,and SRCR5 was essential for PRRSV infection.The results lay foundation for analyzing the function of CD163 as PRRSV receptor in cultured cell.
Key words:PRRSV; Marc-145 cell; CD163; domains; identification
*通讯作者:张桂红,教授,博士生导师,研究方向为兽医传染病学。E-mail:guihongzh@scau.edu.cn
作者简介:曹宗喜(1982-),男,副研究员,博士,研究方向为兽医传染病学。E-mail:caozongxi@163.com
基金项目:国家自然科学基金项目(31272564);现代农业产业技术体系专项资金项目(CARS- 36);海南省科学事业费项目(13-214002- 0002)
收稿日期:2016-01-19
中图分类号:S852.65
文献标志码:A
文章编号:1005-9369(2016)03-0023-08

