酒曲发酵产凝乳酶及其酶学特性研究
,
(北京工商大学食品质量与安全北京实验室,北京100048)
酒曲发酵产凝乳酶及其酶学特性研究
赵爱梅,赵笑,段紫怡,杨亚威,滕军伟,杨贞耐
(北京工商大学食品质量与安全北京实验室,北京100048)
通过研究不同因素对酒曲发酵产凝乳酶的影响,确定适宜的产酶条件:酒曲添加量3%(质量分数),发酵时间4 d,培养基初始pH值为6.0,摇床转速120 r/m in。利用乙醇分级沉淀对酒曲发酵液中的凝乳酶进行提取,得到体积分数为70%乙醇沉淀蛋白具有凝乳活力;进一步进行Sephadex G-75凝胶过滤得到纯化凝乳酶,并经SDS-PAGE电泳分析,确定酶的分子量为35.6 ku。对此纯化酶的酶学特性的研究表明,该酶的最适温度为40℃,pH值为5.4时酶活性最高,Ca2+,Zn2+,M g2+和K+对酶活性具有促进作用,其中以Ca2+和Zn2+促进作用较强;Cu2+,Na+和Fe2+对酶活性有抑制作用,其中Cu2+的作用较为显著。该凝乳酶在干酪加工中具有潜在的应用前景。
酒曲发酵;凝乳酶;提纯;酶学特性
0 引 言
江米酒是利用酒曲发酵江米而形成的产物,其具有的凝乳作用是由酒曲微生物产生的蛋白酶引起的[1]。目前商业化凝乳酶的来源主要包括动物、植物、微生物和基因工程凝乳酶。随着近年来世界干酪产量的逐步提高,凝乳酶需求量也将不断增加。由于微生物生长速度较快,发酵产量大,酶的提取方便有效,且生产成本较低[2],利用微生物凝乳酶来进行干酪生产是今后凝乳酶研究开发的趋势[3]。
凝乳酶的凝乳活性受到酶浓度、体系温度、pH值和离子浓度等反应条件的影响[4,5]。在干酪生产过程中,在适宜条件下若凝乳酶的蛋白水解活性过高,则导致成熟干酪出现苦味[6];若凝乳酶的耐热性强,在干酪加工过程中残留较高的酶活性,也会影响产品的品质[7]。因此,获得具有优良酶学特性的凝乳酶对于确保干酪质量至关重要[8]。
本研究对酒曲发酵江米产生的凝乳酶进行分离提取纯化,对其酶学特性进行了研究,为进一步利用微生物发酵生产适于干酪加工的凝乳酶制剂提供技术依据。
1 实 验
1.1 材料和设备
酒曲,糯米,脱脂乳粉,其他化学试剂均为分析纯。
数显恒温水浴锅HWS-12,电子天平PL-203,电热恒温培养箱DHP-9272,低温高速离心机CR 21G III,超纯水制备系统Molgene1810a,博乐纯化系统Bio-rad,博乐蛋白电泳系统Bio-rad Mini-Protein,全自动凝胶成像仪Bio-rad。
1.2 不同因素对酒曲发酵产凝乳酶的影响
利用酒曲发酵糯米采用Zhao等[9]方法。将新鲜糯米洗净后浸泡4 h,常压下蒸煮30 m in,冷却后,按如下对不同因素设定的参数,加入酒曲搅拌均匀,加入经灭菌冷却后的去离子水,于摇床中恒温发酵。发酵完成后用中速定性滤纸对发酵液进行过滤,取滤液按1.5方法测定凝乳活力。
1.2.1 酒曲接种量的影响
酒曲的添加量按1%,2%,3%,4%,5%和6%(均为质量分数,下同)添加,水分添加量为0.5毫升每克熟化的糯米基质;混匀后在30℃、摇床转速120 r/m in,发酵3 d,发酵的初始pH值6.0。
1.2.2 发酵时间的影响
酒曲添加量质量分数为3%,水分添加量为0.5毫升每克熟化的糯米基质;混匀后在30℃、摇床转速120 r/m in;发酵时间设定为2,3,4,5和6 d;发酵的初始pH值为6.0。
1.2.3 培养基初始pH值的影响
酒曲添加量为3%(质量分数),水分添加量为0.5毫升每克熟化的糯米基质;混匀后在30℃、摇床转速120 r/m in发酵3 d;发酵的初始pH值设定为4.5,5.0,5.5,6.0,6.5和7.0。
1.2.4 摇床转速的影响
按1.2.1所示方法进行酒曲发酵,其中酒曲添加量为3%(质量分数),水分添加量为0.5毫升每克熟化的糯米基质;混匀后在30℃条件下进行震荡发酵3 d,摇床转速设定为80,100,120,140和160 r/m in,发酵的初始pH值为6.0。
1.3 凝乳酶的提取、纯化和SDS-PAGE电泳分析
1.3.1 乙醇分级沉淀提取凝乳酶
取经冷却的酒曲发酵滤液采用乙醇分级沉淀法提取凝乳酶。选取乙醇体积分数为50%,60%,70%和80%进行分级沉淀;逐级添加所需乙醇,充分混匀后,静置2 h;在4℃下,转速为5 000 r/m in离心30 m in,收集上清进行下一级沉淀,收集沉淀物作为分级蛋白,用去离子水溶解后,分别测定各级沉淀所得蛋白的凝乳活力,将具有酶活性的蛋白沉淀物进一步冷冻干燥制成凝乳酶粗酶干粉待用。
1.3.2 凝胶过滤纯化凝乳酶
将粗提凝乳酶干粉配置成质量浓度为0.2 g/m L的溶液,溶剂为浓度0.05 mo l/L(pH值为5.8)的PBS溶液(配方:NaC l35 g,KC l1 g,KH2PO41.2 g,K2HPO49 g,添加蒸馏水定容至1 L,用乙酸调节pH值至5.8)。采用Sephadex G-75柱子(2.6cm×60cm)进行凝胶过滤,上样量为4 m L,流速为1 m L/m in,洗脱液浓度为0.05 m ol/L(pH值为5.8)的PBS溶液,测定每个蛋白峰的凝乳活力,收集具有凝乳活力的洗脱峰即为纯化酶。
1.3.3 SDS-PAGE电泳分析
SDS-PAGE电泳参考汪家政等的方法[10-11]。纯化凝乳酶样品与样品处理液以3:1的比例混匀,沸水浴煮5 m in后,转速8 000 r/m in离心5 m in,上样量为10 uL。电泳条件为分离胶质量分数12.5%,浓缩胶质量分数4.5%;电泳开始时电压为60 V,进入分离胶后电压调至50 V。考马斯亮蓝R 250染色,然后脱色6 h,置凝胶成像仪观察。
1.4 凝乳酶的酶学特性
1.4.1 凝乳酶的最适温度
取5m L质量浓度为100 g/L的脱脂乳,40℃保温5 m in添加凝乳酶,添加量为10 SU/m L;分别在温度20,25,30,35,40,45,50、55℃下测定纯化凝乳酶的凝乳活力,以40℃时的凝乳活力为100%,计算相对凝乳活力。
1.4.2 pH值对凝乳酶活力的影响
取5 m L质量浓度为100 g/L的脱脂乳,40℃保温5 m in添加凝乳酶,添加量为10 SU/m L;以0.1 m ol/L的NaOH或HC l调整脱脂乳的pH值,分别在pH值为5.4,5.6,5.8,6.0,6.2,6.4,6.6,6.8,7.0时测定纯化凝乳酶的凝乳活力;以pH值为5.8时的凝乳活力为100%,计算相对凝乳活力。
1.4.3 金属离子对凝乳酶活力的影响
取5 m L质量浓度为100 g/L的脱脂乳,分别添加N aC l,KC l,M gC l2,CaC l2,FeC l2,CuC l2,ZnC l2(浓度均为10 mm o l/L),40℃保温5 m in添加凝乳酶,添加量为10 SU/m L;测定纯化凝乳酶的凝乳活力,以空白对照的凝乳活力为100%,计算相对凝乳活力。
1.4.4 凝乳酶的最适钙离子浓度
取一定量质量浓度为100 g/L的脱脂乳,分别添加浓度10 mm ol/L的CaC l2将脱脂乳的钙离子浓度调节为0.005,0.01,.0.015,0.02,0.025,0.03和0.035 m ol/L;取5m L不同钙离子浓度的脱脂乳,40℃保温5m in添加凝乳酶,添加量为10 SU/m L;测定纯化凝乳酶的凝乳活力,以钙离子浓度为0.02 m o l/L时的凝乳活力为100%,计算相对凝乳活力。
1.4.5 凝乳酶的最适锌离子浓度
分别将脱脂乳内的锌离子浓度调节为0.005,0.01,0.015,0.02,0.025,0.03和0.035 m o l/L,取5 m L不同锌离子质量浓度的100 g/L脱脂乳,40℃保温5 m in添加凝乳酶,添加量为10 SU/m L;测定纯化后目的凝乳酶的凝乳活力时间,以锌离子浓度为0.02 m ol/L时的凝乳活力为100%,计算相对凝乳活力。
1.5 凝乳酶活力测定
凝乳酶活力的测定采用A rim a[12]的方法。取5 m L质量浓度100 g/L的脱脂乳,在35℃保温5m in,加入0.5m L适当稀释的酶液或江米酒发酵液,迅速混合均匀,准确记录从加入待测液到乳凝固的时间。以40 m in凝固用质量浓度为100 g/L的脱脂乳1 m L所需的酶量定义为一个索氏单位(Soxhelt Unit,SU),即
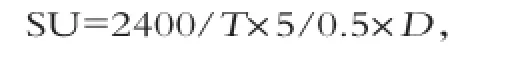
式中:T为凝乳时间(s);D为稀释倍数。
2 结果与分析
2.1 发酵条件对酒曲微生物产凝乳酶的影响
2.1.1 酒曲添加量的影响
由图1(a)可以看出,酒曲的接种量由1%增加至3%时,发酵液的凝乳活力迅速上升,且达到最大值,接种量大于3%后,凝乳活力有所下降。Shahta&Foda[13]所研究的产凝乳酶米曲霉LS1其最佳接种量为7.4× 106g-1,接种量过高会引起酶产量的下降,从而使酶活性相对降低。这可能是当接种量增加时,发酵液的微生物数量随之增加,当微生物达到一定数量时,由于培养基内营养物质有限,使产酶微生物的生长受到限制,从而影响了凝乳酶的生产,酶活力也相应降低[14]。
2.1.2 发酵时间的影响
由图1(b)可知,在发酵初期发酵液的凝乳活力逐渐增加,第4天时达到最高值,之后随着发酵时间的延长凝乳活力逐渐降低。这与发酵液中产酶微生物的生长密切相关。发酵初期培养基内营养物质充足,产酶微生物迅速增加,成为优势菌群,当到达第4天时,微生物数量达到最高,凝乳酶的产量最大。随着发酵时间的进一步延长,可能是由于目标产酶微生物数量的急速下降及衰亡而不能很好地抑制杂菌的生长,同时发酵液中某些营养成分或中间代谢产物可能对产酶有抑制作用,从而使发酵液中酶活力降低;Escobar &Barnett[15]实验结果表明,用不同水解程度的酪蛋白来代替发酵体系中的酪蛋白来生产凝乳酶,随着酪蛋白水解程度的增加,酶的产量下降,因此发酵过程中产生的中间产物游离氨基酸可能抑制微生物产酶。
2.1.3 培养基初始pH的影响
由图1(c)可知,当发酵液初始pH值从4.5升至5.5时,酒曲微生物所产凝乳酶的活力缓慢升高;pH值升至6.0时凝乳活力达到最大值。当pH值超过6.0后,凝乳活力迅速下降。Higashio&Yoshioka[16]研究发现,利用总状毛霉N o.50发酵产凝乳酶时,在酶产量达到最大值后,酶活性急剧减少,而调节发酵基质的初始pH值到5.0并维持在6.4以下能够使这中酶活性下降的趋势被抑制。这可能是由于酒曲微生物凝乳酶大多属于酸性蛋白酶,其最适pH值为1.5~6.0[17]。
2.1.4 摇床转速的影响
由图1(d)可知,随着摇床转速由80 r/m in增至100 r/m in,发酵液凝乳活力稍微增加,继续升高至120 r/m in时,凝乳活力迅速上升并达到最大值,之后逐渐下降。一般来说,改变摇床的转速可以导致发酵系统溶氧量的变化,进而影响产酶微生物的生命活动。提高发酵体系的溶氧量,有利于需氧微生物的生长,但是溶氧量过高,也会使微生物生长受到影响,因此合适的溶氧量对产酶微生物的生长有重要的意义[18]。
2.2 酒曲发酵产凝乳酶的提取、纯化和SDS-PAGE电泳分析
根据上述对酒曲发酵产凝乳酶条件的研究,确定适宜的产酶条件:酒曲添加量3%,发酵时间4 d,培养基初始pH值为6.0及摇床转数120 r/m in。在此条件下利用酒曲发酵糯米(水分添加量为0.5毫升每克熟化的糯米基质),发酵液经过滤后用于凝乳酶的提纯。
2.2.1 乙醇分级沉淀提取凝乳酶
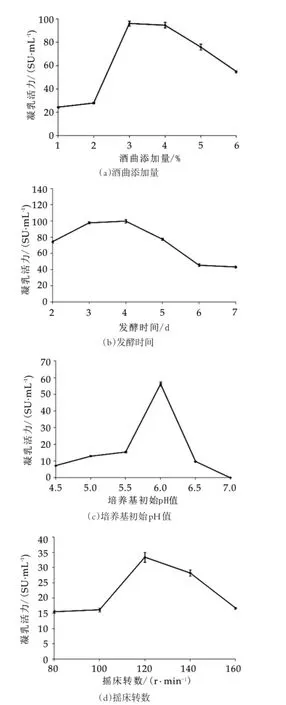
图1 发酵条件对酒曲微生物产凝乳酶的影响
对酒曲发酵滤液的乙醇分级沉淀物测定其凝乳活力,结果表明,只有乙醇体积分数为70%时其沉淀得到的蛋白质具有很好的凝乳效果,表明此蛋白沉淀物具有凝乳酶活力,进一步冷冻干燥即得凝乳酶粗酶品。本研究结果与前人有关霉菌凝乳酶提取的结果类似。潘道东等[19]通过乙醇分级沉淀提取根霉凝乳酶,当添加的乙醇体积分数为70%时,凝乳酶的得率最大;Hashem[20]对青霉凝乳酶进行提纯,当添加的乙醇体积分数为60%~70%时沉淀得到的蛋白质其凝乳活力最高。

图2 酒曲发酵液乙醇分级沉淀蛋白的SDS-PAGE电泳
图2为酒曲发酵滤液的乙醇分级沉淀物的SDS-PAGE电泳分析结果。由图2可以看出,乙醇分级沉淀物的蛋白条带分布在分子量10~100 ku之间,其中体积分数为70%乙醇沉淀物的蛋白条带在34~43 ku之间,与50%,60%和80%乙醇沉淀物的蛋白条带分布位置不同。根据上述凝乳活力的测定结果,确定体积分数70%乙醇沉淀物的蛋白条带即为凝乳酶组分(M CE)。
2.2.2 凝胶过滤纯化凝乳酶及其SDS-PAGE电泳分析
乙醇分级沉淀所得的凝乳酶粗酶经Sephadex G-75分子筛层析柱进一步分离纯化,得到两个明显的洗脱峰(图3)。经过测定凝乳活力,第一个洗脱峰具有凝乳活力,而第二个洗脱峰无凝乳活力。收集洗脱峰1的洗脱液,使用分子量为10 ku的超滤离心管进行超滤浓缩,浓缩液进一步冷冻干燥得到纯化凝乳酶。
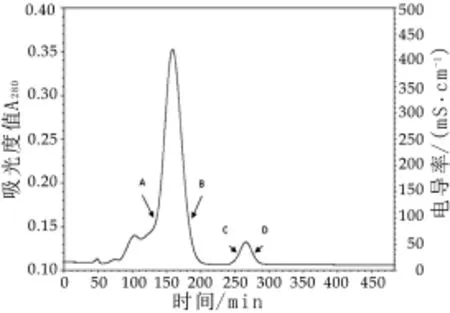
图3 Sephadex G-75对酒曲微生物凝乳酶的纯化
对纯化凝乳酶进行SDS-PAGE电泳分析,在约35 ku处可见酶蛋白条带(图4A)。以蛋白质的迁移距离与示踪染料的迁移距离的比值为横坐标,以标准蛋白分子质量对数为纵坐标绘制标准曲线(图4B),经计算得到本研究的酒曲微生物凝乳酶(M CE)的分子量为35.6 ku。据报道,小牛皱胃酶分子量为35.65 ku,米黑毛霉所产凝乳酶的分子量为34.0~39.0 ku之间,根霉所产凝乳酶分子量约为35 ku[9]。滕国新[21]等报道,酒曲中根霉凝乳酶的分子量为36.6 ku。本研究所得凝乳酶分子量与上述结果接近。程巧玲[22]等认为,酒曲中的霉菌是产凝乳酶的优势菌群,因为在酒曲发酵过程中,霉菌数量与发酵液凝乳活力的变化趋势一致。因此,初步推测本研究所得凝乳酶很有可能是酒曲中霉菌产生的。
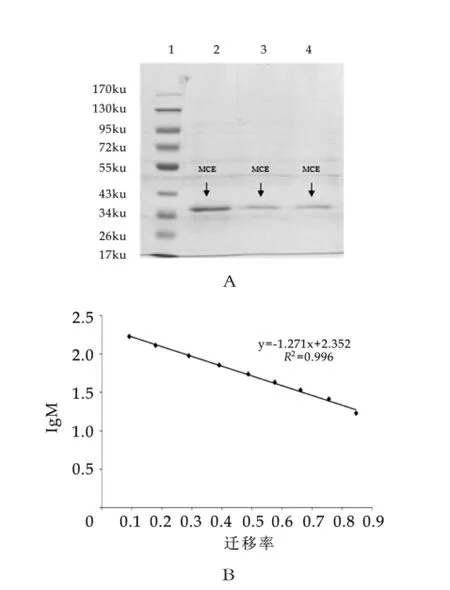
图4 酒曲微生物凝乳酶的SDS-PAGE电泳分析
2.3 凝乳酶的酶学性质
2.3.1 凝乳酶的最适温度
图5为温度对酒曲微生物凝乳酶活力的影响。由图5可以看出,温度在20~40℃之间时,凝乳酶的凝乳活力随温度的升高而增加,40℃时酶活达到最大值。温度在40~55℃之间时,凝乳酶的凝乳活力随温度的升高显著下降,当温度达到55℃时凝乳活力几乎完全消失。
据报道,小牛皱胃酶的最适温度为50℃[23];微小毛霉、米黑毛霉和草酸青霉所产凝乳酶的最适温度分别为55,60和65℃[24-25];蒋晓雪等[26]对酒曲凝乳酶的酶学特性研究表明其最适温度为35℃。本研究的酒曲微生物凝乳酶的最适温度为40℃。通常干酪制作时需经过热烫(约为50℃)处理,在此温度条件下,本研究的酒曲微生物凝乳酶将受热失活,从而减少凝乳块中凝乳酶残留活性,有利于避免干酪成熟期间因蛋白过度降解导致苦味肽的产生。
2.3.2 pH值对凝乳酶活力的影响
由图6可以看出,随着pH值的逐渐升高,凝乳酶活力不断降低,pH值为5.4时凝乳活力最高;pH值趋于中性时,凝乳活力显著降低;pH值为7.0时凝乳活力几乎消失。有研究表明,毛霉所产凝乳酶在pH值为5.5时表现出最高的凝乳活力,青霉所产凝乳酶在pH值为4.0时凝乳活力最高;薛璐等[27]研究酒曲凝乳酶在pH值为6.5时表现出最大活力。当pH值从7.0下降到4.0~5.0时,大部分商用凝乳酶的凝乳活力呈线性增加[28]。多数凝乳酶在中性或弱碱性条件下凝乳酶活力的显著损失可能与其在此条件下酶空间构象发生不可逆转的变化有关[29]。

图5 温度的影响

图6 pH值的影响
2.3.3 金属离子对凝乳酶活力影响
不同金属离子对酒曲微生物凝乳酶活力的影响如图7所示。由图7可能看出,Ca2+,Zn2+,M g2+和K+对凝乳酶活力有促进作用,其中Ca2+的促进作用最强,依次为Zn2+、M g2+和K+。与对照组相比,添加10 mm o l/L CaC l2可以使凝乳酶的活力提高约1倍左右。有研究表明,Ca2+能够和酪蛋白胶束中的胶体磷酸钙进行离子交换,从而使胶束表面的电荷减少,胶束彼此间的空间斥力减小而易于靠近并大量聚集促进凝乳;同时,Ca2+与H+之间进行交换可以降低凝乳体系的pH值,间接加快酶促反应[30]。Cu2+,Na+和Fe2+对凝乳酶的活力均有不同程度的抑制作用,其中Cu2+的抑制作用最为显著。薛璐等[27]对酒曲凝乳酶的研究表明,K+、Ca2+,M g2+,Zn2+均能促进凝乳,而Na+对凝乳活力也具有一定的促进作用,其中Ca2+的作用最为明显;Cu2+对凝乳酶的活力有抑制作用。吴进菊等[31]的研究表明,Ca2+,M g2+对酒曲凝乳酶的活力具有促进作用,而Na+和Cu2+具有抑制作用,K+具有抑制作用。因此,金属离子对于不同来源的酒曲凝乳酶的活性有不同的影响。在制作干酪的过程中要选择合适种类和数量的盐,以达到最佳的凝乳效果,确保干酪质量。
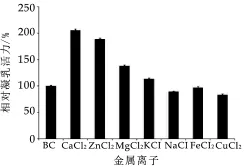
图7 金属离子对酒曲微生物凝乳酶活力的影响
2.3.4 凝乳酶的最适钙离子和锌离子浓度
如上所述,Ca2+和Zn2+对酒曲微生物凝乳酶的活力影响显著。进一步研究表明(图8),随着脱脂乳中Ca2+或Zn2+浓度的增加,凝乳酶的活力也随之升高,当Ca2+或Zn2+浓度增加至0.02 m ol/L时,酶活力达到最大值;之后随着Ca2+或Zn2+浓度增加,凝乳活力下降,但前者酶活力下降得更缓慢些。因此,酒曲微生物凝乳酶的最适钙离子和锌离子浓度均为0.02 m ol/L。当Ca2+或Zn2+浓度为0.02 m o l/L时凝乳速率最快,凝固效果最好,对凝乳酶活力的促进作用最为显著。
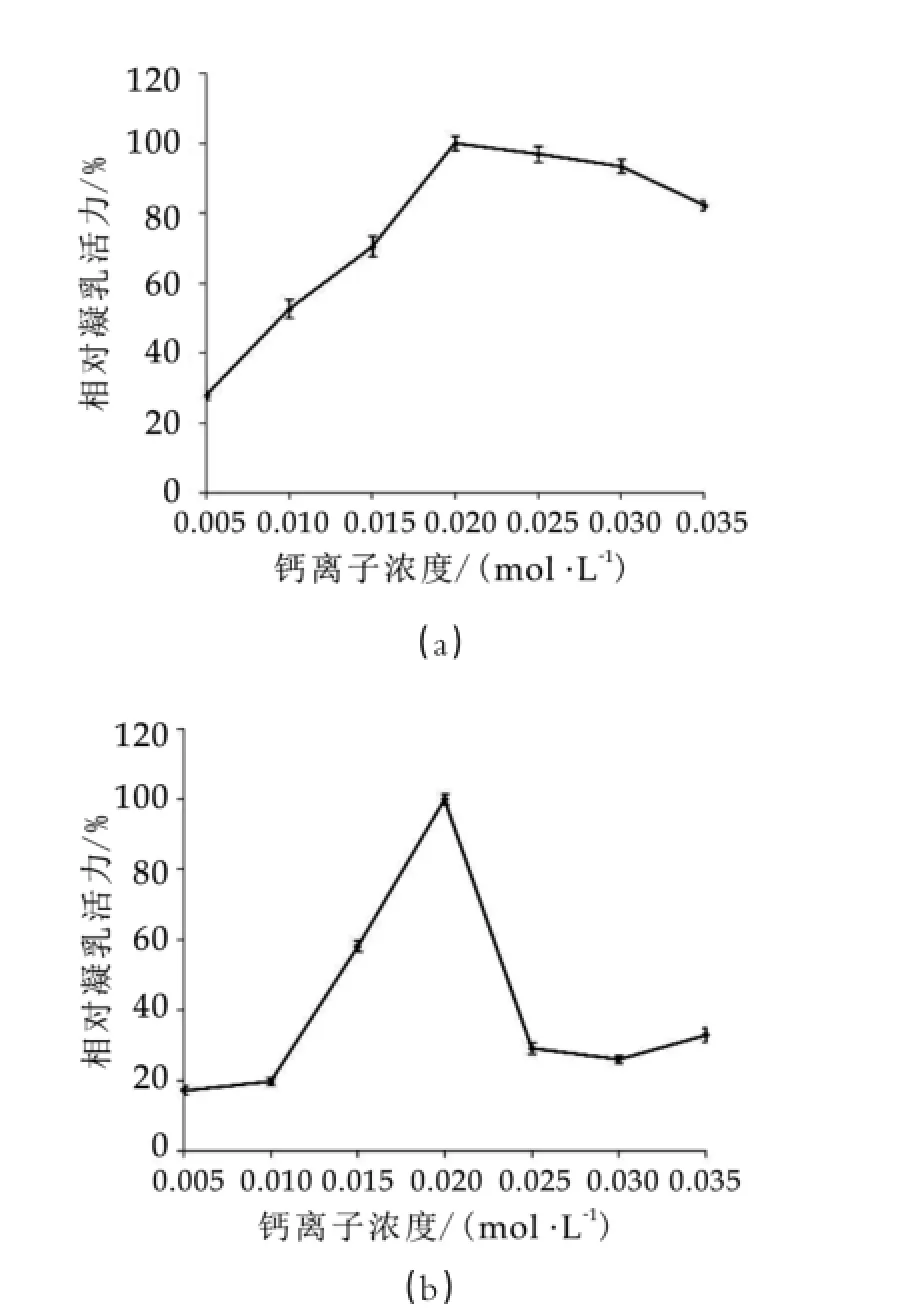
图8 钙离子和锌离子对酒曲微生物凝乳酶活力的影响
3 结 论
通过研究不同因素对酒曲发酵产凝乳酶的影响,确定适宜的产酶条件为:酒曲添加量3%,发酵时间4 d,培养基pH值为6.0,摇床转速120 r/m in。在此条件下进行酒曲发酵,对发酵液中的凝乳酶进行乙醇分级沉淀提取和Sephadex G-75凝胶过滤,获得纯化凝乳酶。经SDS-PAGE电泳分析,获单一蛋白条带,其分子量为35.6 ku。该凝乳酶最适温度40℃,高于55℃时酶活性完全丧失。该酶在偏酸性条件下具有较高的凝乳活力。Ca2+,Zn2+,M g2+和K+对该酶活性具有不同程度的促进作用,其中Ca2+和Zn2+的促进作用强,酶的最适Ca2+和Zn2+浓度均为0.02 m o l/L;Cu2+,N a+和Fe2+对酶活性具有抑制作用,其中Cu2+的抑制作用较显著。本研究结果表明,酒曲微生物凝乳酶耐热性相对较差,适于干酪加工;在干酪加工过程中使用不同盐分时,应注意金属离子的种类及浓度对酶活性的影响。后续研究着力于该酶的凝乳机理及在干酪加工中的应用。
[1]刘振民,骆承庠.江米酒乳凝固机理研究[J].食品科学,2000,21(7):13-15.
[2]POZA M,SIEIRO C,CARREIRA L,et al.Production and characterization of the milk-clotting protease of Myxococcus xanthusstrain 422[J].Microbiol Biotechnol.2003,30:691-698.
[3]孙宝国,曹雁平,李健,等.食品科学研究前沿动态[J].食品科学技术学报,2014,32(2):1-11.
[4]NAJERA A I,RENOBALES M,BARRON L JR.Effects of pH, temperature,CaCl2and enzyme concentrations on the rennet-clotting properties of milk:a multifactorial study[J].Food Chemistry,2003,80 (3):345-352.
[5]LUCEY J.A.Rennet-induced coagulation of milk[J].Encyclopedia of Dairy Sciences(Second Edition),2011:579-584.
[6]刘显庭,张昊,郭慧媛,等.凝乳酶在干酪生产中的应用[J].中国乳业,2013,(133):54-57.
[7]钟继才.凝乳酶在干酪生产中的应用[J].中国乳品工业,2006,34 (1):54-56.
[8]STAFF A.Rennet eontaining 100%chymosin inereases cheese quality and yield.New proeess optimizes extraetion of chymosin from calves leading to improved rennet product.Food Teehnology.1989,43, 88-89.
[9]ZHAO X,WANG J,ZHENG Z,et al.Production of a milk-clotting enzyme by glutinous rice fermentation and partial characterization of the enzyme.Journal of Food Biochemistry.2015,39(1):70-79.
[10]姜铁民,薛璐,周伟明,等.江米酒凝乳酶的纯化及凝乳机制初探[J].食品与发酵工业,2006,32(7):24-27.
[11]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2002.
[12]AR IMA K,YU J and IWASAKIS.M ilk-clotting enzyme from Mucor pusillus var[J].Lindt.Method.Enzymol.,1970,19,446-459.
[13]SHAHTA H.M.A,FODA M.S.Production of a milk-clotting enzyme by Aspergillus oryzae under solid substrate culture conditions. Deutsche Lebensmittel-Rundschau,2005,101(6):260-265.
[14]PEI J.Y,CHENG C.C.Factors Affecting the Grow th and Production of Milk-Clotting Enzyme by Amylomyces rouxii in Rice Liquid Medium[J].Graduate Institute of Food Science and Technology, 2005,43(3)283-288.
[15]JOES E,STANLEY B.Synthesis of acid protease from Mucor miehei:integration of production and recovery.Process Biochemistry,1995,30(8):695-700.
[16]HIGASHIO K,YKAOSHIO Y.M ilk clotting enzyme production by NTG induced mutant of Mucor racemosus No.50.(Studies on milk clotting enzyme from microorganisms.V.)[J].Journal of the Agricultural Chemical Society of Japan[Nihon Nogei Kagakkai-shi],1982,56(9):777-785.
[17]姜峰,张兰威.我国凝乳酶特性及其替代品的研究现状[J].食品研究与开发,2003,24(6):3-6.
[18]王明强,张惟广.发酵法生产凝乳酶的概述[J].四川食品与发酵, 2008,44(2):22-24.
[19]潘道东,韩玲玲.根霉凝乳酶的分离纯化及其酶学特性研究[J].中国食品学报,2011,11(2):53-59.
[20]HASHEM A.M.Purification and properties of amilk-clotting enzyme produced by Penicilliun oxalicum[J].Bioresource Technologe, 2000,75(3):219-222.
[21]腾国新.酒曲中根霉凝乳酶性质及对扣碗酪凝乳质地影响的研究[D].北京:中国农业大学,2005.
[22]程巧玲,白小佳,王艳萍.江米酒中凝乳酶产生菌的分离及产酶条件的优化程[J].生物工程学报,2008,6(24):999-1003.
[23]韦薇.小牛凝乳酶的分离及部分特性研究[J].中国乳品工业,1997,25 (4):21-24.
[24]HE X,REN F,GUO H,et al.Purification and properties of a milk-clotting enzyme produced by Bacillus amyloliquefaciensD4[J]. Korean Journal of Chemical Engineering,2011,28(1):203-208.
[25]MARTIN P,RAYMONG M.N,BRICASE,et al.Kinetic studies on the action of Mucor pusillus,Mucor miehei acid proteases and chymosins A and B on a synthetic chromophoric hexapeptide[J].Biochimicaet Biophysica Acta(BBA)-Enzymology,1980,612(2):410-420.
[26]蒋晓雪,王艳萍.江米酒酒醪中凝乳酶酶学性质的初步研究[J].天津科技大学学报,2010,25(1):5-8.
[27]薛璐,陈历俊.江米酒凝乳酶酶学特性的研究[J].食品科学,2008,29 (4):259-262.
[28]CAVALCANTI M.T.H,TEIXEIRA M.F.S,LIMA F J.L,et al.Partial purification of new milk-clotting enzyme produced by Nocardiopsissp[J].Bioresource Technology,2004,93(1)29-35.
[29]王明强.微小毛霉产凝乳酶条件及酶性质的研究[D].西南大学, 2008.
[30]苏光宇.影响凝乳酶活性的研究[J].内蒙古科技与经济,2006(11): 120-121.
[31]吴进菊,徐尔尼.酒曲根霉F34菌株凝乳酶的初步纯化及部分酶学性质的研究[J].食品工业科技,2008(9):135-137.
Production of a milk-clotting enzyme by Jiuqu starter fermentation and enzymatic properties of the enzyme
ZHAO Ai-mei,ZHAO Xiao,DUAN Zi-yi,YANG Ya-wei,TENG Jun-wei,YANG Zhen-nai
(Beijing Technology and Business University Beijing Laboratory O f Food Quality and Safety,Beijing 100048,China)
By studying different factors influencing production of am ilk-clotting enzyme by Jiuqu starter fermentation,the suitable conditions for producing the enzyme were determined:addition of Jiuqu starter 3%,fermentation time 4 days,initial medium pH6.0 and rotation speed 120rpm.The enzyme was extracted from the fermentation liquor by step-wise ethanol precipitation from 50%to 60%,70%and 80%, and the 70% ethanol precipitate was found with milk-clotting activity.This active fraction was further purified by Sephadex G-75 gel filtration and analyzed by SDS-PAGE electrophoresis,showing the molecular weight of the enzyme of 35.6 ku.The purified enzyme had an optimal reaction temperature of 40℃,and the optimal pH of 5.4.Ca2+,Zn2+,Mg2+and K+stimulated the enzyme activity,with Ca2+and Zn2+having stronger effect.Cu2+,Na+and Fe2+had inhibitory effect on the enzyme activity,with Cu2+having stronger effect.Them ilk-clotting enzyme could be potentially used in cheese processing.
Jiuqu starter fermentation;Milk-clotting enzyme;Extraction and purification;enzymatic properties
Q93-33
:A
:1001-2230(2016)02-0016-06
2015-07-27
公益性行业(农业)科研专项(201303085);北京市百千万人才工程资助项目;国家自然科学基金项目(31371804)。
赵爱梅(1989-),女,研究生,研究方向为乳品加工。

