微小毛霉G-3凝乳酶的酶学特性研究
邵淑娟,曾庆真,朱丽君,杨贞耐
(1.菏泽市行政审批服务局,山东菏泽 274000;2.菏泽市食品药品检验检测研究院,山东菏泽 274000;3.北京食品营养与人类健康高精尖创新中心/食品质量与安全北京实验室,北京工商大学,北京 100048)
凝乳酶(Chymosin,EC 3.4.23.4)是重要的工业用酶之一,在食品、医药等领域应用广泛。在干酪制作过程中,它主要起着凝固牛乳、改善风味和质构、影响干酪得率等作用[1]。传统凝乳酶最初来源于未断奶的小牛皱胃,而随着世界干酪及干酪素产业的发展,其供应已不能满足现代生产所需[2]。因此,研究学者进行大量研究从动植物或微生物中寻找最具发展潜力的凝乳酶。其中,微生物具有易培养、生长周期短、受地域气候时间限制小等特性,用其生产凝乳酶成本低、经济效益高、酶提取方便,因此与动植物相比最具发展前途[3]。从现有文献报道可知,目前产生凝乳酶的微生物主要有毛霉、曲霉、根霉及细菌类等[4-5]。其中,由微小毛霉产生的凝乳酶较大部分蛋白分解酶的蛋白分解能力弱,对牛乳凝固作用强,安全无毒,因而成为目前微生物凝乳酶应用最多的菌种之一[6]。
本实验室前期经筛选培育得到一株高产凝乳酶的微小毛霉菌株,菌株编号为G-3。因此,本文在前期对微小毛霉(G-3)凝乳酶的发酵条件进行优化的基础上对其酶学特性进行详细研究,为高效率、低成本产生凝乳酶提供一定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
微小毛霉(G-3)由吉林省农业科学院农产品加工研究中心选育与保藏。
1.1.2 培养基
固态发酵培养基:(NH4)2SO40.3 g、KH2PO40.05 g、麸皮15 g、去离子水25 mL。
1.1.3 试剂
脱脂乳粉,新西兰Fonterra公司;乙醇、β-巯基乙醇、十二烷基硫酸钠(SDS),北京化工厂有限责任公司;金属盐类,汕头市西陇化工有限公司。其余试剂均为国产分析纯。
1.2 仪器与设备
HZQ-X100振荡培养箱,中国哈尔滨市东联电子技术开发有限公司;冷冻离心机,美国Thermo Eletron公司;HWS24电热恒温水浴锅,上海一恒科技有限公司;数显pH计,德国Sartorious公司。
1.3 方法
1.3.1 微小毛霉凝乳酶酶液的制备
向微小毛霉(G-3)固态发酵培养基中加入100 mL的氯化钠溶液(4%),搅拌后于恒温振荡箱上(30 ℃)以150 r/min的转速浸提4 h。之后用4层无菌纱布过滤得该凝乳酶的粗酶液。向粗酶液中加入60%的乙醇溶液于4 ℃条件下沉淀4 h后,以10 000 r/min的转速离心15 min(4 ℃)。将沉淀用pH为5.8的磷酸钠缓冲液(0.1 mol/L)溶解即得用于以下凝乳活力测定的凝乳酶酶液。
1.3.2 凝乳活力测定
用CaCl2(0.01 mol/L)溶液将脱脂乳粉配制成的脱脂乳液(10%),准确量取35 ℃水浴10 min下的待测酶液0.2 mL及脱脂乳液2 mL,两者迅速充分混匀后开始计时,至絮状沉淀出现为终点。凝乳活力计算公式见式(1),相对凝乳活力计算公式见式(2):

式(1)中:t为凝乳时间,单位为s;n为稀释倍数。式(2)中:A为所测凝乳活力,单位为SU/mL;A0为对照凝乳活力,单位为SU/mL。
1.3.3 不同温度对凝乳酶活力的影响及凝乳酶的热稳定性
将待测酶液分别在20~80 ℃条件下水浴10 min后,根据1.3.2的方法测定凝乳活力。以最高凝乳活力项为对照记为100%,以研究该凝乳酶的最适凝乳温度。
将待测酶液分别在35 ℃、45 ℃、55 ℃和60 ℃条件下水浴 15 min、30 min、45 min、60 min、90 min、120 min、150 min、180 min、240 min、300 min和360 min,迅速降温并于35 ℃水浴10 min后,根据1.3.2的方法测定剩余凝乳活力。以最高凝乳活力项为对照记为100%,以研究该凝乳酶的热稳定性。
1.3.4 不同pH对凝乳酶活力的影响及凝乳酶的pH稳定性
用0.1 mol/L的NaOH溶液及0.1 mol/L的HCl溶液将待测酶液的pH分别调至4.0、5.0、6.0、7.0、8.0和9.0后,根据1.3.2的方法测定凝乳活力。以最高凝乳活力项为对照记为100%,以研究该凝乳酶的最适凝乳pH。
用0.1 mol/L的NaOH溶液及0.1 mol/L的HCl溶液将待测酶液的pH分别调至4.0、5.0、6.0、7.0、8.0和9.0,4 ℃避光放置24 h后,将待测酶液pH调至5.97(原待测酶液pH值),根据1.3.2的方法测定凝乳活力。以最高凝乳活力项为对照记为100%,以研究该凝乳酶的pH稳定性。
1.3.5 不同乳液质量分数对凝乳酶活力的影响
取待测溶液分别加入到质量分数为5.0%、7.5%、10.0%、12.5%、15.0%、17.5%和20.0%的脱脂乳液中,根据1.3.2的方法测定凝乳活力。以最高凝乳活力项为对照记为100%,以研究不同乳液质量分数对凝乳酶活力的影响。
1.3.6 不同金属离子种类及浓度对凝乳酶活力的影响
在脱脂乳液中分别加入 NaCl、KCl、CaCl2、MgCl2、FeCl3、ZnCl2、FeCl2、CoCl2、MnSO4、K2SO4、NiSO4、Li2SO4、CuSO4、MgSO4和ZnSO4等金属盐类,使其浓度均为5 mmol/L,加入待测酶液室温静置30 min后根据1.3.2的方法测定凝乳活力。以未添加任何金属盐类的脱脂乳液测得的凝乳活力为对照记为100%,计算其相对凝乳活力。
挑选能显著促进凝乳酶活力的金属盐类,并分别调整浓度为0 mol/L、0.001 mol/L、0.005 mol/L、0.010 mol/L、0.015 mol/L、0.02 mol/L和0.025 mol/L,加入待测酶液室温静置30 min后根据1.3.2的方法测定凝乳活力。以未添加任何金属盐类的脱脂乳液测得的凝乳活力为对照记为100%,计算其相对凝乳活力。
1.3.7 不同有机溶剂种类及溶度对凝乳酶活力的影响
在脱脂乳液中分别加入不同浓度的乙醇溶液(1%、2%、3%、4%和5%)、β-巯基乙醇溶液(1 mmol/L、2 mmol/L、4 mmol/L和7 mmol/L)及SDS溶液(1 mmol/L、2 mmol/L、3 mmol/L和4 mmol/L),加入待测酶液室温静置30 min后根据1.3.2的方法测定凝乳活力。以未添加有机溶剂的脱脂乳液测得的凝乳活力为对照记为100%,计算其相对凝乳活力。
1.4 数据处理与分析
以上所有实验进行3次生物学重复,实验数据的平均值以及标准差采用Microsoft Excel 2019处理,并通过Origin 2018进行绘图。
2 结果与分析
2.1 微小毛霉凝乳酶的最适凝乳温度及热稳定性分析
温度主要影响酪蛋白胶束表面电荷而影响凝乳酶的凝乳活力[7]。如图1所示,在20~65 ℃,随着温度升高,胶束表面电荷减少,聚集作用增强,凝乳酶的活力也逐渐增加。当温度高于65 ℃时,凝乳活力明显下降,到80 ℃时,相对凝乳活力仅为7.76%。因此,该微小毛霉凝乳酶的最适作用温度为65℃。

图1 不同温度对凝乳酶活力的影响
凝乳酶的热稳定性可决定干酪加工、成熟过程中凝乳酶的残余量,并可进一步影响干酪成品的风味和质构。从图2可看出,随着水浴时间的延长,各温度下凝乳酶的凝乳活力均呈一定程度的下降趋势。该酶在35~45 ℃有较高热稳定性,此区间水浴150 min,相对凝乳活力仍在85%以上。但随着温度的升高,凝乳活力明显降低。当温度达到55 ℃,水浴150 min后,相对凝乳活力仅为63.46%,温度达到60 ℃,水浴120 min,凝乳酶蛋白变性完全失活。该凝乳酶在55 ℃后的热不稳定性,在干酪后期制作过程中对凝乳酶的灭活有较大帮助。
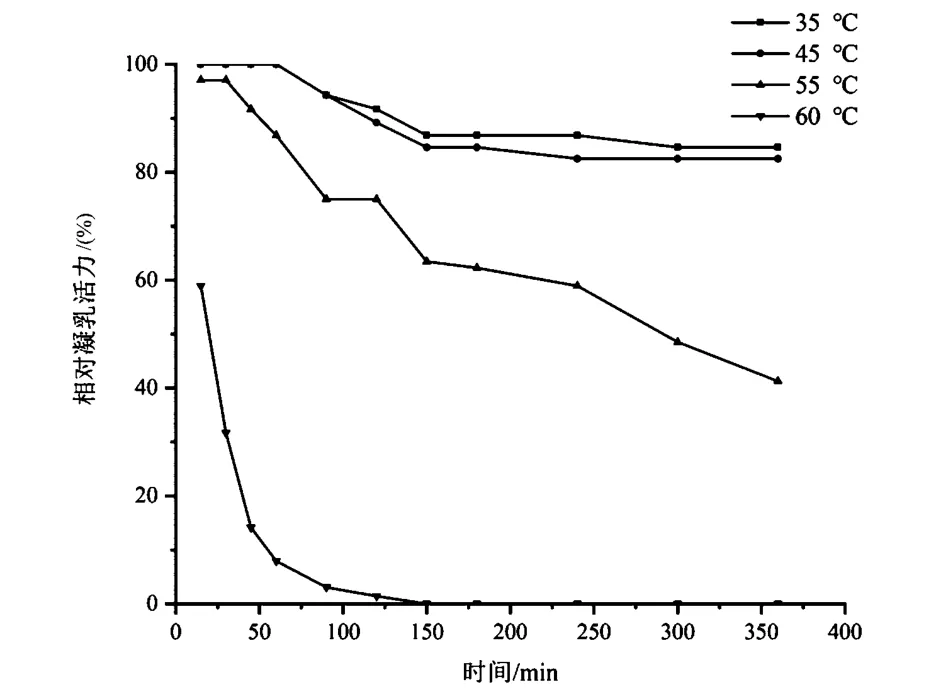
图2 凝乳酶的热稳定性
2.2 微小毛霉凝乳酶的最适pH及pH稳定性分析
pH的变化可影响凝乳酶的空间结构及凝乳酶活性中心的解离形式,从而影响酶促反应动力学导致凝乳活力改变[8]。由图3所示,凝乳酶在pH为5.0时,表现出最强的凝乳活力,随着凝乳酶所处环境由弱酸性转到偏中性时,凝乳活力下降极快。当凝乳酶处于中性条件时,相对凝乳活力仅为对照的20.51%,处于偏碱性条件时,由于凝乳酶的空间结构可能发生了不可逆转的变化使得凝乳活力几乎完全丧失。因此,该凝乳酶的最适凝乳pH为5.0,在此pH条件下,凝乳酶、脱脂乳液的存在状态可能最适合彼此相互结合,发生催化反应,从而使凝乳活力达到最大值。

图3 不同pH对凝乳酶活力的影响
有研究显示在偏酸性条件下,酪蛋白的疏水性增强,胶束易解离,从而使酪蛋白聚集产生凝乳[9]。由图4可看出,凝乳酶在弱酸性(pH=4~6)条件下,凝乳活力较稳定,均保持在90%以上,其中在pH为6时酶最稳定。pH过大(>7)会造成凝乳活力较大损失,这可能是因为凝乳酶属于酸性蛋白酶,在持续碱性条件下由于活力位点的电荷改变,凝乳酶不能有效与底物结合发生催化作用。因此可看出,该凝乳酶的耐酸能力比耐碱能力强,这一特性在干酪制作过程中具有一定优势。
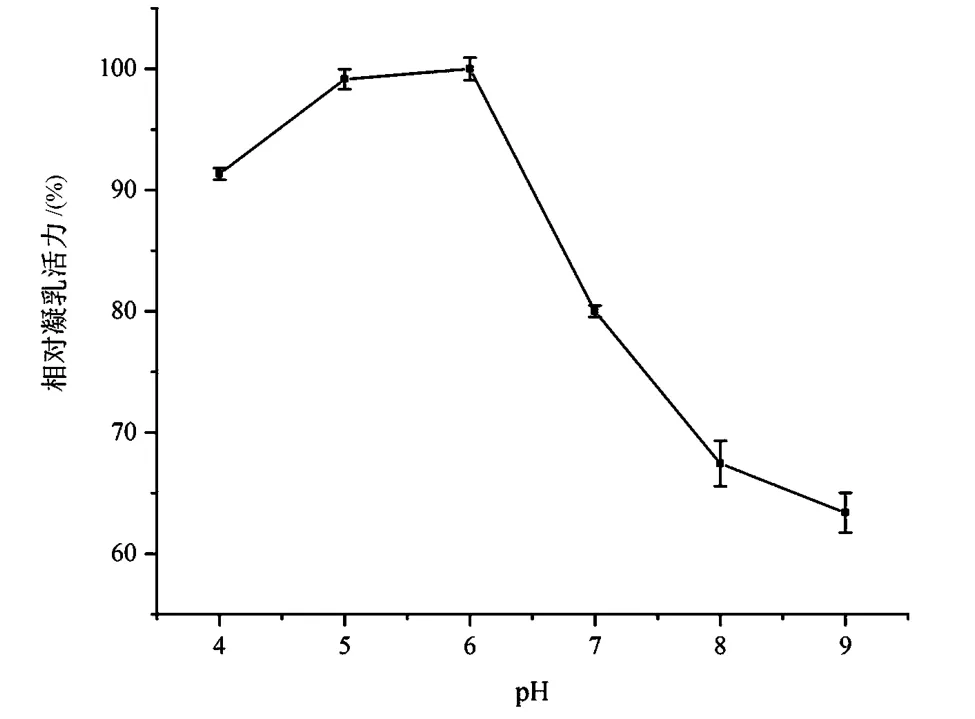
图4 凝乳酶的pH稳定性
2.3 微小毛霉凝乳酶的最适底物质量分数分析
由图5可知,不同质量分数的脱脂乳液对凝乳酶的凝乳活力有较大影响。随着乳液质量分数的升高,凝乳酶的相对凝乳活力逐渐降低,当乳液质量分数达到20%时,相对凝乳活力仅为23.6%。当乳液质量分数为5%时,该酶活力最强。而李玉秋等研究报道,凝乳酶的最适凝乳底物质量分数为10%,与本研究结果不同,这可能是由于脱脂乳粉及凝乳酶的来源不同导致最适作用底物浓度也有所不同[10]。

图5 不同乳液质量分数对凝乳酶活力的影响
2.4 不同种类及浓度的金属离子对凝乳酶活力的影响
在干酪制造过程中,金属离子具有防腐作用,并能改善干酪的质构、风味及功能性。因此,选择合适种类和浓度的金属离子可使凝乳酶发挥最佳的凝乳效果[11]。由图6、7可知,Ca2+、Mg2+、Fe3+、Fe2+、Mn2+分别对凝乳酶的活力有明显促进作用,其中以Mn2+、Mg2+、Ca2+的促进作用最显著。Co2+、Ni2+、Cu2+、Zn2+分别对凝乳酶的活力有抑制作用,其中以Co2+、Ni2+的抑制作用最显著。而Na+、K+、Li+对凝乳酶的活力作用较不明显。本研究结果与其他研究报道略有差异,如潘道东等研究表明Cu2+和Zn2+对根霉凝乳酶有促进作用[12],李柳研究发现Mn2+对甲醇芽孢杆菌凝乳酶有抑制作用[1],宋曦等研究表明Na+、Li+对地衣芽孢杆菌凝乳酶有抑制作用[8]。金属离子对凝乳酶活力的影响较为复杂,不同来源的凝乳酶或反应体系浓度不同,都可能导致金属离子对凝乳酶活力作用产生差异。此外,通过分析比较相同浓度下的MgCl2溶液与MnSO4溶液、KCl溶液与K2SO4溶液对凝乳酶活力作用发现,SO42-比Cl-更能促进凝乳酶的活力。

图6 不同种类金属离子对凝乳酶活力的影响(含Cl-)
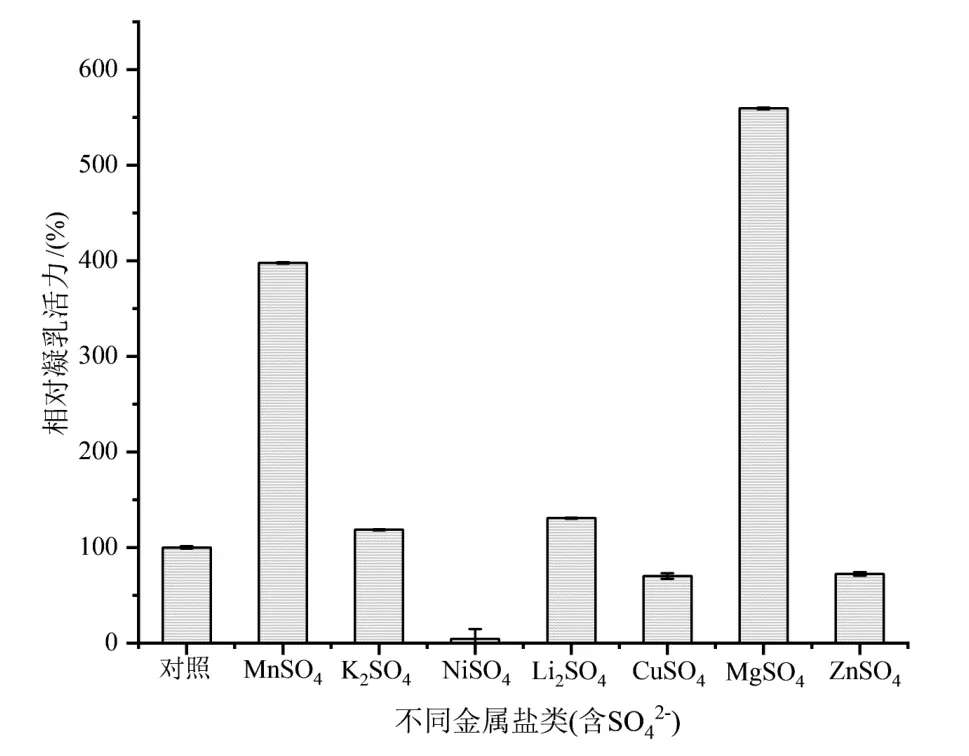
图7 不同种类金属离子对凝乳酶活力的影响(含SO42-)
为了进一步证明Mn2+、Mg2+、Ca2+对凝乳酶活力的促进作用,考察了不同浓度下的Mn2+、Mg2+、Ca2+对凝乳酶凝乳活力的影响。从图8可看出,随着Mn2+、Mg2+浓度的增加,凝乳酶的相对凝乳活力均呈上升趋势,且当Mn2+、Mg2+浓度达到0.025 mol/L时,相对凝乳活力达到最大值。而随着Ca2+浓度的增加,凝乳酶的相对凝乳活力呈先上升后下降的趋势,当Ca2+浓度达到0.02 mol/L时,相对凝乳活力最高。

图8 不同浓度金属离子对凝乳酶活力的影响
2.5 有机溶剂对凝乳酶凝乳活力的影响
表1显示,乙醇对凝乳酶活力有一定的抑制作用,且随着其浓度的增加,抑制作用随之增强。当乙醇浓度为5%时,相对凝乳活力仅为对照的69.59%。这可能是由于乙醇的加入降低了脱脂乳液中蛋白质的介电常数,从而降低了凝乳酶的凝乳活力。由表1可看出,SDS溶液作为一种蛋白变性剂对凝乳酶活力也有抑制作用,且比乙醇的抑制作用更强。当SDS浓度为4 mmol/L时,相对凝乳活力仅为对照的21.46%。表1显示,β-巯基乙醇对凝乳酶活力有明显促进作用,但这种促进作用并不随β-巯基乙醇浓度的变化而变化。β-巯基乙醇中的巯基在凝乳酶中可作为活性催化集团的中心,同时与另一巯基形成二硫键,从而稳定凝乳酶的结构,促进凝乳酶的活力[13]。
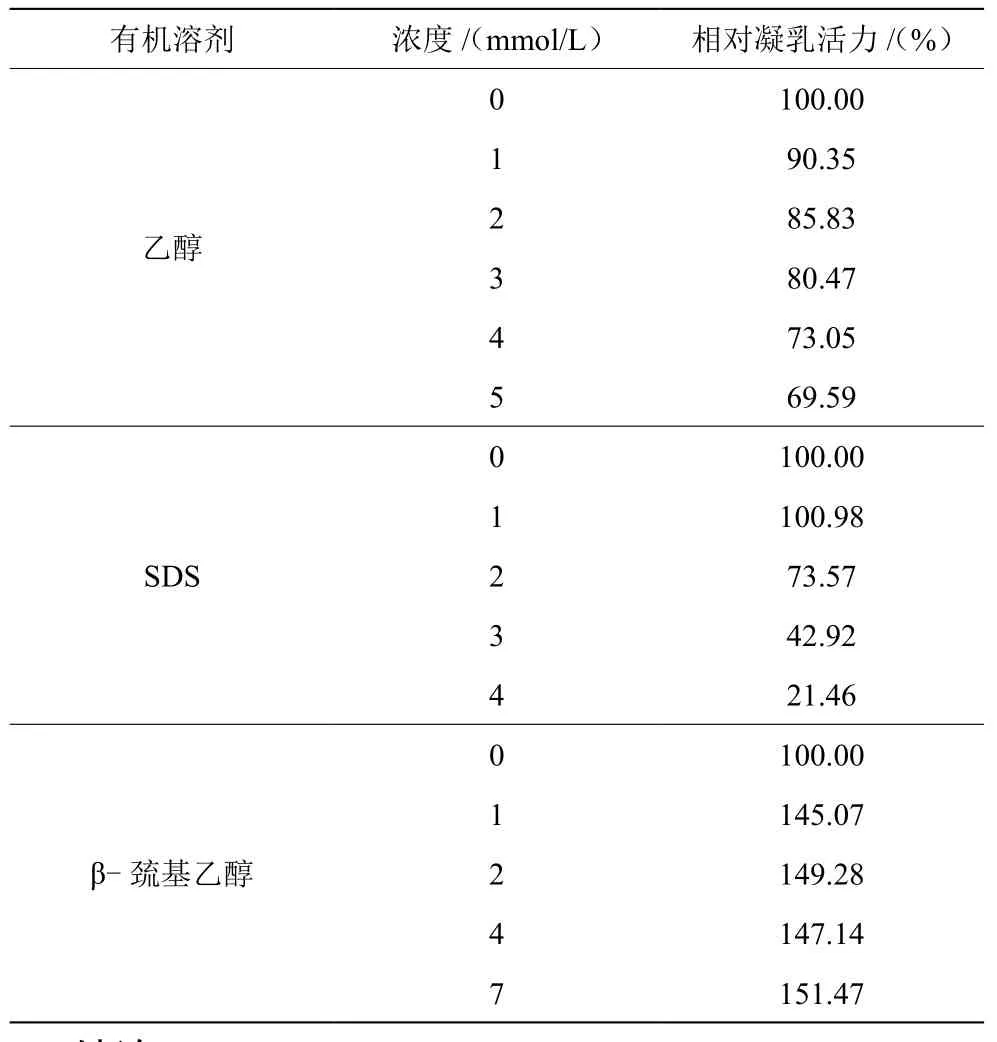
表1 不同种类及浓度的有机溶剂对凝乳酶活力的影响
3 结论
本文主要测定了在不同温度、pH、乳液浓度、金属离子、有机溶剂种类及浓度等条件下微小毛霉(G-3)凝乳酶的相对凝乳活力。研究显示,该凝乳酶的最适凝乳温度为65℃,在35~45℃有较好热稳定性,此温度区间保温150 min,相对凝乳活力仍在85%以上。酶的最适凝乳pH为5.0,且此酶的耐酸能力比耐碱能力强,pH为6.0时酶最稳定。凝乳酶的最适底物质量分数为5%。Ca2+、Mg2+、Fe3+、Fe2+、Mn2+可明显促进凝乳酶活力,其中以Mn2+、Mg2+、Ca2+的促进作用最显著,Co2+、Ni2+、Cu2+、Zn2+对酶活力有抑制作用,其中以Co2+、Ni2+的抑制作用最显著,而Na+、K+、Li+对凝乳酶的活力几乎无作用。乙醇、SDS溶液对凝乳酶活力有抑制作用,且均随着浓度增加,抑制作用随之增强。而β-巯基乙醇对凝乳酶活力有明显促进作用。上述研究表明,该凝乳酶可作为传统凝乳酶的替代酶,根据该凝乳酶的酶学特性制作干酪具有广阔的发展前景。

