烟草Nt4CL与虎杖PcSTS基因的融合表达与功能分析
刘文彬, 郭辉力, 刘 欢, 黄丽娜, 张奋强, 马兰青*
1.北京农学院植物科学技术学院, 北京 102206;
2.北京农学院生物科学与工程学院, 农业部都市农业(北方)重点实验室, 北京 102206
烟草Nt4CL与虎杖PcSTS基因的融合表达与功能分析
刘文彬1,郭辉力2,刘欢1,黄丽娜2,张奋强1,马兰青2*
1.北京农学院植物科学技术学院, 北京 102206;
2.北京农学院生物科学与工程学院, 农业部都市农业(北方)重点实验室, 北京 102206
摘要:4-香豆酰辅酶A连接酶(4-coumarate-CoA ligase, 4CL)和芪合酶(stilbene synthase, STS)是白藜芦醇苯丙氨酸代谢合成的最后两个关键酶。运用悬挂PCR(overlap PCR)的方法将烟草4CL基因(Nt4CL)和虎杖STS基因(PcPKS5)用3个中性氨基酸链连接,得到融合基因Nt4CL-PcPKS5,将其插入原核表达载体中,构建pET30a-Nt4CL-PcPKS5重组质粒,表达Nt4CL-PcPKS5融合蛋白。经Ni(2+)纯化和PD-10柱脱盐后,得到可溶性纯化蛋白。体外酶促反应结果表明该融合酶具有4CL和STS的双重活性,其催化产物为白藜芦醇。酶促反应最适条件为:pH 6.5,反应温度为45℃。研究结果获得了有效催化白藜芦醇生物合成的双功能融合酶,为进一步利用融合酶基因转化工程菌株实现白藜芦醇工业化生产奠定了基础。
关键词:白藜芦醇;融合基因;原核表达;酶促反应
白藜芦醇(resveratrol)是植物在受到生物或非生物胁迫时产生的一种能够提高植物病原抗性和环境恶化的植物次生代谢产物,主要存在于各种浆果、花生以及虎杖(Polygonumcuspidatum)中[1]。日本学者Tokaoka在1940年首次从毛叶藜芦(VeratrumgrandiflorumLoes.)中分离获得[2],随后在虎杖根茎中分离出来[3]。1976年,白藜芦醇作为一种植物自身产生的抗逆物质在葡萄叶片中被发现[4]。目前已知白藜芦醇主要存在于葡萄、桑椹、花生、买麻藤、桉树、大黄等12科、31属72种植物中,以葡萄属植物中最多。Nonomura等[3]发现该物质是治疗炎症、脂类代谢紊乱以及心脏病的有效成分。大量的细胞或动物试验表明白藜芦醇在调节脂质代谢、疏松血管、抗肿瘤、抗衰老、保护心脑血管和调控胰岛素等方面都具有保健功能,在医药、食品和化妆品等行业中被广泛应用[5~7]。
目前,白藜芦醇主要从植物中提取,但植物资源相对有限,又受地理条件和季节的影响,很难获得高产量和高质量的白藜芦醇。有机合成步骤繁杂,生产率低下,限制了有机合成工业的开发[8]。植物细胞工程、转基因技术成本较高,来源有限并且在时间及组织特异性上制约着白藜芦醇的制备。微生物工程方法制备白藜芦醇能够在短期内获得大量目的产物,成为获取白藜芦醇新的有效途径[9]。白藜芦醇经由苯丙氨酸代谢途径(phenylpropanoid pathway)在植物体内合成,4-香豆酰辅酶A连接酶(4-coumarate-CoA ligase,4CL)和芪合酶(stilbene synthase,STS)是该代谢途径的最后两步关键酶。分别过量表达一种关键酶可以有效提高白藜芦醇的产量,但难以高水平积累[10]。研究发现将4CL和STS两个关键酶基因在重组大肠杆菌中合成时,白藜芦醇的产量为104.5 mg/L;而在重组酵母菌中合成白藜芦醇时,白藜芦醇的产量高达391 mg/L[11]。近年来,优化蛋白技术及融合蛋白与蛋白支架上取得了显著的成果。Hölsch[12]将甲酸脱氢酶(FDH)和3-酮酰基-ACP还原酶(KR)通过不同长度的Linker融合,融合酶均表现出单酶的活性,并且显著提高了初始催化速度,使底物转化率达到99.97%。BulowL等[13]在探索构建了双功能酶及多功能酶分子研究中采用融合基因的方法,发现融合蛋白不仅能够保留构成酶分子各自的活性,而且对连续的催化反应能产生“邻近效应”(proximity effect)。
因此,本研究运用悬挂PCR技术将烟草(Nicotianatabacum)4CL基因(Nt4CL)与虎杖STS基因(PcPKS5)用3个氨基酸(GGS)的Linker连接,尝试在白藜芦醇生物合成途径的最后两步中对其关键酶基因Nt4CL和PcSTS进行融合,以期获得有效催化白藜芦醇生物合成的融合酶。从而为进一步利用融合酶基因转化工程菌株实现白藜芦醇的工业化生产奠定基础。
1材料与方法
1.1菌株与质粒
大肠杆菌(Escherichiacoli)DH5α、表达宿主菌Rosetta为本实验室保存,质粒pCRT7/CT-TOPO-Nt4CL、pET30a-PcPKS5均已在前期工作[14]中构建完成。
1.2主要试剂仪器
高纯度质粒小试剂盒购于康为世纪公司,快速琼脂糖凝胶DNA回收试剂盒、OMEGA、dNTPs、X-Gal、EcoRⅠ、XhoⅠ限制性内切酶及Buffer、250 bp DNA Ladder Marker、IPTG、T4 DNA Ligase、pMD18-T载体均购于TaKaRa公司;TransStartTMFastPfu DNA聚合酶、Protein RluerTMⅣ购于北京全式金生物技术有限公司;考马斯亮蓝R-250、亮肽素、胰蛋白酶、PMSF、Dnase、溶菌酶、EDTA、咪唑、DTT、冰醋酸、甘氨酸、溴酚蓝、丙烯酰胺储液、SDS等用于蛋白纯化及电泳试验;酵母提取物、胰蛋白胨和琼脂等均为分析纯;Ni-NTA His-Bind镍琼脂糖购于北京鼎国生物公司;丙二酰辅酶A、辅酶A、白藜芦醇标准品、ATP均购自Sigma公司;PD-10柱购于Amersham Pharmacia Biotech公司。上海生物工程技术服务有限公司进行引物合成及测序服务。
1.3融合酶基因的克隆
依据GenBank中已注册的Nt4CL(登录号:U50846)和PcPKS5(登录号:ACC76753)的序列,设计两对引物F1、R1和F2、R2(表1),分别用来扩增Nt4CL与PcPKS5的基因片段。以扩增的Nt4CL与PcPKS5为模板,F1、R2为引物扩增含Linker长度为3个氨基酸(GGS)的Nt4CL-PcPKS5融合基因。引物F1、R2中分别引入酶切位点EcoRⅠ和XhoⅠ,用于原核表达载体构建。
提取pCRT7/CT-TOP-Nt4CL、pET30a-PcPKS5质粒作为模板,F1、R1为引物扩增带有酶切位点EcoRⅠ和中间连接肽3个氨基酸Linker的Nt4CL片段。F2、R2为引物扩增带有酶切位点XhoⅠ和中间连接肽3个氨基酸Linker的PcPKS5片段。Nt4CL与PcPKS5(浓度比3∶4)混合后做模板,F1、R2为引物,用悬挂PCR技术将Nt4CL与PcPKS5连接起来,构建融合基因Nt4CL-PcPKS5。PCR扩增体系(50 μL):5 μL 2.5 mmol/L dNTPs,1 μL 10 ng/μL模板,10 μmol/L上、下游引物各1 μL,1 μL Trans StartTMFastPfu DNA聚合酶,10 μL 5×Trans StartTMFastPfu缓冲液,加ddH2O至终体积为50 μL。PCR反应条件为:95℃预变性4 min;95℃ 20 s,62℃ 20 s,72℃ 30 s,共循环35次;72℃延伸5 min。产物与pMD18T-Vector连接,转化至DH5α,在含氨苄抗生素的X-Gal/IPTG/LB平板上筛选阳性克隆菌,进一步扩大培养,提取pMD18T-Nt4CL-PcPKS5重组质粒。EcoRⅠ/XhoⅠ双酶切鉴定,并测序。

表1 悬挂PCR引物序列
注:F1中下划线为引入的EcoR I位点,R2中下划线为引入的XhoI位点,R1、F2中下划线为引入的3个氨基酸序列。
1.4Nt4CL-PcPKS5基因原核表达载体构建
分别提取测序正确的重组质粒pMD18T-Nt4CL-PcPKS5和pET30a质粒,用EcoRⅠ、XhoⅠ双酶切质粒,回收Nt4CL-PcPKS5片段和线性pET30a,用T4 DNA连接酶连接片段与线性载体,构建pET30a-Nt4CL-PcPKS5重组质粒,转化至大肠杆菌DH5α感受态中,用含有50 μg/mL卡那霉素的LB平板筛选。菌液PCR鉴定,进一步提取重组质粒,用EcoRⅠ、XhoⅠ双酶切鉴定。重组质粒pET30a-Nt4CL-PcPKS5转入大肠杆菌表达菌株Rosetta。用含有50 μg/mL的卡那霉素和25 μg/mL氯霉素的双抗LB平板筛选阳性菌株,用于下一步融合蛋白的表达。
1.5融合基因的原核表达与纯化
筛选含有目的基因重组质粒pET30a-Nt4CL-PcPKS5的Rosetta阳性菌株,划线培养,挑单菌落于50 μg/mL卡那霉素和25 μg/mL氯霉素的LB液态培养基中培养。对起始菌液OD600值(0.2、0.4、0.6、0.8)、IPTG终浓度(0.2 mmol/L、0.5 mmol/L、0.8 mmol/L、1.0 mmol/L)、诱导温度(15℃、20℃、25℃、30℃、35℃)和表达时间(2 h、4 h、6 h、8 h、10 h)等条件进行筛选,找出融合蛋白表达的最适条件,并在此条件下进行大量表达。细胞破碎后,用Ni2+亲和柱纯化,PD-10柱脱盐,SDS-PAGE检测。纯化蛋白于-80℃保存,用于体外酶促反应检测其催化活性。
1.6体外酶促反应与产物检测
选择0.1 mol/L磷酸钾缓冲液作为体外酶促反应的缓冲液。300 μL标准体外酶促反应体系含有150 μmol/L 4-香豆酸、280 μmol/L丙二酰辅酶A、250 μmol/L ATP、100 μmol/L CoA以及2.0 μg纯化后融合蛋白Nt4CL-PcPKS5。上述反应体系分别在不同pH(5.0、6.0、7.0、8.0、9.0)缓冲液和不同温度(30℃、35℃、40℃、45℃、50℃)条件下反应30 min,加入15 μL乙酸来检测副产物,加入等体积乙酸乙酯萃取,10 000 r/min、10 min离心,重复两次以上,富集上述乙酸乙酯层萃取液,待挥发干燥后加入1 mL色谱甲醇过有机相滤膜,再次挥发干燥后加入50 μL 50%(V/V)甲醇溶解,HPLC进行检测。
选用SunfireTMC18反相柱(5.0 μm,4.6 mm×250 mm)的Waters HPLC系统检测酶促反应产物。选甲醇(A)和水(B)作为流动相,流速设置为0.8 mL/min,设定梯度洗脱条件:10%~70% A 30 min,70% A 10 min。白藜芦醇的标准品溶于色谱甲醇后HPLC检测其保留时间,白藜芦醇最大吸收波长为306 nm。
2结果与分析
2.1Nt4CL-PcPKS5融合基因的克隆
以引物F1和R1为组合、以pCRT7/CT-TOPO-Nt4CL质粒为模板来扩增Nt4CL基因,片段大小为1 200 bp (图1A),组合引物F2和R2以pET30a-PcPKS5质粒为模板来扩增PcPKS5基因,片段大小为1 600 bp(图1A)。这样在Nt4CL的3′端和PcPKS5的5′端引入3个氨基酸(GGS)的Linker,Nt4CL3′端与PcPKS5 5′端的重复序列用于基因融合。回收目的片段,并按比例混合(Nt4CL∶PcPKS5=3∶4),以此为模板,F1和R2为引物组合,运用悬挂PCR技术,扩增Nt4CL-PcPKS5融合基因,电泳检测片段约2 800 bp(图1B),与理论Nt4CL-PcPKS5融合基因片段大小相符,连接Nt4CL-PcPKS5融合基因片段至pMD18-T克隆载体,转化DH5α感受态细胞,提取pMD18-T-Nt4CL-PcPKS5重组质粒,测序结果表明融合基因构建正确。

图1 Nt4CL、PcPKS5和Nt4CL-PcPKS5基因PCR扩增电泳图Fig.1 PCR amplification of Nt4CL, PcPKS5 and Nt4CL-PcPKS5 genes.注:A: Nt4CL和PcPKS5基因扩增电泳图。M:250 bp DNA ladder marker; 1~3:Nt4CL基因;4~6:PcPKS5基因;B:Nt4CL-PcPKS5融合基因电泳图。M:250 bp DNA ladder marker; 1:Nt4CL-PcPKS5融合基因。
2.2Nt4CL-PcPKS5的表达与纯化
将测序正确的表达载体pET30a-Nt4CL-PcPKS5转化到大肠杆菌表达菌株Rosetta中,用于融合蛋白的表达。划线培养pET30a-Nt4CL-PcPKS5,在含有卡那霉素和氯霉素的LB培养基中多次活化菌株,外源添加蛋白表达诱导剂IPTG对目标蛋白进行诱导表达条件筛选。当菌液OD600值在0.4~0.6时,加入终浓度为0.5 mmol/L诱导剂IPTG,25℃诱导表达4 h时,融合蛋白的表达量达到最大。选取最适表达条件进行大量表达,收集菌体,超声破碎细胞,经Ni2+柱纯化、PD-10柱脱盐得到Nt4CL-PcPKS5融合蛋白,聚丙烯酰胺电泳检测(图2),融合蛋白的分子量约为100 kDa,与预测蛋白分子量大小相符。
2.3融合酶体外酶促反应条件筛选
分别研究了反应缓冲液pH和反应温度对Nt4CL-PcPKS5融合酶体外酶促反应的影响。Nt4CL-PcPKS5融合酶的催化效率随pH不断提高呈先升后降的趋势,最适pH为6.5(图3A)。反应温度对Nt4CL-PcPKS5融合酶催化效率的影响趋势同pH,随着温度的升高融合酶的催化效率先升后降,最适反应温度为45℃(图3B)。

图2 融合蛋白Nt4CL-PcPKS5 SDS-PAGE电泳图Fig.2 SDS-PAGE analyses of Nt4CL-PcPKS5 fusion protein.注:M:Protein RluerTM IV Marker; 1:Ni2+树脂亲和柱纯化蛋白;2~4:PD-10柱脱盐后的蛋白。
2.4融合酶功能鉴定
白藜芦醇标准品高效液相色谱(HPLC)检测结果如图4A所示。纯化获得的Nt4CL-PcPKS5融合蛋白在最适条件下催化4-香豆酸和丙二酰辅酶A,生成产物的HPLC检测结果如图4B所示。反应产物与白藜芦醇标准品混合后进行共色谱检测,结果如图4C所示。进一步证实Nt4CL-PcPKS5融合蛋白能有效催化白藜芦醇合成,表明Nt4CL-PcPKS5融合蛋白具有4CL和STS双重活性。
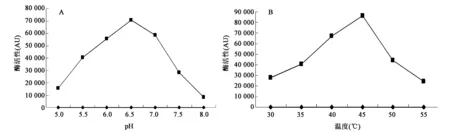
图3 融合酶体外酶促反应的最适条件Fig.3 Optimal conditions of fusion enzyme enzymatic reaction in vitroA:融合酶体外酶促反应pH曲线;B:融合酶体外酶促反应温度曲线。
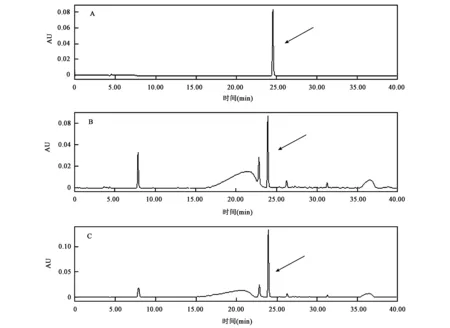
图4 融合蛋白体外酶促产物高效液相色谱图Fig.4 HPLC analysis of fusion enzyme reaction product in vitro enzymatic.A:白藜芦醇标准品HPLC图;B:融合蛋白体外酶促反应产物HPLC图;C:融合蛋白体外酶促反应产物与白藜芦醇标准品共色谱图;箭头所指均为白藜芦醇。
3讨论
白藜芦醇具有抗肿瘤、抗氧化、保护心血管、调节脂质代谢等多种生物功能活性[15,16],利用微生物工程提高白藜芦醇产量备受研究者的关注。Becker等[17]将杨树(Populus)辅酶A连接酶基因(4CL216)和白藜芦醇合酶基因(vst1)共转化到酿酒酵母中,添加4-香豆酸前体,得到1.5 μg/L白藜芦醇。同样,Watts等[18]将拟南芥(Arabidopsisthaliana)4CL与花生(Arachishypogaea)STS基因转化至代谢工程大肠杆菌(JM109),在添加底物4-香豆酸的情况下生成白藜芦醇的量超过了100 mg/L。而将来自被修饰的紫草(Lithospermumerythrorhizon)4CL基因和花生STS基因转化至同一株大肠杆菌(JM109)时,白藜芦醇产量达到171 mg/L[19]。进一步揭示了来自不同物种的4CL与STS融合基因的催化活性有着显著的差别。研究发现,虎杖(Polygonumcuspidatum)是已知白藜芦醇含量最高的植物[20]。在同一催化体系下,虎杖STS催化效率(Kcat/Km)是葡萄STS的2.4倍[21]。Robison[22]将G、S、T组成不同长度的Linker来研究其对蛋白活性的影响,结果表明Linker的长度不同会影响融合蛋白的活性,氨基酸长度≥13时具有野生型生物活性,当长度比较短时只具有部分或不具有生物学活性。
本研究将烟草4CL与较高活性虎杖STS基因通过3个氨基酸长度的Linker连接,并在原核表达系统中表达,融合酶在体外酶促反应中能有效催化4-香豆酸与丙二酰辅酶A生成白藜芦醇,有利的证实了融合蛋白Nt4CL-PcPKS5同时具有4CL和STS的双重活性。Zhang等[10]将拟南芥4CL与葡萄(Vitisvinifera)STS两个酶基因融合,获得融合基因At4CL-VvSTS,构建融合基因表达载体,转化酿酒酵母菌WAT11,得到的白藜芦醇表达量高达5.25 μg/mL,是共表达At4CL和VvSTS两个单酶的15倍,这一结果说明融合酶活性要远高于单酶活性。Wang等[23]在研究融合蛋白的晶体结构和酶促动力学中发现融合酶4CL/STS催化活性高于STS。对于STS的底物4-香豆酰辅酶A和丙二酰辅酶A而言,融合酶4CL/STS的催化效率(Kcat/Km)较STS相比分别高出2.33倍和1.29 倍。Nt4CL-PcPKS5酶促动力学,以及构成融合蛋白Linker的氨基酸长度和组成类型是否影响融合酶的活性还有待于进一步研究。本研究为利用融合酶基因转化工程菌株生产白藜芦醇提供了基础。较单酶转化相比,融合酶的转化可减少表达载体的数量,从而简化了代谢途径。
参考文献
[1]付元庆, 李 铎. 白藜芦醇[J]. 营养学报, 2014,36: 13-16.
[2]Sobolev V S, Cole R J. Trans-resveratrol content in commercial peanuts and peanut products[J]. J. Agric. Food Chem., 1999, 47(4):1435-1439.
[3]Nonomura S, Kanagawa H, Makimoto A. Chemical constituents of polygonaceous plants. I. Studies on the components of Ko-JO-Kon (PolygonumcuspidatumSieb. Et Zucc.)[J]. Yakugaku Zasshi., 1963, 83: 988-990.
[4]Langcake P, Pryce R J. The production of resveratrol byVitisviniferaand other members of the vitaceae as a response to infection or injury [J]. Physiol. Plant Pathol., 1976, 9: 77-86.
[5]Jang M, Cai L, Udeani G O,etal.. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes[J]. Science, 1997, 275(5297): 218-220.
[6]Stef G, Csiszar A, Lerea K,etal.. Resveratrol inhibits aggregation of platelets from high-risk cardiac patients with aspirin resistance[J]. J. Cardiovasc. Pharmacol., 2006, 48(2):1-5.
[7]Timmers S, Konings E, Bilet L,etal.. Calorie restriction-like effect of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans[J]. Cell Metab., 2011, 14(5): 612-622.
[8]王永智. 酿酒酵母生产白藜芦醇关键酶基因4CLc DNA的克隆与转化[D]. 西安:西北大学, 硕士学位论文, 2009.
[9]柳忠玉. 虎杖PcRS和PcPKS1基因在白藜芦醇生物合成中的调控作用 [D] .广州: 华南理工大学, 博士学位论文, 2012.
[10]Zhang Y, Li SZ, Li J,etal.. Using unnatural protein fusions to engineer resveratrol biosynthesis in yeast and mammalian cells[J]. J. Am. Chem. Soc., 2006,128(40):13030-13031.
[11]Donnez D, Jeandet P, Clement C,etal.. Bioproduction of resveratrol and stilbene derivatives by plant cells and microorganisms[J]. Trends Biotechnol., 2009, 27(12): 706-713.
[12]Hölsch K, Weuster-Botz D. Enantioselective reduction of prochiral ketones by engineered bifunctional fusion proteins[J]. Biotechnol. Appl. Biochem., 2010, 56(4): 131-140.
[13]Carlsson H, Ljung S, Bülow L. Physical and kinetic effects on introduction of various linker regions in beta-galactosidase galactose dehydrogenase fusion enzymes[J]. Biochim. Biophys. Acta, 1996, 1293(1): 154-160.
[14]张 红,刘霄霄,解语晨,等.烟草4CL与虎杖STS融合基因原核表达载体的构建[J]. 北京农学院学报,2013,28(3):1-6.
[15]唐传核,杨晓泉.葡萄及葡萄酒生物活性物质的研究概况.(II)抗氧化以及预防心血管疾病效果[J].中国食品添加剂, 2003,2: 48-55.
[16]郑世刚,李 臻,赵善仓,等.白藜芦醇合成酶基因在基因工程中的应用及功能研究进展[J]. 生物工程学报,2014, 30(3): 341-354.
[17]Becker J V, Armstrong G O, van der Merwe M J,etal.. Metabolic engineering ofSaccharomycescerevisiaefor the synthesis of the wine-related antioxidant resveratrol[J]. FEMS Yeast Res., 2003, 4(1): 79-85.
[18]Kevin T W, Pyung C L, Claudia S,etal.. Biosynthesis of plant-specific stilbene polyketides in metabolically engineeredEscherichiacoli[J]. BMC Biotechnol., 2006, 6(1): 1-12.
[19]Katsuyama Y, Funa N, Miyahisa I,etal.. Synthesis of unnatural flavonoids and stilbenes by exploiting the plant biosynthetic pathway inEscherichiacoli[J]. Chem. Biol., 2007,14(6): 613-621.
[20]夏海武,吕柳新. 虎杖不同部位白藜芦醇含量的分析[J]. 植物资源与环境学报, 2005, 14(3): 55-56.
[21]郭辉力,罗在柒,杨亚东,等.两种不同植物来源白藜芦醇生物合成关键酶:芪合酶催化效率比较[J]. 生物工程学报,2014, 30(10): 1622-1633.
[22]Robinson C R, Sauer R T. Optimizing the stability of single-chain protein by linker length and composition mutagenesis[J]. Proc. Natl. Acad. Sci. USA, 1998, 95(11): 5929-5934.
[23]Wang Y, Yi H, Wang M,etal.. Structural and kinetic analysis of the unnatural fusion protein 4-coumaroyl-coA ligase-stilbene synthase[J]. J. Am. Chem. Soc., 2011, 133(51): 20684-20687.
Fusion Expression and Functional Analysis ofNicotianatabacumNt4CLandPolygonumcuspidatumPcSTSGene
LIU Wen-bin1, GUO Hui-li2, LIU Huan1, HUANG Li-na2, ZHANG Fen-qiang1, MA Lan-qing2*
1.PlantScienceandTechnologyCollege,BeijingUniversityofAgriculture,Beijing102206,China;
2.KeyLaboratoryofUrbanAgriculture(North),MinistryofAgriculture,CollegeofBiologicalScienceandEngineering,BeijingUniversityofAgriculture,Beijing102206,China
Abstract:4-coumarate coenzyme A ligase (4CL) and stilbene synthase (STS) are two key final rate-limiting enzymes in the resveratrol phenylalanine metabolic synthesis. In this paper, Nicotiana tabacum 4CL and Polygonum cuspidatum PKS5 were fused together by overlap PCR with three amino acids to construct fusion gene Nt4CL-PcPKS5. The fusion gene was subcloned into pET30a, the recombinant plasmid pET30a-Nt4CL-PcPKS5 was analyzed through heterologous expression in Escherichia coli. The expression product was purified with Ni(2+) affinity column and desalted through PD-10 column. The collected target fusion protein was used for enzymatic reaction in vitro. The enzymatic product analysis showed that the fusion protein showed the activities of both 4CL and STS. The final product was resveratrol. The optimum pH and reaction temperature were 6.5 and 45℃. In this study, a bifunctional fusion enzyme catalyzing resveratrol biosynthesis was obtained, which proved a basis for realizing industrial production of resveratrol.
Key words:resveratrol; fusion gene; prokaryotic expression; enzymatic reaction
DOI:10.3969/j.issn.2095-2341.2016.02.03
作者简介:刘文彬,硕士研究生,研究方向为果品优质生态安全。E-mail: lwb8002@126.com。*通信作者:马兰青,教授,研究方向为植物次生代谢分子调控。E-mail:lqma@bac.edu.cn
基金项目:国家自然科学基金(31300620;31370674);北京市自然科学基金重点项目(5111001);北京市教委面上项目(KM201310020002;KM201310020015;KM201110020001;KM201210020009);北京市属高校人才强教深化计划项目(PHR201108279)资助。
收稿日期:2015-12-15; 接受日期:2015-01-07

