谷胱甘肽硫转移酶A1(GSTA1)基因多态性与前列腺癌和膀胱癌易感性的Meta分析
谭于龙 钱辉军
430060 武汉大学人民医院
谷胱甘肽硫转移酶A1(GSTA1)基因多态性与前列腺癌和膀胱癌易感性的Meta分析
谭于龙钱辉军
430060 武汉大学人民医院
【摘要】目的探讨谷胱甘肽硫转移酶A1(GSTA1)基因多态性与前列腺癌及膀胱癌易感性的关系。方法通过检索PubMed等数据库,获取GSTA1基因多态性与前列腺癌或膀胱癌的文献9篇,对1989例病例和2246例对照进行meta分析,以比值比(OR)和95%可信区间(CI)作为效应指标。结果各遗传模型的Meta分析显示:GSTA1基因多态性与前列腺癌易感性的相关性无统计学意义[(AA vs BB:OR=0.92,95%CI:0.68~1.23,P=0.56);(AB vs BB:OR=1.02,95%CI:0.86~1.21,P=0.83);(AA/AB vs BB OR=1.01,95%CI:0.86~1.17,P=0.93);(AA vs AB/BB:OR =0.91,95%CI:0.69~1.20,P=0.51)]。各遗传模型的Meta分析显示:GSTA1基因多态性与膀胱癌易感性的相关性无统计学意义[(AA vs BB:OR=0.97,95%CI:0.71~1.33,P=0.85);(AB vs BB:OR=1.11,95%CI:0.93~1.31,P=0.25);(AA/AB vs BB OR=1.07,95%CI:0.92~1.25,P=0.37);(AA vs AB/BB:OR =0.87,95%CI:0.64~1.18,P=0.37)]。结论单独的GSTA1基因多态性不是前列腺癌和膀胱癌的易感因素。
【关键词】谷胱甘肽硫转移酶A1;基因多态性;前列腺癌;膀胱癌;肿瘤易感性 为谷胱甘肽硫转移酶A1(glutathione S-transferase A1/GSTA1)、基因多态性(polymorphism)、前列腺癌(prostate cancer)、膀胱癌(bladder cancer)、肿瘤易感性(cancer susceptibility)及其相应MeSH词汇。计算机检索PubMed、Embase、Highwire、Cochrane library、中国知网、维普、万方医学网、中国生物医学文献数据库。
(ThePracticalJournalofCancer,2016,31:417~420)
前列腺癌和膀胱癌是泌尿生殖系统常见的肿瘤。尽管对前列腺癌和膀胱癌的病因进行了大量的研究,但各研究的结果并不一致。一些基因具有多态性,其编码的酶参与致癌物的生物转化,包括谷胱甘肽硫转移酶(glutathione S-transferases/GSTs)。GSTs是参与体内Ⅱ相反应的重要的代谢酶,能够对多种遗传毒性物质进行解毒,并且能有效对抗活性氧簇(reactive oxygen species/ROS)的氧化作用[1]。GSTA1(ID:2938;定位于染色体6p12.1)基因有2个等位基因,即GSTA1*A和GSTA1*B,有4个单核苷酸多态性(single nucleotide polymorphisms/SNPs)位点,即exon5的沉默的碱基替换以及-631T/G、-567 T/G、-69 C/T、-52 G/A。虽然对基因多态性影响基因表达的机制并不十分清楚,但有研究明确表明,-52A转换为-52G会阻止转录因子(Sp1)与启动子位点的结合,下调GSTA1基因的表达[2]。人体内的GSTA1主要存储于肝脏,GSTA1表达不足可导致致癌物在体内堆积,从而增加了癌症的发生风险[3]。
1材料与方法
1.1文献获取
1.2纳入文献的筛选
纳入标准:①涉及GSTA1基因多态性与前列腺癌或膀胱癌的易感性;②研究对象为人类;③病例-对照研究;④各研究的设计和方法类似,便于提取数据;⑤重复发表的文献,选取发表时间最新和质量更高的文献。排除标准:①无法提取可用于分析的数据;②病例报道、综述、meta分析等;③研究对象不是人类或未设立对照组。
1.3文献质量评价及资料提取
质量评价标准:①是否为大样本文献(n≥50);②疾病的诊断是否得到病理检查确认;③试验设计是否科学并与同类研究具有可比性。两名研究者独立提取数据,由另外一位研究者核实数据。资料提取内容:第一作者姓名、文献发表时间、国家或地区、研究的疾病、病例组和对照组各基因型的例数。
1.4统计学分析
应用STATA 12.0软件,先用卡方检验衡量各研究之间的异质性,若P>0.05 时则采用固定效应模型,否则判定为有明显的异质性并使用随机效应模型,并使用I2衡量异质性的大小。合并效应量采用OR值和95%CI 表示,以P<0.05为差异有统计学意义。漏斗图和Egger检验评估文献潜在的发表偏倚,P<0.10则提示有潜在的发表偏倚。
2结果
2.1入选文献的情况
按照关键词检索出的文献共58篇,根据纳入和排除标准筛选后获得的文献共9篇[4-12],均为英文文献,且均为大样本量的病例对照研究(所用分析文献)。累及的病例和对照数量分别为1989例和2246例。纳入分析的基本情况见表1。
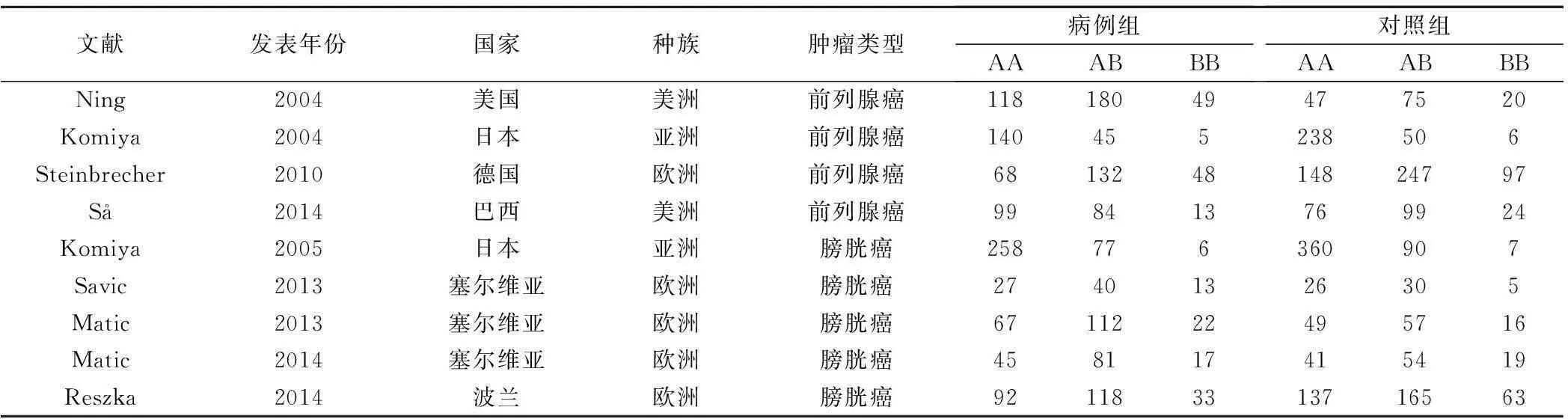
表1 纳入文献的基本情况
2.2meta分析结果
研究GSTA1与前列腺癌的文献4篇,累计病例981例和对照1127例。提取的数据在AA vs BB、AB vs BB、AA/AB vs BB、AA vs AB/BB基因型的比较模型中进行分析,各遗传模型Meta分析结果显示:GSTA1基因多态性与前列腺癌的遗传易感性无相关性[(AA vs BB:OR=0.92,95%CI:0.68~1.23,P=0.56);(AB vs BB:OR=1.02,95%CI:0.86~1.21,P=0.83);(AA/AB vs BB OR=1.01,95%CI:0.86~1.17,P=0.93);(AA vs AB/BB:OR =0.91,95%CI:0.69~1.20,P=0.51)]。AA/AB vs BB模型分析见图1。
研究GSTA1与膀胱癌的文献5篇,累计病例1008例和对照1119例,提取的数据在AA vs BB、AB vs BB、AA/AB vs BB、AA vs AB/BB基因型的比较模型中进行分析,各遗传模型Meta分析结果显示,GSTA1基因多态性与膀胱癌的遗传易感性无相关性[(AA vs BB:OR=0.97,95%CI:0.71~1.33,P=0.85);(AB vs BB:OR=1.11,95%CI:0.93~1.31,P=0.25);(AA/AB vs BB OR=1.07,95%CI:0.92~1.25,P=0.37);(AA vs AB/BB:OR =0.87,95%CI:0.64~1.18,P=0.37)]。AA vs BB模型分析见图2。
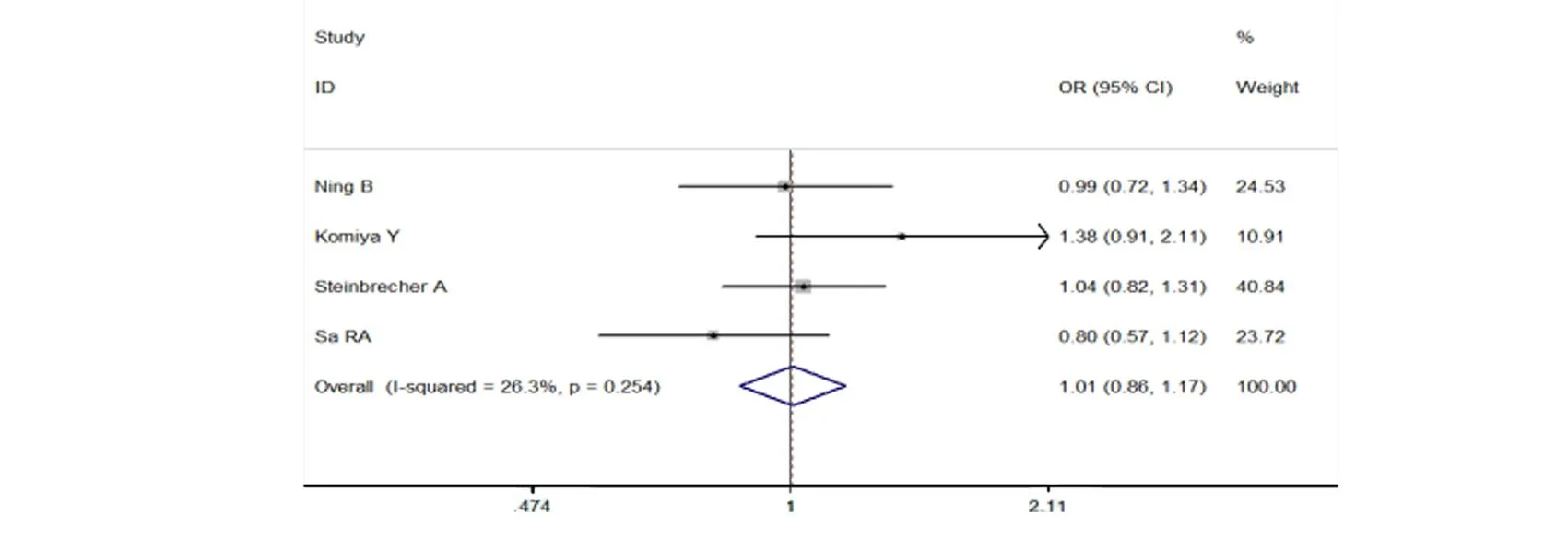
图1 GSTA1基因多态性与前列腺癌易感性的Meta分析森林图

图2 GSTA1基因多态性与膀胱癌易感性的Meta分析森林图
2.3敏感性分析及发表偏倚分析
通过逐一剔除各单个研究,其他研究合并的OR值及95%CI 在整个人群中并未受到明显的影响,认为最后的合并效应量比较稳定。使用Begg检验分别绘制2种肿瘤的4种遗传模型的漏斗图,显示所有模型的漏斗图基本对称,Egger法线性回归模型定量分析显示没有显著的发表偏倚,表明结论有较好的可信度,见图3及图4。
3讨论
GSTs是一组二聚体酶,根据酶的底物特性、化学结构等可分为8种,即GSTA、GSTK、GSTM、GSTP、GSTO、GSTS、GSTT、GSTZ。致癌物的代谢包括Ⅰ相反应和Ⅱ相反应,在Ⅰ相反应中经过Ⅰ相反应酶(例如细胞色素P450)的催化而活化,然后在Ⅱ相反应中经过Ⅱ相反应酶(例如GSTs)催化致癌物发生结合反应,在这个过程中致癌物被灭活,并且水溶性增加而有利于机体排出,是机体抵抗外源有毒物质的关键步骤。另外,有研究表明,GSTs参与细胞内对类固醇激素的运输。在有前列腺癌遗传倾向的个体,如果长期暴露于致癌物质、雄激素及雄激素代谢产物,罹患前列腺癌的风险会急剧升高[13]。由于尿路上皮细胞不表达GSTA1,不能有效将致癌物解毒,增加了膀胱癌的患病风险[8]。寻找与前列腺癌和膀胱癌的发生和发展有关的基因标志物显得尤为重要,将使我们能够筛选出具有遗传易感性的群体,并采取针对性的预防措施。
有研究发现,在与慢性炎症有关的氧化应激和增生肥大中,GSTA1的表达上升,而在前列腺癌的上皮组织内的表达却下降,提示前列腺癌的发生过程涉GSTA1表达的改变。多环芳香烃(polycyclic aromatic hydrocarbons/PAHs)是GSTA1的底物之一,在PAHs的转换为苯醌的过程可产生ROS,导致DNA加合物的形成,影响DNA的正常功能[14]。在细胞向恶性转化的过程中,细胞的氧化还原状态不稳定,此时容易发生活性氧簇介导的DNA损伤、基因突变以及DNA结构的改变。此外,氧化应激不仅参与癌症的起始,还通过活性氧簇引起基因表达的异常和信号通路的改变,导致细胞增殖或减少凋亡,从而推动癌症的进展。

图3 GSTA1基因多态性与前列腺癌易感性Meta分析漏斗图

图4 GSTA1基因多态性与膀胱癌易感性Meta分析漏斗图
尽管经过精心设计,但本研究还是存在很多局限。有研究表明,GSTA1、GSTP1、GSTM1、GSTT1基因多态性都不是前列腺癌或膀胱癌的独立危险因子,癌症的发生与发展涉及基因-基因以及基因-环境的交互作用,而本研究纳入分析的文献缺乏基因基因以及基因环境交互作用的数据。
参考文献
[1]Sohn SW,Jung JW,Lee SY,et al.Expression pattern of GSTP1 and GSTA1 in the pathogenesis of asthma〔J〕.Exp Lung Res,2013,39(4-5):173-181.
[2]Reljic Z,Zlatovic M,Savic-Radojevic A,et al.Is increased susceptibility to Balkan endemic nephropathy in carriers of common GSTA1(*A/*B) polymorphism linked with the catalytic role of GSTA1 in ochratoxin a biotransformation Serbian case control study and in silico analysis〔J〕.Toxins(Basel),2014,6(8):2348-2362.
[3]Sergentanis TN,Economopoulos KP.GSTT1 and GSTP1 p-
olymorphisms and breast cancer risk:a meta-analysis〔J〕.Breast Cancer Res Treat,2010,121(1):195-202.
[4]Så RA,Moreira Ados S,Cabello PH,et al.Human glutathi one S-transferase polymorphisms associated with prostate
cancer in the Brazilian population〔J〕.Int Braz J Urol,2014,40(4):463-473.
[5]Reszka E,Jablonowski Z,Wieczorek E,et al.Polymorphis-
ms of NRF2 and NRF2 target genes in urinary bladder cancer patients〔J〕.J Cancer Res Clin Oncol,2014,140(10):1723-1731.
[6]Matic MG,Coric VM,Savic-Radojevic AR,et al.Does occupational exposure to solvents and pesticides in association with glutathione S-transferase A1,M1,P1,and T1 polymorphisms increase the risk of bladder cancer The Belgrade case-control study〔J〕.PLoS One,2014,9(6):e99448.
[7]Matic M,Pekmezovic T,Djukic T,et al.GSTA1,GSTM1,GSTP1,and GSTT1 polymorphisms and susceptibility to smoking-related bladder cancer:a case-control study〔J〕.Urol Oncol,2013,31(7):1184-1192.
[8]Savic-Radojevic A,Djukic T,Simic T,et al.GSTM1-null and GSTA1-low activity genotypes are associated with enhanced oxidative damage in bladder cancer〔J〕.Redox Rep,2013,18(1):1-7.
[9]Steinbrecher A,Rohrmann S,Timofeeva M,et al.Dietary glucosinolate intake,polymorphisms in selected biotransformation enzymes,and risk of prostate cancer〔J〕.Cancer Epidemiol Biomarkers Prev,2010,19(1):135-143.
[10]Komiya Y,Tsukino H,Nakao H,et al.Human glutathion S-transferase A1 polymorphism and susceptibility to urothelial cancer in the Japanese population〔J〕.Cancer Lett,2005,221(1):55-59.
[11]Komiya Y,Tsukino H,Nakao H,et al.Human glutathione S-transferase A1,T1,M1,and P1 polymorphisms and susceptibility to prostate cancer in the Japanese population〔J〕.J Cancer Res Clin Oncol,2005,131(4):238-242.
[12]Ning B,Wang C,Morel F,et al.Human glutathione S-transferase A2 polymorphisms:variant expression,distribution in prostate cancer cases/controls and a novel form〔J〕.Pharmacogenetics,2004,14(1):35-44.
[13]Hötker AM,Mazaheri Y,Zheng J,et al.Prostate Cancer:assessing the effects of androgen-deprivation therapy using quantitative diffusion-weighted and dynamic contrast-enhanced MRI〔J〕.Eur Radiol,2015,25(9):2665-2672.
NA adduct formation and risk of bladder cancer〔J〕.Cancer Epidemiol Biomarkers Prev,2007,16(10):2155-2159.
(编辑:吴小红)
The Relationship between Glutathione S-transferase A1(GSTA1)Polymorphism and Susceptibility to Prostate Cancer and Bladder Cancer:a Meta-analysis
TANYulong,QIANHuijun.
RenminHospitalofWuhanUniversity,Wuhan,430060
【Abstract】ObjectiveTo explore the association between genetic polymorphism of glutathione S-transferase A1(GSTA1) and susceptibility to prostate cancer and bladder caner.MethodsPubMed and other databases were searched,identified 9 relevant literatures of relationship between genetic polymorphism of glutathione S-transferase A1(GSTA1) and susceptibility to prostate cancer and bladder caner,containing 1989 cases and 2246 controls.Meta-analysis was applied,and odds ratio(ORs) with 95% confidence intervals(CIs) was used to evaluate the connection.ResultsThere was no significant association between GSTA1 polymorphism and susceptibility to prostate cancer[(AA vs BB:OR=0.92,95%CI:0.68~1.23,P=0.56);(AB vs BB:OR=1.02,95%CI:0.86~1.21,P=0.83);(AA/AB vs BB OR=1.01,95%CI:0.86~1.17,P=0.93);(AA vs AB/BB:OR =0.91,95%CI:0.69~1.20,P=0.51)].No statistical significance existed between GSTA1 polymorphism and susceptibility to bladder cancer[(AA vs BB:OR=0.97,95%CI:0.71~1.33,P=0.85);(AB vs BB:OR=1.11,95%CI:0.93~1.31,P=0.25);(AA/AB vs BB OR=1.07,95%CI:0.92~1.25,P=0.37);(AA vs AB/BB:OR =0.87,95%CI:0.64~1.18,P=0.37)].ConclusionGSTA1 polymorphism is not the independent risk factor for prostate cancer and bladder cancer.
【Key words】Glutathione S-transferase A1;Polymorphism;Prostate cancer;Bladder cancer;Cancer susceptibility
(收稿日期2015-04-20修回日期 2015-09-28)
中图分类号:R737
文献标识码:A
文章编号:1001-5930(2016)03-0417-04
DOI:10.3969/j.issn.1001-5930.2016.03.020
通讯作者:钱辉军

