钙化性主动脉瓣疾病患者血清免疫球蛋白E水平的变化
郑韵仪,曾庆春,詹琼,朱丁季,华经海,周浩斌,安冬琪,刘祖恒,赖文岩,许顶立
钙化性主动脉瓣疾病患者血清免疫球蛋白E水平的变化
郑韵仪,曾庆春*,詹琼,朱丁季,华经海,周浩斌,安冬琪,刘祖恒,赖文岩,许顶立
摘要
关键词心脏瓣膜疾病;动脉粥样硬化;免疫球蛋白E;肥大细胞;炎症
作者单位:510515 广东省广州市,南方医科大学南方医院 心内科
Alterated Serum Levels of Immunoglobulin E in Patients With Calcific Aortic Valve Disease
ZHENG Yun-yi,ZENG Qing-chun,ZHAN Qiong,ZHU Ding-ji,HUA Jing-hai,ZHOU Hao-bin,AN Dong-qi,LIU Zu-heng,
LAI Wen-yan,XU Ding-li.
Department of Cardiology,Nanfang Hospital,Southern Medical University,Guangzhou(510515),Guangdong,China
Corresponding Author:XU Ding-li,Email:dinglixu@fimmu.com
Abstract
Objective:To explore the relationship between serum levels of immunoglobulin E(IgE)and calcific aortic valve disease(CAVD)in relevant patients.
Methods:A total of 394 patients were enrolled in our study.Based on echocardiography presentation,the patients were divided into 2 groups:CAVD group,n=169 and Non-CAVD group,n=225.Serum levels of IgE were examined by chemiluminescence method.The IgE levels were compared between 2 groups and the relationship between serum IgE level and CAVD was analyzed.
Results:Serum levels of IgE in CAVD group was significantly higher than Non-CAVD group 113.30 IU/ml vs 63.76 IU/ml(P<0.05);multivariate logistic regression analysis confirmed above difference(P<0.05)and it also indicated that the alteration of surum IgE level is obviously related to CAVD occurrence.
Conclusion:Serum IgE level is obviously increased in CAVD patients.IgE is an independent biochemical indicator of CAVD,it may play the important role in CAVD pathogenesis.
Key words Heart valve diseases;Atherosclerosis;Immunoglobulin E;Mast cell;Inflammation
(Chinese Circulation Journal,2016,31:263.)
钙化性主动脉瓣疾病(CAVD)包括主动脉瓣钙化与钙化性主动脉瓣狭窄,是一种慢性进展性疾病,其病理生理改变主要表现为主动脉瓣进行性增厚钙化、活动受限、左心室流出道梗阻、心功能不全乃至心力衰竭[1]。组织病理学研究显示,早期CAVD的病变机制可能与动脉粥样硬化相类似,符合经典的“损伤应答假说”[2-4],而晚期则与骨形成过程相类似[5-7]。
肥大细胞来源于造血干细胞,含有特定的胞质颗粒,其中贮存有炎症介质和细胞因子如糜蛋白酶、胰蛋白酶、组胺、肝素和肿瘤坏死因子α等。免疫球蛋白E(IgE)可特异性与肥大细胞膜表面Fc段高亲和力受体(FcεR I)结合导致肥大细胞激活,并释放各种炎症性介质和细胞因子等,从而导致动脉血管平滑肌增生和组织损伤[8]。已有研究报告,肥大细胞数量与主动脉瓣钙化严重程度密切相关,且主要分布在钙化灶周围[9],推测在主动脉瓣钙化过程中可能起重要作用。IgE是肥大细胞最重要的激活因子,故探讨血清IgE水平与CAVD的关系具有重要的临床意义。本研究旨在分析血清IgE在CAVD患者和非CAVD(non-CAVD)患者中的水平,探讨血清IgE水平与CAVD的关系。
1 资料与方法
病例选择与分组:本研究收集南方医科大学南方医院2012-01-01至2014-10-31曾进行血清IgE检查的患者数据,严格把握排除标准,把符合排除标准的患者剔除。既往研究显示年龄与瓣膜钙化有相关性,故将患者年龄控制在46岁及以上,将年龄低于46岁的患者排除在外。因此,此次研究共有394例符合入选标准的患者,其中男285例,女109例,患者年龄最小46岁,最大97岁,平均年龄70.95岁。入选的患者均于南方医科大学南方医院进行完整的经胸超声心动图检查,包括M型、二维和多普勒超声心动图。根据超声心动图检查结果,本研究将年龄和性别相匹配的入选患者分为CAVD组(n=169)和non-CAVD组(n=225)。
排除标准:患有过敏性疾病(哮喘急性发作、过敏性鼻炎等)、重症肺炎等急性感染(细菌、病毒、真菌、不典型病原体)、自身免疫性疾病急性发作、关节炎急性发作[明确关节炎病史和(或)类风湿因子阳性]等疾病的患者排除。
CAVD的诊断标准:根据完整的经胸超声心动图检查结果诊断。患者取左侧卧位及平卧位,分别进行左心室长轴、心尖四腔、心尖五腔、大动脉短轴及胸骨短轴切面检查,判定CAVD的标准为:除外风湿性心脏病,感染性心内膜炎及其他疾病所致的主动脉瓣疾病,主动脉瓣表现为:主动脉瓣膜局限性或弥漫回声增强[凡瓣或环的回声强度(EV)≥同一切面主动脉根部后壁回声(Eaor),即EV≥Eaor,则认为瓣叶或瓣环钙化]且瓣膜增厚(≥2 mm),瓣叶活动不受限制,跨瓣血流速率<2.5 m/s、瓣口面积≥3 cm2为主动脉瓣钙化;跨瓣血流速率 ≥2.5 m/s、瓣口面积<3 cm2为钙化性主动脉瓣狭窄[8]。
资料收集:由心内科专业医师详细记录患者的基本信息,包括姓名、年龄、性别、联系电话、ID号,住院号等。所有患者于入院次日清晨静息状态下空腹采集静脉血,送至南方医科大学南方医院检验科检验,用化学发光法测定IgE,仪器为瑞士罗氏Cobas 601全自动化学发光分析仪,单位为IU/mL。甘油三酯、总胆固醇、低密度脂蛋白胆固醇、降钙素原、C反应蛋白等用全自动生化分析仪(Olympus AU5421)测定。所有数据检测均在我院检验科盲法完成。
统计学处理:结果采用统计学软件SPSS 20.0进行处理。符合正态性分布的参数以均数±标准差表示,不符合正态性分布的参数以中位数表示。方差齐性检验采用Levene法,符合正态分布的两独立样本的比较采用两独立样本t检验,非正态分布数据两样本的比较采用非参数检验中Mann-Whitney U检验。两独立样本性别的比较采用卡方检验。根据t检验和非参数检验中有意义的指标建立了多因素Logistic回归模型,分析各指标与CAVD的关系。所有检验均为双侧检验,P<0.05认为差异有统计学意义。
2 结果
CAVD组及non-CAVD组患者年龄和性别比较:CAVD组男性126例,女性43例,年龄最大90岁,最小46岁,中位年龄73.00岁。non-CAVD组男性159例,女性66例,年龄最小58岁,最大97岁,中位年龄70.59岁。非参数检验中Mann-Whitney U检验表明,CAVD组与non-CAVD组患者年龄之间的差异无统计学意义(Z值为-1.810,P>0.05)。卡方检验提示,两组间性别的差异亦无统计学意义(χ2值为0.730,P>0.05)。
CAVD组及non-CAVD组患者血液检查各指标水平比较(表1、表2):经正态性检验发现,IgE、甘油三酯、降钙素原、C反应蛋白不符合正态分布,用中位数表示;总胆固醇、低密度脂蛋白胆固醇符合正态分布,用均数和标准差表示。Mann-Whitney U检验表明,CAVD组患者血清IgE水平明显高于non-CAVD组患者(113.30 IU/ml vs 63.76 IU/ml,P<0.05);两组间C反应蛋白水平差异也有统计学意义(14.80 mg/L vs 6.60 mg/L,P<0.05);两组间甘油三酯、降钙素原水平的差异无统计学意义(表1)。两独立样本t检验提示,两组间总胆固醇、低密度脂蛋白胆固醇水平的差异均无统计学意义(P>0.05,表2)。
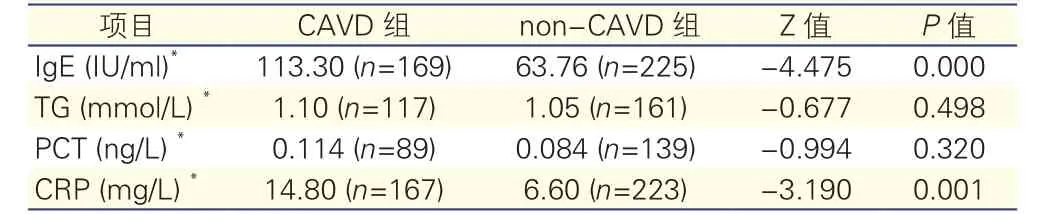
表1 两组患者IgE、甘油三酯、降钙素原、C反应蛋白水平比较(Mann-Whitney U检验)
表2 两组患者总胆固醇和低密度脂蛋白胆固醇水平比较(±s,t检验)
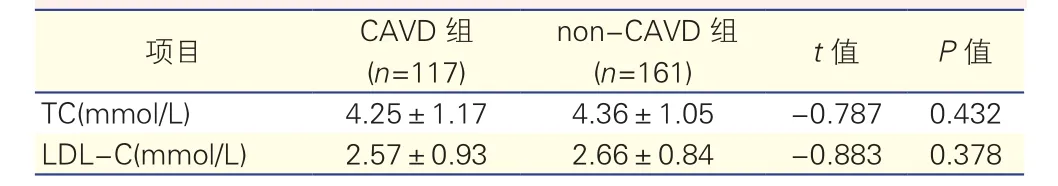
表2 两组患者总胆固醇和低密度脂蛋白胆固醇水平比较(±s,t检验)
注:CAVD:钙化性主动脉瓣疾病;non-CAVD:非钙化性主动脉瓣疾病;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇
项目 (n=117)(n=161) t值 P值TC(mmol/L) 4.25±1.17 4.36±1.05 -0.787 0.432 LDL-C(mmol/L) 2.57±0.93 2.66±0.84 -0.883 0.378
血清IgE水平与CAVD之间的关系(表3):为了解血清IgE水平与CAVD的关系,以CAVD为因变量,IgE、C反应蛋白等多个指标为自变量,建立多因素Logistic回归模型。在回归模型中,CAVD组的IgE水平显著高于non-CAVD组(113.30 IU/ml vs 63.76 IU/ml,P<0.05),CAVD组的C反应蛋白水平也显著高于non-CAVD组(14.80 mg/L vs 6.60 mg/L,P<0.05)。多因素回归分析表明,血清IgE[Exp(B)=1.001,95%可信区间:1.000~1.002,P=0.001]和C反应蛋白水平[Exp(B)=1.005,95%可信区间:1.000~1.009,P=0.040]与CAVD显著相关。
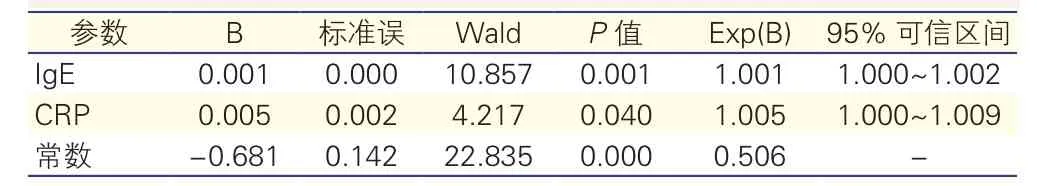
表3 CAVD与血清IgE和C反应蛋白水平的多因素Logistic回归分析结果
3 讨论
国外文献表明,退行性主动脉瓣钙化患病率随年龄增大而增加,且瓣膜钙化的程度随年龄增大而加重,多瓣膜受累的发生率也明显增高[10]。国内外病理报道老年退行性心脏瓣膜病存在性别差异,其中主动脉瓣钙化多见于男性,男女之比为4:1,二尖瓣钙化多见于女性,男女之比为1:2.44[11]。曾有大规模调查研究发现,年龄、男性、高血压、吸烟、脂蛋白A和低密度脂蛋白是主动脉瓣钙化的独立预测因子[12]。为减少年龄对本研究的影响,将入选病例年龄规定在46岁以上。经分析,CAVD组和non-CAVD组患者的年龄和性别无显著差异,提示在本研究中可以排除年龄和性别对血清IgE水平的影响,这为单独分析血清IgE水平与CAVD的关系提供了保证。
排除年龄、性别等因素影响后,U检验结合stic回归分析提示,血清IgE水平是CAVD的独险因素。研究表明,肥大细胞与动脉粥样硬化密切。肥大细胞在正常的动脉管壁上很少出现,但在动脉粥样硬化病变处肥大细胞却明显聚集。肥大细胞通过多种机制被激活后释放细胞因子来诱导血管内皮细胞蛋白酶的表达;释放趋化因子来招募炎性细胞;释放蛋白酶来促进泡沫细胞的形成、血管生成、基质降解、血管内皮细胞凋亡和细胞因子激活,从而参与动脉粥样硬化病变的发生、发展过程[13-15]。国外文献提示,在CAVD发病过程中,肥大细胞在主动脉瓣钙化病灶周围聚集,可能通过血管内皮生长因子、组织蛋白酶G、血管紧张素Ⅱ等机制参与CAVD的发生、发展[16-18]。而IgE可特异性与FcεR I结合导致肥大细胞激活,并释放和合成各种炎症性介质和细胞因子,从而引起一系列的局部或全身反应。CAVD与动脉粥样硬化在发病机制上存在共同点,但组织破坏更严重,相对于动脉粥样硬化,肥大细胞在CAVD发生过程中可能起更重要的作用。本研究证明,CAVD患者血清IgE水平显著高于non-CAVD患者,结合多因素Logistics回归分析结果提示,血清IgE水平是CAVD的独立危险因素,IgE可能在CAVD的发生、发展过程中发挥重要作用。我们可大胆推测,由于肥大细胞是IgE的效应细胞,高水平的IgE可能通过特异性与肥大细胞膜表面的FcεR I结合导致更多的肥大细胞被激活,从而释放和合成各种炎症性介质和细胞因子作用于主动脉瓣,引起一系列的炎症反应,从而促进CAVD的发生、发展。另一方面,IgE可以通过直接作用于内皮细胞和平滑肌细胞,直接导致局部炎症反应,促进动脉粥样硬化的发生、发展[19]。IgE还可能直接作用于主动脉瓣组织的内皮细胞和间质细胞,引起炎症反应,从而促进主动脉瓣钙化病灶的发生、发展。为进一步明确血清IgE水平与CAVD的关系,进一步了解IgE是否通过肥大细胞作用于主动脉瓣,未来研究还将进行病理标本检测,评估钙化性主动脉瓣标本中IgE水平和肥大细胞的数量,同时进行肥大细胞炎症介质、细胞因子如糜蛋白酶、胰蛋白酶、组胺、肿瘤坏死因子、白细胞介素-8等检测。
此外,本研究还纳入了C反应蛋白、降钙素原、甘油三酯、总胆固醇、低密度脂蛋白胆固醇等研究指标。炎症在动脉粥样硬化形成、瓣膜钙化机制中起着重要作用,但炎性标志物如C反应蛋白与瓣膜钙化的关系还存在争议[20,21]。本研究发现,CAVD组与non-CAVD组患者之间的C反应蛋白水平存在显著差异,Logistic回归分析也发现C反应蛋白与CAVD显著相关,可推测C反应蛋白与CAVD密切相关,这可能与炎症在CAVD发生、发展过程中起重要作用有关。根据主动脉瓣钙化的脂质聚集学说,脂质可以激活炎症细胞,促进瓣膜钙化的进展。本研究发现,CAVD组甘油三酯、总胆固醇、低密度脂蛋白胆固醇等血脂指标与non-CAVD组相比也无显著差异,这可能与CAVD组患者多合并心血管系统疾病、长期服用调脂药物以及控制了年龄和性别等混杂因素有关,因此本研究还应完善患者病史采集,明确其药物服用史。
本研究虽然只入选了394例患者,但已经有足够的检验效能得出结论,我们期待更大样本的多中心随机对照研究得出更确切的结论。未来可能需要进行相关细胞实验、构建动物模型来进一步研究IgE在CAVD发病过程中的作用及作用机制。本研究提示,IgE可能在CAVD发生、发展过程中起重要作用,这为进一步阐明CAVD的发病机制提供了新的思路,但具体机制尚有待进一步探讨。
参考文献
[1]Coffey S,Cox B,Williams MJ.The prevalence,incidence,progression,and risks of aortic valve sclerosis:a systematic review and metaanalysis.J Am Coll Cardiol,2014,63:2852-2861.
[2]Otto CM,Lind BK,Kitzman DW,et al.Association of aortic-valve sclerosis with cardiovascular mortality and morbidity in the elderly.N Engl J Med,1999,341:142-147.
[3]Rajamannan NM,Otto CM.Targeted therapy to prevent progression of calcific aortic stenosis.Circulation,2004,110:1180-1182.
[4]Kaden JJ,Dempfle CE,Grobholz R,et al.Inflammatory regulation of extracellular matrix remodeling in calcific aortic valve stenosis.Cardiovasc Pathol,2005,14:80-87.
[5]Freeman RV,Otto CM.Spectrum of calcific aortic valve disease:pathogenesis,disease progression,and treatment strategies.Circulation,2005,111:3316-3326.
[6]刘丽,赵玉生,王士雯.老年退行性心脏瓣膜病钙化的发病机制研究进展.中国循环杂志,2004,19:158-160.
[7]Mohler ER,Gannon F,Reynolds C,et al.Bone formation and inflammation in cardiac valves.Circulation,2001,103:1522-1528.
[8]Erdogan O,Gul C,Altun A,et al.Increased immunoglobulin E response in acute coronary syndromes.Angiology,2003,54:73-79.
[9]Wypasek E,Natorska J,Grudzien G,et al.Mast cells in human stenotic aortic valves are associated with the severity of stenosis.Inflammation,2013,36:449-456.
[10]王彩荣,张蕾.老年人群钙化性心脏瓣膜病的超声所见与常见病相关因素分析.中国超声医学杂志,2003,19:631-632.
[11]Stewart BF,Siscovick D,Lind BK,et a1.Clinical factors associated with calcific aortic valve disease.J Am Coll Cardiol,1997,29:630-634.
[12]Petrovic D,Obrenovic R,Stojimirovic B.Risk factors for aortic valve calcification in patients on regular hemodialysis.Int J Artif Organs,2009,32:173-179.
[13]Sun J,Sukhova GK,Wolters PJ,et al.Mast cells promote atherosclerosis by releasing proinflammatory cytokines.Nat Med,2007,13:719-724.
[14]Wezel A,Quax PH,Kuiper J,et al.The role of mast cells in atherosclerosis.Hamostaseologie,2015,35:113-120.
[15]Wezel A,Laqraauw HM,van der Velden D,et al.Mast cells mediate neutrophil recruitment during atherosclerotic plaque progression.Atherosclerosis,2015,241:289-296.
[16]Syväranta S,Helske S,Laine M,et al.Vascular endothelial growth factor-secreting mast cells and myofibroblasts:a novel selfperpetuating angiogenic pathway in aortic valve stenosis.Arterioscler Thromb Vasc Biol,2010,30:1220-1227.
[17]Helske S,Swäranta S,Kupari M,et al.Possible role for mast cellderived cathepsin G in the adverse remodelling of stenotic aortic valves.Eur Heart J,2006,27:1495-1504.
[18]Helske S,Lindstedt KA,Laine M,et al.Induction of local angiotensin Ⅱ-producing systems in stenotic aortic valves.J Am Coll Cardiol,2004,44:1859-1866.
[19]Wang J,Chenq X,Xiang MX,et al.IgE stimulates human and mouse arterial cell apoptosis and cytokine expression and promotes atherogenesis in Apoe-/-mice.J Clin Invest,2011,121:3564-3577.
[20]Novaro GM,Katz R,Aviles RJ,et al.Clinical factors,but not C-reactive protein,predict progression of calcific aortic-valve disease:the Cardiovascular Health Study.J Am Coll Cardiol,2007,50:1992-1998.
[21]李建军.C反应蛋白:动脉粥样硬化的标志物还是兼具致病作用.中国循环杂志,2009,4:241-243.
(编辑:朱柳媛)
临床研究
收稿日期:(2015-09-18)
中图分类号:R54
文献标识码:A
文章编号:1000-3614(2016)03-0263-04
doi:10.3969/j.issn.1000-3614.2016.03.014
作者简介:郑韵仪 硕士研究生 主要研究方向为心血管内科学 Email:shao.218@qq.com 通讯作者:许顶立 Email:dinglixu@fimmu.com*为并列第一作者
基金项目:国家自然科学基金项目(81270320;81570352)
目的:探讨血清免疫球蛋白E(IgE)水平与钙化性主动脉瓣疾病(CAVD)的关系。
方法:符合入选标准的394例患者根据超声心动图结果分为CAVD组(n=169)和非CAVD组(non-CAVD组,n=225)。采用化学发光法测定血清IgE水平,分析两组患者间血清IgE水平的差异以及血清IgE水平与CAVD之间的关系。
结果:CAVD组患者血清IgE水平显著高于non-CAVD组(113.30 IU/ml vs 63.76 IU/ml,P<0.05),多因素Logistic回归分析也提示两组间血清IgE水平的差异有统计学意义(P<0.05),且血清IgE水平与CAVD显著相关。
结论:CAVD组患者血清IgE水平显著增高;血清IgE水平是提示CAVD的独立生化指标,IgE可能在CAVD的发病过程中起重要作用。

