小花棘豆中毒对大鼠下丘脑—垂体—卵巢轴α-甘露糖苷酶的影响
王 帅, 贾琦珍, 陈根元, 程 勇, 张 玲, 马春晖,3
(1.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆 阿拉尔 843300;2.塔里木大学动物科学学院,新疆 阿拉尔 843300;3.石河子大学动物科技学院,新疆 石河子 832000)
小花棘豆中毒对大鼠下丘脑—垂体—卵巢轴α-甘露糖苷酶的影响
王帅1,2, 贾琦珍1, 陈根元1, 程勇1,2, 张玲1,2, 马春晖1,3
(1.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆 阿拉尔 843300;2.塔里木大学动物科学学院,新疆 阿拉尔 843300;3.石河子大学动物科技学院,新疆 石河子 832000)
摘要:将144只雌性大鼠随机分为4组,即对照组和试验Ⅰ、Ⅱ、Ⅲ组.将小花棘豆全草粉碎后,按Ⅰ组添加15%(含苦马豆素30 mg·kg(-1))、Ⅱ组添加30%(含苦马豆素60 mg·kg(-1))、Ⅲ组添加45%(含苦马豆素90 mg·kg(-1))的比例制作混合饲料,饲喂至典型中毒症状出现为止.攻毒后每7 d每组随机采集4只大鼠的下丘脑、垂体和卵巢,检测其AMA活性及表达的变化.结果表明,试验及对照大鼠下丘脑—垂体—卵巢轴高尔基体α-甘露糖苷酶Ⅱ(AMA1)和溶酶体α-甘露糖苷酶(AMA2)均有表达,但各试验组表达转录水平与对照组差异显著,试验Ⅰ组大鼠HPOA的AMA1及AMA2的表达均与对照组差异不显著(P>0.05),但试验Ⅱ组大鼠HPOA的AMA1以及试验Ⅲ组大鼠HPOA的AMA1、AMA2相对表达均显著低于对照(P<0.05),而且随着试验的进行抑制效果愈加明显.结果表明,小花棘豆中毒可影响大鼠HPOA中AMA的活性及其基因的转录表达.
关键词:小花棘豆; 苦马豆素; α-甘露糖苷酶; 下丘脑—垂体—卵巢轴
小花棘豆(OxytropisglabraDC)是新疆南疆地区分布最为广泛的有毒植物,具有耐旱、耐贫瘠、返青早、生命力强、繁殖系数高等多种特性,现已严重危害新疆草原畜牧业的发展[1].目前仅新疆阿克苏地区天然草场分布面积就超过20%,每年因采食小花棘豆而中毒的家畜占放牧家畜总数的5%-10%,其中约50%的中毒家畜死亡.中毒家畜表现为机体的广泛性损伤,其中尤以神经系统和繁殖系统损伤最为明显[2].国内外研究表明,苦马豆素(Swainsonine, SW)是小花棘豆的主要毒性成分[3],可通过抑制α-甘露糖苷酶(α-mannosidase, AMA)活性,导致机体甘露糖代谢发生异常而发挥毒性作用[4,5].研究表明,AMA是动物小花棘豆中毒特异性最强的指标[6],小花棘豆中毒动物的AMA活性受到显著抑制,但对其转录、翻译、加工修饰等的影响尚不清楚,中毒动物繁殖系统AMA活性及表达的变化未见报道.本试验通过ELISA、免疫组化和荧光实时定量PCR法,研究小花棘豆攻毒对大鼠下丘脑—垂体—卵巢轴(hypothalamus-pituitary-ovarian axis, HPOA)AMA活性及分布、表达的影响,为小花棘豆中毒机制的研究提供依据.
1材料与方法
1.1材料
小花棘豆2013年8月采集于阿克苏市乌什县奥特贝希乡,由塔里木大学动物科学学院草业科学学科组鉴定.取植株的地上部分,阴干、保存备用.
AMA检测试剂盒,南京建成生物技术有限公司;S-P超敏组化试剂盒,福州迈新生物技术有效公司;AMA抗体及抗体免疫组化稀释液,Abcam(上海)贸易有限公司;低分子质量Marker(DL2500),总RNA提取试剂(D9108),反转录试剂盒(DRR047A),实时荧光定量PCR试剂盒(DRR081),均为TAKARA(大连)有限公司;其余试剂均为国产分析纯,实验室用水为超纯水.
5331型PCR仪,Realplex2型实时荧光定量PCR仪,德国Eppendorf;PowerWave XS型全波长酶标仪,美国BIO-RAD;DYY-Ⅱ型电泳仪,北京六一;PRO250型组织匀浆仪,美国PRO Scientific;GELDOC-IT型凝胶成像分析仪,美国UVP.
1.2试验动物分组与处理
3月龄雌性SPF级Wistar大鼠144只,体质量(200±10 g),购自塔里木大学动物科学学院实验站.随机分为对照组,试验Ⅰ组、试验Ⅱ组和试验Ⅲ组,每组36只,分笼饲养.自由采食和饮水.对照组饲喂大鼠饲料,其组成为:面粉300 g·kg-1,玉米粉290 g·kg-1,豆饼200 g·kg-1,麸皮100 g·kg-1,鱼粉50 g·kg-1,酵母粉10 g·kg-1,植物油10 g·kg-1,鱼肝油10 g·kg-1,食盐10 g·kg-1,骨粉10 g·kg-1,矿物质添加剂9 g·kg-1.维生素添加剂1 g·kg-1[2];试验Ⅰ组、试验Ⅱ组和试验Ⅲ组分别饲喂小花棘豆质量分数为150、300和450 g·kg-1的混合饲料.根据气相色谱法测定结果[7],相当于SW添加量为30、60和90 mg·kg-1.试验持续63 d.试验每7 d每组随机取4只大鼠,剖杀后分别取下丘脑、垂体和卵巢,各项组织部分进行免疫组化染色分析,部分利用冰生理盐水制备10%组织匀浆液用于检测AMA活性,部分组织液氮保存用于检测mRNA水平表达的影响.所有解剖工具及冻存管均预先用DEPC水处理.
1.3AMA在小花棘豆中毒大鼠HPOA组织中分布的测定
试验鼠丘脑、垂体和卵巢组织均使用4%多聚甲醛固定,梯度酒精脱水,二甲苯透明后进行石蜡包埋.包埋组织进行连续切片,片厚6 μm,二甲苯脱蜡,梯度酒精复水,然后按照试剂盒说明操作,其中抗体稀释比为1/100,DAB显色,使用PBS为阴性对照.常规脱水,透明,封片,观察组织病理学变化,采用Image-Pro Plus 6.0软件对免疫组化获得照片进行分析.
1.4小花棘豆中毒大鼠HPOA组织中AMA活性的测定

1.5小花棘豆中毒大鼠HPOA AMA在mRNA表达水平的测定
1.5.1引物设计与合成根据GenBank中大鼠高尔基体α-甘露糖苷酶Ⅱ(AMA1)、溶酶体α-甘露糖苷酶(AMA2)和β-actin基因的核苷酸序列,采用Beacon Designer软件设计引物,引物由TAKARA(大连)有限公司合成(表1).
1.5.2总RNA提取与cDNA合成参照TAKARA公司说明书提取大鼠卵巢总RNA,然后用核酸蛋白检测仪测定其D260 nm和RNA浓度,用10 g·L-1琼脂糖凝胶电泳检测RNA的完整性.将合格RNA利用gDNA Eraser去除基因组DNA,反应条件:42 ℃,2 min.以除去基因组DNA的RNA为模板采用两步法进行反转录,反应体系如下:5×Prime Script®Buffer 4.0 μL,Prime Script®RT Enzyme MixⅠ1.0 μL,RT Primer Mix 1.0 μL,去除DNA的RNA 液10.0 μL,RNase Free dH2O 4.0 μL,总体积20.0 μL,以上步骤均在冰上进行.反应条件:37 ℃ 15 min,85 ℃ 5 s.
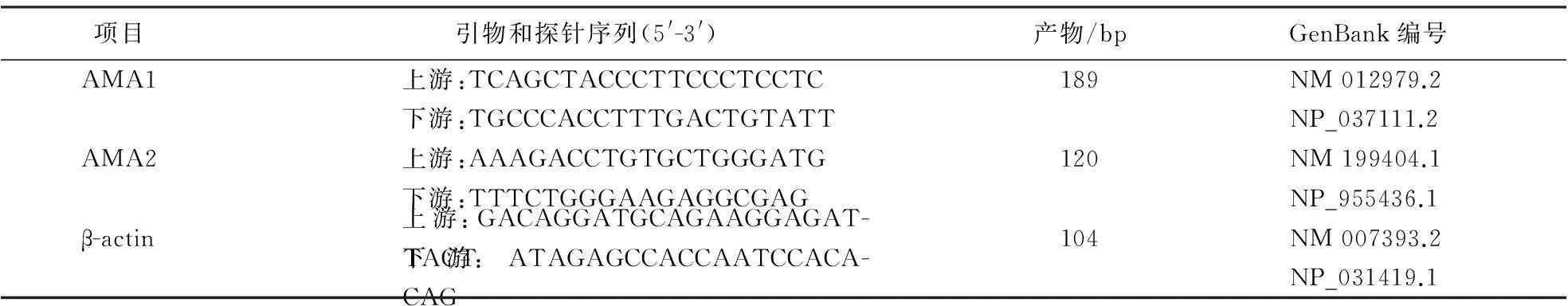
表1 引物设计
1.5.3普通PCR及基因测序PCR反应体系如下:TaqPCR Master Mix (2×)12.5 μL,模板cDNA 2.0 μL,上、下游引物(10 μmol·L-1)各2.0 μL ,ddH2O 6.5 μL,合计25.0 μL.其反应程序为:95 ℃预变性5 min, 94 ℃变性20 s,58 ℃退火30 s,72 ℃延伸30 s,反应30个循环,72 ℃最终延伸10 min.PCR产物用琼脂糖凝胶电泳鉴定,扩增阳性者送TAKARA(大连)有限公司测序.
1.5.4实时荧光定量PCR检测大鼠HPOA中AMA的相对表达采用SYBR®Premix Ex TaqTMⅡ进行实时荧光定量PCR操作,反应体系如下:SYBR®Premix Ex TaqTM(2×)10.0 μL,上、下游引物(10 μmol·L-1)各0.8 μL,ROX Reference Dye Ⅱ(50×) 0.4 μL,1.5.2所得cDNA溶液2.0 μL,RNase Free dH2O 6.0 μL,总体积25.0 μL,以上步骤均在冰上进行.反应条件:95 ℃预变性30 sec, 95 ℃变性5 s,60 ℃退火34 s,反应40个循环,PCR扩增反应结束.按反应体系及反应条件进行实时荧光定量PCR,得到各部分Ct值,采用双标准曲线法对所得实时荧光定量PCR结果进行分析.
1.6数据分析
试验数据采用SPSS 16.0软件中One-Way ANOVA方法进行单因素方差分析.
2结果与分析
2.1AMA在大鼠HPOA组织中的分布
由图1可见,AMA在大鼠的丘脑旁中央核、丘脑室旁核、丘脑背内侧核、丘脑腹内侧核、垂体前叶、垂体后叶、垂体正中隆起、卵巢上皮细胞、绒毛细胞、颗粒层细胞等区域均有分布.而小花棘豆攻毒大鼠丘脑背内侧核细胞、丘脑室旁核、垂体前叶、垂体后叶、卵巢上皮细胞及卵巢颗粒层细胞中AMA的染色明显变淡,其中试验Ⅰ组与对照组差异不明显,但试验Ⅱ组和试验Ⅲ组下降明显,其中试验Ⅲ组在攻毒第42 d后AMA免疫组化染色极淡,表明其已经几乎不表达.
2.2引物的可靠性验证
由图2可知,β-actin在约100 bp出现条带,AMA1和AMA2基因分别在在100和200 bp间出现2条清晰条带,与试验设计的目的条带相符,表明引物设计良好.
2.3试验期内大鼠HPOA中的AMA活性变化
由图3可知,在整个试验期内对照组大鼠HPOA中的AMA活性无明显变化,试验组大鼠HPOA中的AMA活性均有一定程度下降.攻毒第7 d时试验组大鼠所有指标与对照组差异均不显著(P>0.05);第14 d时试验Ⅲ组大鼠HPOA中的AMA活性均显著低于对照(P<0.05);第35 d时试验Ⅱ组和试验Ⅲ组大鼠HPOA中的AMA活性均极显著低于对照(P<0.01),并持续到试验结束.攻毒第63天时试验Ⅰ组下丘脑AMA活性显著低于对照(P<0.05),但垂体、卵巢AMA活性与对照组差异不显著(P>0.05).试验表明,长时间、高剂量的摄食小花棘豆可显著影响大鼠HPOA中的AMA活性,其中小花棘豆中毒对下丘脑的影响最为明显.
2.4试验期内大鼠HPOA AMA1表达水平的变化
由图4可知,各试验组大鼠HPOA中AMA1均有表达.与对照组相比,第28 d的试验Ⅲ组大鼠下丘脑中AMA1 mRNA表达量显著下降(P<0.05),但其它试验组均与对照组差异不显著(P>0.05).第42 d的试验Ⅲ组大鼠HPOA中AMA1 mRNA表达量均极显著低于对照(P<0.01);试验Ⅱ组大鼠丘脑和垂体AMA1 mRNA表达量极显著低于对照(P<0.01),卵巢AMA1 mRNA表达量显著低于对照(P<0.05).第63 d的试验Ⅱ组和试验Ⅲ组大鼠HPOA中的AMA1 mRNA表达量均极显著低于对照(P<0.01),但试验Ⅰ组HPOA中AMA1 mRNA表达量仍与对照组差异不显著(P>0.05).试验结果表明大剂量、长时间的饲喂小花棘豆可显著影响大鼠HPOA中的AMA1在mRNA的表达水平.
2.5试验期内大鼠HPOA AMA2表达水平的变化
试验结果见图5.试验开始至第35 d的各试验组AMA2 mRNA表达量均与对照组差异不显著(P>0.05);第42 d的仅试验Ⅲ组大鼠下丘脑中AMA2 mRNA表达量显著低于对照(P<0.05),但其余试验组均与对照组差异不显著(P>0.05);第49 d的试验Ⅲ组大鼠HPOA中的AMA2 mRNA表达量均显著低于对照(P<0.05),并持续至试验结束;第63 d的试验Ⅱ组大鼠下丘脑和垂体AMA2的mRNA表达量显著低于对照(P<0.05),但卵巢AMA2的mRNA表达量与对照组差异不显著(P>0.05).试验表明小花棘豆中毒对大鼠HPOA中的AMA2 mRNA表达量的影响较弱.
2.6试验期内大鼠HPOA组织AMA基因序列的影响
经DNAStar软件分析及NCBI BLAST比对,试验Ⅰ组大鼠下丘脑、垂体、卵巢AMA与公布的基因序列重合率均在99%以上,其中垂体和卵巢AMA与公布序列完全一致,表明低剂量小花棘豆中毒对大鼠HPOA中的AMA活性及表达无明显影响.试验Ⅱ组和试验Ⅲ组大鼠HPOA中的AMA与公布的基因序列均有较大差异,试验第63 d的试验Ⅲ组大鼠下丘脑、垂体、卵巢AMA1与公布的基因序列重合率分别只有88%、90%和90%,但各试验组大鼠下丘脑、垂体、卵巢AMA2与公布的基因序列重合率均在95%以上,表明大剂量的小花棘豆中毒对大鼠AMA1有显著影响.
3讨论
3.1小花棘豆中毒对大鼠HPOA中的AMA活性影响
SW是小花棘豆的主要毒性成分,其结构与甘露糖类似,可强烈的、特异性的与AMA结合,从而使机体甘露糖代谢发生异常,导致甘露糖大量蓄积于细胞内而造成细胞空泡变性,最终导致细胞损伤[8,9].王帅等[2]研究表明小花棘豆中毒可导致试验鼠脑组织与性腺损伤,而且脑指数和性腺指数均与小花棘豆中毒均极显著相关(P<0.01).丁伯良等[10]研究认为甘肃棘豆(主要毒性成分为SW)中毒山羊卵巢组织细胞的空泡变性与AMA活性下降有关,陈根元等[6]发现小花棘豆中毒家兔AMA活性显著下降.本试验发现AMA在大鼠HPOA中均有分布,而且中毒大鼠HPOA中的AMA活性显著下降,并与时间-剂量呈正相关,表明小花棘豆毒性成分SW可通过影响AMA导致动物中毒.
3.2小花棘豆中毒对大鼠HPOA中的AMA在mRNA表达水平的影响
AMA在机体糖蛋白合成和代谢方面具有重要的作用,可在N-糖基化过程中对甘露糖进行加工.该过程与蛋白的折叠、运输、成熟、构象维持、半衰期及生物活性密切相关.AMA既是N-聚糖成熟的必要酶,也参与N-聚糖的降解[11].贾琦珍等[5]、宋岩岩[12]研究发现SW可显著影响中毒鼠AMA在脑组织中的相对表达,张建军等[13]研究发现小花棘豆中毒可显著影响小鼠肝脏组织内AMA的相对表达.本试验研究发现,小花棘豆中毒可显著影响大鼠HPOA中高尔基体α-甘露糖苷酶Ⅱ和溶酶体α-甘露糖苷酶在mRNA水平的表达,而且对高尔基体α-甘露糖苷酶Ⅱ的影响更为显著,该结果与贾琦珍等[5]、宋岩岩[12]、张建军等[13]的研究结果一致.另外免疫组化试验发现小花棘豆中毒大鼠HPOA中AMA蛋白表达均有一定程度的下降,而且各试验组见差异显著,高剂量小花棘豆攻毒可导致大鼠HPOA中的AMA蛋白表达受到显著抑制.α-甘露糖苷酶按其在亚细胞器的分布可分为高尔基体α-甘露糖苷酶Ⅱ、溶酶体α-甘露糖苷酶和细胞质α-甘露糖苷酶,动物小花棘豆中毒时主要抑制哪种AMA尚不明确,对其转录、翻译、加工修饰是否产生影响还不清楚.本试验研究表明小花棘豆毒性成分可从mRNA水平和蛋白表达水平影响AMA的表达,从而为揭示小花棘豆中毒的作用机理奠定了基础.
3.3小花棘豆中毒对大鼠HPOA中的AMA基因序列的影响
AMA活性受到抑制可导致细胞内糖蛋白的N-糖基化合成、加工、转运等过程发生变化,临床上表现为生殖功能、内分泌和免疫功能紊乱[14].试验表明中、高剂量小花棘豆攻毒可对大鼠HPOA中的AMA活性与表达产生显著影响,试验结束时高剂量攻毒组大鼠下丘脑、垂体、卵巢AMA1基因序列与NCBI公布的正常大鼠基因序列重合率分别只有88%、90%和90%.张建军等[13]的研究发现高剂量小花棘豆中毒组小鼠肝脏AMA基因与正常对照的重合率较低,本试验结果与之一致.丘脑和垂体是动物内分泌的控制中心,并分泌大量与生殖相关的激素,卵巢是多种性激素的受体.HPOA任何部位出现功能紊乱或病变,都会影响动物性激素的分泌,从而导致一系列的临床病症出现.国内外研究表明小花棘豆中毒可显著影响动物的繁殖机能,导致母畜性欲下降、不孕、流产、畸形、难产等,严重时发生死胎,但其具体作用机制尚不明确.本研究发现小花棘豆中毒可通过影响AMA的活性及表达从而导致HPOA损伤,而HPOA与动物性激素的分泌密切相关,小花棘豆中毒动物繁殖机能的下降是否与HPOA损伤导致的性欲下降有关,还有待于进一步研究.
4结论
小花棘豆中毒可导致大鼠HPOA中的AMA活性与表达水平显著下降,而且下降趋势与小花棘豆摄入量呈现极显著的正相关.小花棘豆中毒对AMA1的影响较为显著,其可通过mRNA水平和蛋白表达水平影响AMA1在机体中的作用.
参考文献
[1] 王帅,张玲,陈根元,等.小花棘豆生态学研究概况[J].家畜生态学报,2014,35(3):85-88.
[2] 王帅,贾琦珍,胡建军,等.小鼠实验性小花棘豆中毒的病理学观察[J].塔里木大学学报,2014,26(2):11-15.
[3] 王帅,吴书奇,胡建军,等.南疆地区小花棘豆中苦马豆素的分离与鉴定[J].草业科学,2011,28(6):1194-1197.
[4] 贾琦珍,王帅,张玲,等.小花棘豆中毒对家兔脑组织α-甘露糖苷酶的影响[J].塔里木大学学报,2015,27(1):18-23.
[5] 贾琦珍,陈根元,吴书奇,等.小花棘豆中毒对大鼠睾丸α-甘露糖苷酶的影响[J].西北农业学报,2015,24(4):6-12.
[6] 陈根元,贾琦珍,潘伊微,等.家兔苦马豆素多克隆抗体的制备及其对小花棘豆中毒的治疗效果[J].西北农业学报,2014,23(1):23-29.
[7] 王帅,贾琦珍,陈根元,等.不同生长时期小花棘豆营养成分与苦马豆素含量的比较[J].新疆农业科学,2015,52(8):1505-1509.
[8] 王帅,张玲,陈根元,等.苦马豆素对小鼠肝脏抗氧化功能的影响[J].新疆农业科学,2012,49(12):2304-2309.
[9] 王帅,张玲,陈根元,等.苦马豆素对小鼠脑组织抗氧化功能的影响[J].西北农业学报,2013,22(7):12-18.
[10] 丁伯良,王建辰,薛登民,等.奶山羊甘肃棘豆中毒卵巢、胎盘的病理学研究[J].中国兽医学报,1995,15(1):27-32.
[11] KUNTEZ D A, NAKAYAMA S, SHEA K, et al. Struetural investigation of the binding of 5-substituted swainsonine analogues to golgi α-mannosidase Ⅱ[J]. Chem Bio Chem, 2010,11(5):673-680.
[12] 宋岩岩.甘肃棘豆致大鼠脑组织细胞凋亡及α-甘露糖苷酶变化的研究[D].杨凌:西北农林科技大学,2012.
[13] 张建军,韩敏,王宇,等.小花棘豆苦马豆素对小白鼠肝脏α-甘露糖苷酶基因相对表达的影响[J].中国畜牧兽医,2014,41(2):50-53.
[14] POLAKOVA M, SESTAK S, LATTOVA E, et al. α-D-mannose derivatives as models designed for selective inhibition of golgi α-mannosidase[J]. J Vet Diagn Invest, 2011,23(2):221-232.
(责任编辑:吴显达)
Toxicity ofOxytropisglabraDC on α-mannosidase of hypothalamus-pituitary-ovarian axis in rats
WANG Shuai1,2, JIA Qizhen1, CHEN Genyuan1, CHENG Yong1,2, ZHANG Ling1,2, MA Chunhui1,3
(1.Key laboratory of Tarim Animal Husbandry Science and Technology, Xinjiang Production & Construction Corps, Alar,Xinjiang 843300, China; 2.College of Animal Science, Tarim University, Alar, Xinjiang 843300, China;3.College of Animal Science and Technology, Shihezi University, Shihezi, Xinjiang 832000, China)
Abstract:In order to investigate the toxicity mechanism of Oxytropis glabra DC, 144 3-month female rats were randomized into 4 groups (control group and experimental groupⅠ,Ⅱ,Ⅲ) and fed with mixture of O. glabra DC (fully ground above-ground part) and swainsonine (0, 30, 60 and 90 mg·kg(-1)) accordingly, until typical toxicity symptoms occurred. Then rats were selected randomly from each group every 7 d until the 63rd day. Hypothalamus, pituitary and ovary were collected, and contents of AMA Ⅰ, Ⅱ and its mRNA expression in different encephalic regions were measured. Golgi AMA I and lysosomal AMA Ⅱ were detected in HPOA in four experimental groups. And the concentration of AMA1 and AMA2 mRNA decreased as doses of O. glabra DC increased. The difference was not significant in group Ⅰ and the control group in HPOA (P>0.05), but AMA1 and AMA2 mRNA were significantly lower in experimental group Ⅱ and Ⅲ than the control group(P<0.05). And the inhabitation effect intensified as the study proceeded. To summarize, O. glabra DC reduces the concentration and transcriptional expression of AMA in female rat HPOA.
Key words:Oxytropis glabra DC; swainsonine; α-mannosidase; hypothalamus-pituitary-ovarian axis
DOI:10.13323/j.cnki.j.fafu(nat.sci.).2016.01.012
中图分类号:S856.9
文献标识码:A
文章编号:1671-5470(2016)01-0070-07
作者简介:王帅(1984-),男,实验师,硕士.研究方向:动物毒理学.Email:wangshuaidky@126.com.通讯作者马春晖(1966-),男,教授,博士,博士生导师.研究方向:牧草生产与加工利用.Email:chunhuima@126.com.
基金项目:国家自然科学基金(31460678);兵团塔里木畜牧科技重点实验室开放课题(HS201207).
收稿日期:2015-04-01修回日期:2015-06-26

