Rathke囊肿继发性垂体炎病例分析并文献复习
杨彩彩,刘新艳,高志飞,贾爱华,刘晋津,赵旭敏,井长信,李艳艳
(榆林市第一医院内分泌科,陕西 榆林 719000)
垂体炎根据病因不同,将其分为原发性垂体炎及继发性垂体炎。继发性垂体炎被认为是由明确的继发因素诱发,如颅咽管瘤、垂体腺瘤、垂体脓肿和Rathke囊肿等[1-2]。Rathke囊肿是一种比较少见的垂体疾病,约占垂体病变10.0%[3],由单个立方或柱状上皮组成,包括纤毛和杯状细胞,它们将黏液分泌到囊肿内。由Rathke囊肿所致的继发性垂体炎更为罕见,其临床表现及影像学表现与垂体腺瘤、垂体脓肿等垂体疾病相似。如诊治不及时,将增加并发症的风险,如急性腺垂体功能减退症、尿崩症和(或)视力、视野损害[1,4]。本研究就榆林市第一医院内分泌科收治的6例Rathke囊肿,经鼻蝶窦手术后病理和(或)免疫组化确诊的继发性垂体炎,结合既往文献对Rathke囊肿继发性垂体炎进行总结,提高临床医师的认识,减少误诊及漏诊。
1 对象与方法
1.1 对象
2010年1月至2020年5月在榆林市第一医院内分泌科就诊,并经病理证实的6例Rathke囊肿继发性垂体炎患者。所有患者均详细记录临床资料,如性别、年龄、血压、起病方式、临床表现、生化检查、内分泌激素[性激素、甲状腺激素、生长激素、胰岛素样生长因子(IGF-1)、促肾上腺皮质激素(ACTH)]、血渗透压、尿渗透压、尿比重、垂体MRI检查、诊疗经过及随访结果等临床资料。
1.2 方法
1.2.1 纳入及排除标准 纳入标准:①术前影像学高度怀疑Rathke囊肿,术后病理组织学见上皮样细胞及大量炎性细胞浸润,伴或不伴纤维化;②2例患者未手术,既往均有垂体囊肿病史,垂体MRI示典型Rathke囊肿的影像学,且囊肿周边呈环形不均匀强化,伴垂体柄增粗且被异常强化,伴垂体后叶高信号消失。排除标准:既往无垂体囊肿病史,虽有垂体柄增粗且被强化,但未经手术行病理证实者。
1.2.2 激素水平测定 清晨8∶00静卧状态抽血测定垂体前叶及垂体后叶激素。血ACTH、卵泡刺激素(FSH)、黄体生成素(LH)、睾酮(T)、雌二醇(E2)、促甲状腺激素(TSH)、甲状腺激素(FT3、FT4)、生长激素(GH)、IGF-1以及泌乳素(PRL)均采用德国罗氏化学发光法测定。尿常规采用化学分析法测定。血尿渗透压采用冰点渗透压检测法检测。
1.2.3 垂体功能减退症的诊断标准[5-6](1)下丘脑-垂体-肾上腺轴:基础血ACTH<10.12 pmol/L,基础血浆皮质醇<100 nmol/L高度怀疑促肾上腺皮质功能减退症,胰岛素低血糖兴奋试验后血ACTH升高不明显或无升高,血清皮质醇峰值<450 nmol/L;(2)下丘脑-垂体-性腺轴:①成年男性:血睾酮水平降低,FSH、LH降低或者正常;②育龄期女性:E2降低,FSH、LH降低或者正常(月经稀发或停经时);③绝经后妇女:FSH、LH降低;(3)下丘脑-垂体-甲状腺轴:TSH降低或正常,FT4或TT4下降;(4)高泌乳素血症:查两次基础PRL,取其平均值>17.7 μg/L(男性)或29.2 μg/L(女性);(5)GH缺乏:选用胰岛素低血糖试验进行诊断①儿童:GHmax<10 ng/mL;②成人:GHmax<3 ng/mL;③三种或多于三种垂体激素缺乏时,IGF-1<不同年龄段最低参考值;(6)尿崩症:多尿,尿量>50 mL/kg·h;低比重尿,尿渗透压<血浆渗透压,禁水加压试验后尿渗透压>血浆渗透压,尿渗透压较前上升>9%。
1.3 统计学方法
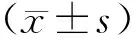
2 结果
2.1 一般情况
6例Rathke囊肿继发性垂体炎,男性2例,女性4例,平均年龄(46.33±14.42)岁,最小者32岁,最大者70岁,平均病程(2.40±1.98)月;平均收缩压(114±9.60)mmHg,平均舒张压(75.17±13.50)mmHg,最短随访时间9个月,最长随访时间45个月,平均随访时间(27.00±14.90)个月。
2.2 临床症状及垂体功能评估
①临床症状:4例患者首发症状表现为头痛,3例表现为口干、多尿、多饮,2例表现月经紊乱,2例表现性欲减退。②垂体功能评估:5例表现为继发性性腺功能减退症,3例轻度高泌乳素血症,3例尿崩症,3例肾上腺皮质功能减退,2例继发性甲状腺功能减退症,1例生长激素缺乏(表1)。

表1 Rathke囊肿继发性垂体炎临床资料
2.3 影像学
1例患者未见核磁描述。余5例患者垂体影像学示病灶最长直径(4~23)mm,3例表现为稍短T1信号,2例表现为等T1信号。5例患者均表现为长T2信号,病变表现为环形不均匀强化,垂体柄增粗且被异常强化,3例视交叉受压,病例3影像学资料见图1。

图1 病例3患者垂体MRI
2.4 病理、治疗及随访
6例患者均经鼻蝶窦行病变切除术,术后病理组织见炎性细胞浸润,伴或不伴纤维化,免疫组化均可见上皮样细胞。4例患者术后垂体压迫症状缓解,但术后下丘脑-垂体-靶腺激素恢复不明显,2例患者术后复发。
3 讨论
Rathke囊是由具有纤毛和杯状细胞的高分化纤毛柱状上皮组成,在其囊内基底细胞是如何增殖和化生导致垂体炎的,目前尚不清楚,可能的机制为囊液局部持续性刺激引起垂体炎性细胞浸润[7]。Rathke囊肿继发性垂体炎的诊断较为困难,垂体组织活检行病理检查和(或)免疫组化是金标准,但对于无压迫症状或无垂体功能减退症患者,是否需要手术仍然是一个争议的话题。
Zhong等[8]研究显示Rathke囊肿继发性垂体炎最常见的临床症状为头痛、视野缺损及内分泌激素紊乱。Morinaga等[9]报道一例36岁女性,病史5年,首发症状表现为月经紊乱及视野缺损,后出现头痛及球后疼痛。Yang等[2]报道一例58岁中国妇女,病史3年,首发症状表现为头痛,后出现多饮、多尿及视力下降及视野缺损,下丘脑-垂体-靶腺轴相关激素未见异常。本研究与既往文献相比,首次就诊时的首发症状及合并的垂体功能低下基本一致。但从本研究也可看出Rathke囊肿继发性垂体炎病程时间长短不一,低促性腺激素性性腺功能减退症为最常见的合并症,尿崩症及高泌乳素血症也较为常见,生长激素缺乏少见。
垂体MRI检查被认为是垂体炎最佳的影像学检查,Caranci等[10]研究指出Rathke囊肿继发性垂体炎的典型特征包括增大的病灶呈三角形或哑铃状,垂体柄增粗可不偏移,如出现垂体后叶高信号消失,可支持垂体炎的诊断。由Rathke囊肿破裂所致垂体炎可表现为短T1或等T1、长T2信号,病灶信号不均匀,垂体柄增粗可被强化,病灶呈环形强化[10]。Kluczyński等[3]研究显示继发性垂体炎典型的影像学表现为鞍区扩大,病变信号不均匀,垂体柄增粗、垂体后叶高信号影消失。Zhong等[8]研究中提到典型的Rathke囊肿继发性垂体炎表现为长T1或短T1、长T2信号。本研究中,5例患者垂体MRI均见鞍内类圆形病变,最长直径波动在(4~23)mm,其中3例患者表现为稍短T1长T2信号,2例表现为等T1长T2信号,病灶均呈环形不均匀强化,垂体柄增粗且被异常强化,3例视交叉受压,其中病例2病变直径4 mm,影像学表现为蝶鞍扩大,鞍底下陷,垂体柄增粗。Yang等[2]报道的病例,病灶最长直径6.2 mm,出现垂体压迫症状,与本研究中病例2相似。
然而,对于影像学不典型的患者,仅依据临床症状、内分泌激素及影像学无法临床确诊时,需依靠病理学及免疫组化。Rathke囊肿由高分化的纤毛柱状上皮构成,在免疫组化检查中见上皮细胞及炎性细胞浸润,可诊断Rathke囊肿继发性垂体炎。在Hama等[7]研究(n=20)中,对13例患者进行免疫组化检查,其中6例为单层上皮化生,7例为鳞状上皮化生,10例表现出不同程度的炎症反应,同时表明上皮细胞与早期炎症有关,鳞状上皮化生及纤维化可能与慢性炎症有关。Yang等[2]报道患者的病理学检查示Rathke囊肿,伴大量炎性细胞浸润,诊断为Rathke囊肿继发性垂体炎。本研究中,6例患者术后病理均可见上皮样细胞及炎性细胞浸润,可明确诊断Rathke囊肿继发性垂体炎。而且,有两例患者的垂体MRI最长直径<10 mm的病变,符合Rathke囊肿特征,但出现不同程度的垂体占位不相符的垂体功能减退及尿崩症,手术病理诊断明确。综上,如高度怀疑Rathke囊肿继发性垂体炎,垂体囊肿最长直径>10 mm时,建议行病理检查,如囊肿最长直径<10 mm时,且出现与占位不相符的垂体前叶功能减退或尿崩症,影像表现除典型Rathke囊肿的表现外,垂体组织增大和垂体柄增粗,且被异常强化,即可临床诊断。
本研究除病例5外,均出现了不同程度的垂体功能减退症,4例患者行经鼻蝶窦病变切除术,术后垂体压迫症状,如头痛、视野缺损等均呈不同程度缓解。病例5术前未出现垂体功能减退症但伴有垂体压迫症状,经鼻蝶窦手术后压迫症状完全缓解,术后复查垂体内分泌激素正常。其余3例患者术后垂体功能减退症未能缓解,需长期激素替代治疗。Morinaga等[9]学者指出Rathke囊肿破裂继发垂体炎者,需尽早手术治疗,或可避免全垂体功能减退症及视野缺损。所以,建议对于高度怀疑Rathke囊肿继发性垂体炎的患者,病变直径较大,且出现垂体功能减退症和(或)垂体占位效应,需尽快手术治疗,同时可获得病理学证据,对于病灶直径相对小的患者,且无垂体病变占位效应,可选择激素替代治疗。

