盐胁迫对不同品种油橄榄抗盐性生理指标的影响
赵曼利, 杜启兰, 焦 健, 李朝周, 金庆轩, 刘文兰
(1.甘肃农业大学林学院; 2.甘肃农业大学生命科学与技术学院; 3.甘肃农业大学甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070; 4.临沂大学生命科学学院,山东 临沂 276005)
盐胁迫对不同品种油橄榄抗盐性生理指标的影响
赵曼利1, 杜启兰4, 焦健1, 李朝周2,3, 金庆轩1, 刘文兰1
(1.甘肃农业大学林学院; 2.甘肃农业大学生命科学与技术学院; 3.甘肃农业大学甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070; 4.临沂大学生命科学学院,山东 临沂 276005)
摘要:对陇南主栽的6个油橄榄品种进行不同程度的NaCl胁迫处理,测定与抗盐性相关的生理生化指标,结果表明叶片相对电导率随盐浓度的升高而呈“S”型曲线变化,叶绿素含量随盐浓度升高而降低,可溶性糖含量随盐浓度的升高基本呈增加趋势,可溶性蛋白质含量、脯氨酸含量、丙二醛含量(MDA)、SOD活性、POD活性和CAT活性随盐浓度的升高呈先升后降的趋势.采用隶属函数法对各生理生化指标进行综合分析,得出不同油橄榄品种的平均隶属度即抗盐性综合评价值,最终确定6个油橄榄品种抗盐能力依次为:莱星(0.683)>鄂植8号(0.556)>配多灵(0.514)>阿斯(0.487)>佛奥(0.362)>皮肖利(0.276).
关键词:油橄榄; NaCl胁迫; 生理响应
盐渍化是现代农业生产所面临的主要问题之一.我国有盐渍土面积约3600万hm2,占全国可利用土地面积的4.88%[1],尤其以西北地区和东部的沿海地区土壤盐渍化最为严重.陇南位于甘肃东南部,以其独特的气候资源和环境条件成为我国两个一级油橄榄适生区之一,近年由于不合理的灌溉,造成部分油橄榄种植区土壤盐渍化加剧.目前有关国内油橄榄引种品种的抗盐性研究尚未见报道,通过研究盐胁迫对油橄榄的生理特性的影响,试图筛选出耐盐性较强的品种,为盐碱地区油橄榄的育苗和种植提供依据,并有利于向东部沿海地区拓展油橄榄的种植区域.
本研究选用陇南引种的6个主要油橄榄品种,测定不同油橄榄品种对NaCl盐胁迫的生理响应,分析NaCl盐胁迫下各油橄榄品种抗性生理指标的变化,采用隶属函数法对其抗盐性进行综合评价,以期为油橄榄抗盐品种引种和选育提供理论支持.
1材料与方法
1.1试验材料
试验材料为甘肃省陇南市武都区富江油橄榄种植园的1年生油橄榄盆栽幼苗,共6个品种,分别为莱星、鄂植8号、配多灵、阿斯、佛奥、皮肖利.
1.2试验方法
盆栽试验于2014年在甘肃农业大学林学院实验室进行,温度5-21 ℃,湿度20%-58%.花盆装入1∶1的珍珠岩(v/v)与蛭石,插入PVC管定时浇灌营养液和蒸馏水.每日上午8点用蒸馏水补充失水,每隔3 d用Hoagland完全营养液浇灌一次.试验以NaCl盐溶液胁迫处理,Na+浓度为0(CK),100,200,300 mmol·L-14个梯度.NaCl胁迫14 d后,摘取油橄榄植株中部且大小一致的油橄榄叶片,进行各生理指标测定.
1.3生理生化指标的测定方法
油橄榄叶片相对电导率、叶绿素含量、可溶性蛋白质含量、脯氨酸含量、可溶性糖含量、丙二醛(Malondialdehyde, MDA)含量、超氧化物歧化酶(Superoxide dismutase, SOD)活性、过氧化物酶(Peroxidase, POD)活性、过氧化氢酶(Catalase, CAT)活性根据肖家欣[2]的方法测定.所有指标重复测定3次.
1.4数据处理方法
采用Excel 2003、SPSS 19.0和STATISTICA 7软件进行数据统计分析.采用SPSS 15.0统计软件分析数据,P<0.05表示具有显著性差异.
1.5油橄榄品种抗盐性综合评价
不同油橄榄品种抗盐性综合评价应用隶属函数法[3]:采用模糊数学的隶属函数法计算每个品种各抗性相关指标的隶属度.
(1)与抗盐性呈正相关的可溶性蛋白质、脯氨酸、叶绿素、可溶性糖含量和抗氧化酶(SOD、POD和CAT)活性用式(1)计算:
(1)
(2)与抗盐性呈负相关的相对电导率、MDA含量用式(2)计算:
(2)
式(1)、(2)中:U(Xijk)为第i个品种第j个盐浓度梯度第k项指标的隶属度,且U(Xijk)∈[0,1];Xijk表示第i个品种第j个盐浓度梯度第k个指标测定值;Xmax、Xmin为所有参试种中第k项指标的最大值和最小值.用每个品种各项指标隶属度的平均值作为各品种抗盐能力综合评判标准,进行比较.
2结果与分析
2.1不同油橄榄品种对NaCl胁迫的生理响应
2.1.1NaCl胁迫对油橄榄叶片相对电导率的影响6个不同品种的油橄榄叶片经过NaCl盐胁迫处理后,其叶片相对电导率随着盐浓度的增加而逐渐升高,大体呈“S”型曲线变化.NaCl浓度升至100 mmol·L-1时,细胞膜透性缓慢增大,佛奥叶片相对电导率为38.42%,增幅为43.98%,升高幅度最大;其次配多灵相对电导率为31.32%,增幅为35.48%,其它品种增幅均小于25.00%;当NaCl浓度升至300 mmol·L-1时,皮肖利、佛奥和阿斯叶片细胞膜开始受到较严重伤害,相对电导率分别为85.32%、66.56%和63.21%,相对电导率超过60.00%,耐盐性较差;莱星、鄂植8号和配多灵细胞膜透性均受到轻度伤害,相对电导率未超过60.00%;然而当NaCl浓度升至400 mmol·L-1时,除了莱星相对电导率为88.564%、鄂植8号90.320%外,其它品种均超过96.000%,其中皮肖利、佛奥相对电导率超过98.000%,表明莱星和鄂植8号耐盐性相对最佳,而皮肖利、佛奥最差.
2.1.2NaCl胁迫对油橄榄叶片叶绿素和丙二醛含量的影响结果显示,NaCl胁迫下6个油橄榄品种叶片叶绿素含量随胁迫加剧且总体呈下降趋势(图2A),与对照相比,400 mmol·L-1处理组6种油橄榄叶绿素含量相对降幅如下:莱星(19.481%)<鄂植8号(24.815%)<阿斯<配多灵(33.673%)<皮肖利(38.072%)<佛奥(47.119%),表明高盐浓度胁迫下,皮肖利与佛奥受害最重,而莱星与鄂植8号耐盐性相对最强.
6个油橄榄品种丙二醛含量随NaCl胁迫的加剧呈先升后降的趋势(图2B),统计分析显示同一品种在不同NaCl胁迫下丙二醛含量存在极显著差异(P<0.01).200 mmol·L-1处理组,除莱星外的5个品种达到峰值, 300~400 mmol·L-1所有品种的丙二醛含量持续降低.与CK相比,400 mmol处理组丙二醛相对增幅如下:莱星0.427%,鄂植8号0.893%,配多灵5.702%,阿斯8.451%,佛奥19.313%,皮肖利22.269%.莱星和鄂植8号增幅较小,皮肖利和佛奥增幅较大(图2B).
2.1.3NaCl胁迫对油橄榄叶片可溶性糖、脯氨酸和可溶性蛋白含量的影响6个油橄榄品种可溶性糖含量随NaCl胁迫的加剧总体呈不同程度的上升趋势.莱星和配多灵随盐浓度升高稳步上升,佛奥在400 mmol·L-1时降低,鄂植8号和阿斯在300 mmol·L-1时有所下降.与CK相比,400 mmol·L-1处理组相对增幅如下:莱星和配多灵随盐浓度升高稳步上升,佛奥在400 mmol·L-1时降低,鄂植8号和阿斯在300 mmol·L-1时有所下降.与CK相比,400 mmol·L-1处理组相对增幅如下:配多灵(55.930%)>莱星(55.827%)>阿斯(52.925%)>鄂植8号(37.128%)>佛奥(23.268%)>皮肖利(10.269%),其中莱星、配多灵和阿斯的可溶性糖含量相对增幅均超过50%,皮肖利增幅最小仅为10.269%(图3A).
脯氨酸含量随胁迫盐浓度的升高呈先升后降的趋势,相同品种在不同浓度NaCl胁迫下存在极显著差异(P<0.01),除阿斯外,其余品种均在300 mmol·L-1时达到峰值,300 mmol·L-1到400 mmol·L-1有所降低.与CK相比,400 mmol·L-1处理组相对增幅如下:莱星(125.969%)>佛奥(109.517%)>鄂植8号(91.200%)>阿斯(69.018%)>皮肖利(61.246%)>配多灵(43.282%).莱星、佛奥、鄂植8号的相对增幅较大,超过90%,皮肖利、阿斯相对增幅较小(图3B).
可溶性蛋白质含量随NaCl胁迫的加剧呈先升后降的趋势,相同品种在不同浓度NaCl盐胁迫下可溶性蛋白质含量存在极显著差异(P<0.01).除莱星和配多灵在200 mmol·L-1达到峰值外,其余品种均在300 mmol·L-1时达到峰值.与CK相比,200 mmol·L-1处理组相对增幅如下:莱星(41.369%)>鄂植8号(28.471%)>阿斯(15.033%)>配多灵(7.718%)>佛奥(-5.328%)>皮肖利(-5.330%).莱星与鄂植8号的相对增幅较大,超过25%,佛奥和皮肖利为负增长(图3C).
2.1.4NaCl胁迫对油橄榄叶片抗氧化酶活性的影响对于本研究所选6个油橄榄品种,其叶片SOD、POD和CAT活性皆从整体上表现为随NaCl胁迫加剧呈先升后降的变化,同一品种在不同NaCl胁迫下存在显著差异(P<0.05)(图4A-C).
各品种SOD活性均在200 mmol·L-1时达到峰值.与CK相比,200 mmol·L-1处理组相对增幅如下:莱星(1123.149%)>鄂植8号(778.071%)>佛奥(704.271%)>配多灵(699.892%)>阿斯(452.173%)>皮肖利(399.373%)(图4A).莱星相对增幅最大,佛奥、鄂植8号和配多灵居中,皮肖利相对增幅最小.
除佛奥和皮肖利POD活性随盐浓度升高呈缓慢下降趋势外,其余品种均表现为随NaCl胁迫加剧呈先升后降的变化,并在200 mmol·L-1时达到峰值.与CK相比,200 mmol·L-1处理组相对增幅如下:莱星(275.232%)>阿斯(184.780%)>鄂植8号(126.245%)>配多灵(116.371%)>皮肖利(-47.681%)>佛奥(-58.236%)(图4B).莱星、阿斯和鄂植8号POD活性相对增幅较大,均超过125%,皮肖利和佛奥为负增长.
除皮肖利外,各品种CAT活性均在300 mmol·L-1达到峰值,与CK相比,300 mmol·L-1处理组相对增幅如下:莱星(432.201%)>鄂植8号(375.061%)>阿斯(332.673%)>配多灵(290.263%)>佛奥(119.463%)>皮肖利(24.509%).莱星、鄂植8号和配多灵的相对增幅较大,均接近或超过300%,皮肖利相对增幅最小(图4C).
2.2生理生化指标的相关性分析
NaCl胁迫下6个油橄榄品种的9个生理指标间均存在着一定的相关性(表1).其中,有些指标的相关性达到了显著或极显著水平.相对电导率与脯氨酸含量呈极显著负相关(P<0.01),与丙二醛含量之间呈极显著正相关(P<0.01),与其它指标间呈不同程度的负相关.叶绿素与丙二醛含量呈负相关,与其它指标呈不同程度的正相关.可溶性糖含量与可溶性蛋白质含量呈显著正相关(P<0.05),与SOD含量呈负相关,与其它指标之间呈不同程度正相关.可溶性蛋白质含量与脯氨酸含量呈显著正相关(P<0.05),与SOD含量呈负相关.脯氨酸含量与丙二醛含量呈负相关,与SOD、POD、CAT活性呈正相关.丙二醛含量与SOD、POD、CAT活性呈显著正相关(P<0.05).SOD活性和POD、CAT活性呈极显著正相关(P<0.01).POD活性与CAT活性呈极显著正相关(P<0.01).
1)*:P<0.05;**:P<0.01.
2.36个油橄榄品种抗盐性的综合评价
平均隶属度综合反映品种抗盐性的强弱,其值越大则表明抗盐性越强.6个油橄榄品种的平均隶属度大小顺序为:莱星(0.683)>鄂植8号(0.556)>配多灵(0.514)>阿斯(0.487)>佛奥(0.362)>皮肖利(0.276),因此,6个品种油橄榄抗盐性由强到弱依次为:莱星> 鄂植8号>配多灵>阿斯>佛奥>皮肖利.
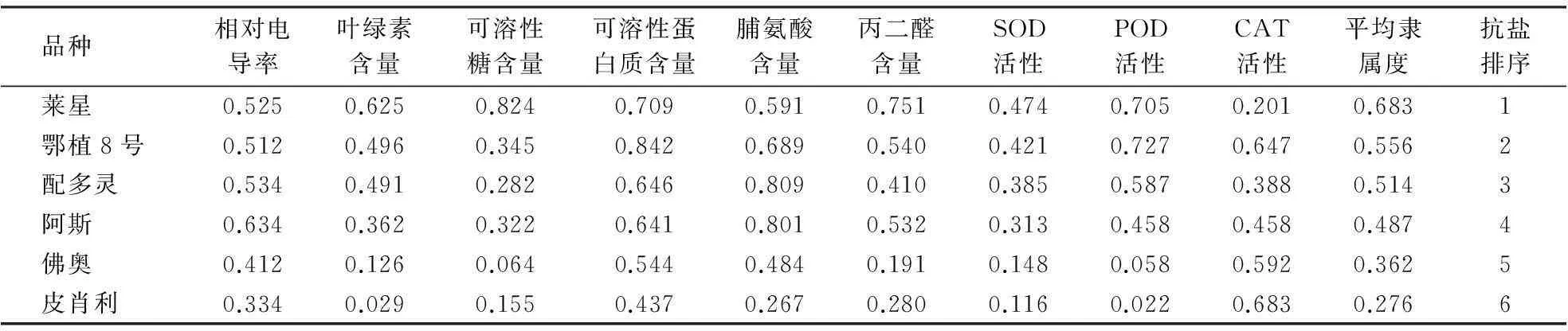
表2 NaCl胁迫下6个油橄榄品种各指标隶属函数值及抗盐性综合评价值
3讨论
本研究选择叶片相对电导率、叶绿素含量和MDA含量作为反映盐胁迫伤害症状的指标.试验所选用6个油橄榄品种叶片的相对电导率随处理盐浓度的升高均呈不同程度的上升趋势,表明胁迫盐浓度越高,油橄榄叶片细胞受伤害越严重,这与魏海霞等[4]的研究结果一致.6种油橄榄叶片的叶绿素含量随NaCl胁迫的加剧而均呈不同程度的下降趋势,说明NaCl胁迫导致油橄榄叶片叶绿素分解.丙二醛是由细胞内不饱和脂肪酸经过氧化而产生的,是细胞毒性物质,大量的累积能使细胞正常调节功能紊乱,损伤生物膜系统.陈涛等[5]研究表明,植物的抗盐性与MDA含量呈负相关,即抗盐性越强,MDA含量越小.本研究油橄榄6个品种中, 3项反映伤害症状的指标相对电导率和MDA含量的升高幅度、叶绿素含量的下降幅度由小到大的顺序均为:莱星<鄂植8号<配多灵<阿斯<佛奥<皮肖利,表明莱星和鄂植8号抗盐性较强,配多灵和阿斯中等,佛奥和皮肖利较弱.
脯氨酸、可溶性糖、可溶性蛋白是植物重要的渗透调节物质和营养物质,它们的积累能提高细胞的保水能力,减轻活性氧对膜脂和蛋白质的过氧化作用,从而对生物膜起到保护作用[6-7].
本研究发现,200 mmol·L-1氯化钠胁迫下,油橄榄叶片脯氨酸含量迅速上升,说明油橄榄在低浓度盐胁迫时反应迅速,当氯化钠浓度升到300 mmol·L-1时,脯氨酸含量持续增加,并达到峰值, 对保持细胞水分,保护膜结构具有重要的意义[8-9].随着盐胁迫持续加剧,脯氨酸含量有所降低,脯氨酸的累积对植物的保护作用是有限的.对可溶性糖含量变化的研究发现,200 mmol·L-1氯化钠胁迫时,油橄榄叶片内可溶性糖含量缓慢稳定上升,说明油橄榄为抵御轻中度盐胁迫,积累可溶性糖,减少氯化钠对细胞的伤害,这也表现出油橄榄对轻中度盐胁迫的适应性.当氯化钠浓度达到300~400 mmol·L-1时,莱星和鄂植8号可溶性糖含量持续上升,表现出较强的渗透调节能力,其他品种都有不同程度的下降,耐盐性较差.
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是逆境胁迫下,植物对膜脂过氧化的酶促防御系统的保护酶[11-12].本研究中油橄榄叶片SOD、POD、CAT活性基本上随胁迫的加剧总体上呈先升高后下降的趋势,莱星和鄂植8号在200~300 mmol·L-1氯化钠胁迫下,酶活性均有显著提高,表现出较强的抗氧化应激反应;而佛奥和皮肖利SOD和CAT活性仅有不明显的升高,POD活性随胁迫的加剧呈下降的趋势.莱星和鄂植8号的抗氧化酶活性显著高于佛奥和皮肖利,表明出较强的抗氧化能力.
本研究对各耐盐指标的相关分析表明,多数指标相互呈显著相关,反映的信息相互重叠,且各单项指标在油橄榄耐盐中作用不尽相同,植物的抗盐性受多种生理因素的影响,因此不能用单一指标评价植物的抗盐性[13-14].研究发现,6个油橄榄品种各单项指标的变化值与最后总体抗盐性评价结果并不完全一致,植物耐盐性是复杂的生理过程,任何单一指标的测定与研究都不能准确有效地评价植物的耐盐性.因此用生理指标进行抗盐性评价时结合统计分析方法,才能保证评价结果的可靠性.
油橄榄耐盐性是多因素作用的结果,机理比较复杂,作为品种耐盐性鉴定、引种筛选,生理生化指标无疑是最直接、最客观的参考依据,其数值的科学性很大程度上直接影响品种的耐盐分析结果,所以确定指标尤为重要.由于品种间性状存在差异,不同指标对品种的贡献力不同,平均计算分析难免会对结果产生偏颇,而生理生化指标可作为品种耐盐性最终评判指标,其它指标可依据生理生化指标进行相关分析, 利用权重系数,确定贡献指数,进行量化转换,耐盐鉴定结果会更加准确、科学.隶属函数分析提供了一条在多指标测定基础上对材料特性进行综合评价的途径[14-16],将其应用于油橄榄耐盐性的研究,可提高油橄榄耐盐性筛选的可靠性.
4结论
本研究结合不同油橄榄品种在NaCl盐胁迫下的生理反应,特别是几种渗透调节物质含量、抗氧化酶活性、及反映盐胁迫伤害症状的相对电导率、叶绿素和MDA含量变化,采用隶属函数法对其抗盐性进行综合评价,较为准确地比较所选6个油橄榄品种的抗盐能力.
在400 mmol·L-1NaCl盐胁迫下,油橄榄品种皮削利、佛奥的叶片相对电导率、叶绿素含量及丙二醛含量相对增幅较大,渗透调节物质含量相对增幅较小,表明高盐浓度胁迫下,二者受害最重,渗透调节能力较弱,而品种莱星和鄂植8号各指标的变化趋势与之相反,受害最轻,渗透调节能力较强,表现出良好的耐盐性.200~300 mmol·L-1NaCl盐胁迫下,莱星和鄂植8号保护酶活性相对增幅较大,表现出良好的抗氧化能力,而品种皮削利、佛奥相对增幅最小,抗氧化能力较差.可见,在NaCl盐胁迫条件下,莱星和鄂植8号等油橄榄品种能通过提高渗透调节物质含量和增强保护酶活性来缓解胁迫造成的过氧化伤害,从而表现出较强的抗盐能力.
根据不同油橄榄品种的平均隶属度(抗盐性综合评价值)确定的品种抗盐能力,基于隶属函数法的综合评价能准确鉴定油橄榄的抗盐性.
参考文献
[1] 刘祖棋,张石城.植物抗性生理学[M].北京:中国农业出版社,1994.
[2] 肖家欣.植物生理学试验[M].安徽:安徽人民出版社,2010.
[3] 杨升,刘正祥,张华新,等.3个树种苗期耐盐性综合评价及指标筛选[J].林业科学,2013,49(1):91-97.
[4] 魏海霞,孙明高,夏阳,等.NaCl胁迫对苦楝细胞膜透性和有机渗透调节物质含量的影响[J].甘肃农业大学学报,2005,40(5):599-603.
[5] 陈涛,王贵美,沈伟伟,等.盐胁迫对红麻幼苗生长及抗氧化酶活性的影响[J].植物科学学报,2011,29(4):493-501.
[6] 姜卫兵.无花果耐盐性生理指标的探讨[J].江苏农业科学,1998,7(4):97-101.
[7] 杨立飞,朱月林,胡春梅,等.NaCl胁迫对嫁接黄瓜膜脂过氧化、渗透调节物质含量及光合特性的影响[J].西北植物学报,2006,26(6):1195-1200.
[8] MOHAMMAD A H, MASAYUKI F. Evidence for a role of exogenous glycinebetaine and proline in antioxidant defense and methylglyoxal detoxification systems in mung bean seedlings under salt stress[J]. Physiology and Molecular Biology of Plants, 2010,16(1):19-29.
[9] 董秋丽,董宽虎,夏方山.氯化钠胁迫对芨芨草苗期脯氨酸代谢的影响[J].草业学报,2010,19(5):70-77.
[10] 张桂霞,李树玲.盐胁迫对两种沙枣抗氧化酶活性的影响[J].北方园艺,2011(10):46-49.
[11] 张晓勉,王泳,高智慧,等.盐胁迫对尖果沙枣和大果沙枣膜脂过氧化和渗透调节的影响[J].浙江林业科技,2012,32(4):1-5.
[12] 孙国荣,阎秀峰.盐胁迫对星星草幼苗保护酶系统的影响[J].草业学报,2001,9(1):34-38.
[13] 张国新,王秀萍,鲁雪林,等.隶属函数法鉴定水稻品种耐盐性[J].安徽农学通报,2011,17(1):36-37.
[14] 张俊叶,张力君,赵青山,等.7 种禾本科牧草种子苗期耐盐性的隶属函数法评价[J].内蒙古农业科技,2012(3):71-72.
[15] 王凯红,凌家慧,张乐华,等.两种常绿杜鹃亚属幼苗耐热性的主成分及隶属函数分析[J].热带亚热带植物学报,2011,19(5):412-418.
[16] 王昌禄,毕韬韬,王玉荣,等.用隶属函数值法评价10个蓖麻品种抗旱性[J].河南农业科学,2009(11):44-47.
(责任编辑:吴显达)
Physiological response and salt resistance evaluation of six varieties ofOleaeuropaeaunder salt stress
ZHAO Manli1, DU Qilan4, JIAO Jian1, LI Chaozhou2,3, JIN Qingxuan1, LIU Wenlan1
(1.College of Forestry; 2.College of Life Science and Technology; 3.Gansu Provincial Key Laboratory of Aridland Crop Science,Gansu Agricultural University, Lanzhou, Gansu 730070, China; 4.College of Life Science,Linyi University, Linyi, Shandong 276005, China)
Abstract:Salinity poses challenges to olive production in Northwest China and the east coast. In order to breed seedlings with relatively high salt resistance, six varieties of olive were imposed to 4 levels of salt stress (0, 100, 200, 300 mmol·L(-1) NaCl) and six physiological and biochemical indicators related with salt hardiness were measured at Longnan district, Gansu province. Results showed that both leaf REC and soluble sugar content increased with increasing salt concentration, with REC presenting a “S” pattern. Leaf chlorophyll content reduced when salt concentrations were elevated. While contents of soluble protein, proline, malondialdehyde (MDA) and the activities of SOD, POD, CAT peaked at some concentration and then dropped gradually. Subsequent comprehensive salt hardiness was evaluated by subordinate function analysis with sequence of salt resistance in following order: Leccino (0.683)>Ezhi 8 (0.556)>Pendolino (0.514)>Ascolano Tenera (0.487)>Frantoio (0.362)>Picholine (0.276). Leccino and Ezhi 8 showed the highest salt resistance, Pendolino at the middle, Frantoio and Picholine were the lowest.
Key words:Olea europaea; NaCl stress; physiological response
DOI:10.13323/j.cnki.j.fafu(nat.sci.).2016.01.004
中图分类号:S311
文献标识码:A
文章编号:1671-5470(2016)01-0019-07
作者简介:赵曼利(1990-),女,硕士研究生.研究方向:植物生理生态.Email:pn0529@yeah.net.通讯作者焦健(1966-),女,教授.研究方向:植物生态学.Email:jiaoj@gsau.edu.cn.
基金项目:国家国际科技合作专项(2012DFR30830);甘肃省农牧厅农业科技创新项目(GNCX-2012-47);甘肃农业大学林学院中青年基金(GSAUFC-2015-3).
收稿日期:2015-04-14修回日期:2015-06-14

