戴云山黄山松、马尾松针叶抗氧化酶活性的海拔梯度分布格局
祁丽霞, 刘金福,3, 黄嘉航, 苏松锦, 洪 伟, 唐 蓉, 周姗姗
(1.福建农林大学林学院;2.福建农林大学海峡自然保护区研究中心;3.福建农林大学计算机与信息学院,福建 福州 350002)
戴云山黄山松、马尾松针叶抗氧化酶活性的海拔梯度分布格局
祁丽霞1,2, 刘金福1,2,3, 黄嘉航2,3, 苏松锦1,2, 洪伟1,2, 唐蓉1,2, 周姗姗1,2
(1.福建农林大学林学院;2.福建农林大学海峡自然保护区研究中心;3.福建农林大学计算机与信息学院,福建 福州 350002)
摘要:以戴云山常见的2种亲缘关系较近的松属植物黄山松(Pinus taiwanensis)与马尾松(Pinus massoniana)为研究对象,探讨这2种植物针叶的抗氧化酶活性沿海拔梯度的差异及其分布规律.结果表明:黄山松、马尾松针叶的丙二醛(MDA)含量差异显著,马尾松MDA含量高于同海拔黄山松.MDA含量沿海拔梯度变化呈现出一定的规律性,在海拔1 400~1 700 m,北坡黄山松MDA含量均高于南坡,随着海拔的升高MDA含量呈先上升后下降的趋势.马尾松、黄山松抗氧化酶活性随海拔的变化情况基本一致,过氧化物酶(POD)、过氧化氢酶(CAT)活性随海拔的升高均呈先上升后下降再增强的趋势;但超氧化物歧化酶(SOD)活性随海拔的升高呈先升高后降低的趋势,而在高海拔处未有明显变化.
关键词:黄山松; 马尾松; 针叶; 抗氧化酶; 酶活性
海拔能影响植物的生长发育、物质代谢、结构和功能[1].随着海拔梯度的升高,环境因子会逐渐变得恶劣,如温度降低,气压及 CO2分压降低,光照强度增大.气温降低和辐射增加等因素不利于植物生长[2].相应地,在长期适应与进化过程中,植物体内形成了一套受遗传制约的生理适应机制.在逆境胁迫下,植物体内抗氧化能力提高,包括低分子质量抗氧化物质(主要有抗坏血酸(AsA)、谷胱甘肽(GSH)、脯氨酸(Pro)等含量的提高和抗氧化酶(如过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等)活性的增强,以抵御和清除活性氧,防止膜脂过氧化,保护细胞免受损伤[2-6].丙二醛(MDA)作为膜脂过氧化的最终产物,其含量常用来表示膜受到损伤的程度.因此逆境条件下抗氧化剂和抗氧化酶含量是植物能否适应逆境的重要生理生化指标[3-9].
黄山松与马尾松分布广阔,是我国东南部亚热带地区分布最广泛的针叶树种.对这2种植物针叶特性方面的研究多集中于针叶形态结构、幼苗生理生态等方面[10-18],而对其针叶抗氧化酶活性的研究较匮乏.己有研究表明由于地区适应性或者表型可塑性的原因,对于单个物种的叶片功能性状的种内变异在很小的环境梯度内就会发生[19-21].随着全球气候变暖趋势的加剧及人为干扰的影响,戴云山黄山松群落呈现衰退趋势,可能导致黄山松群落生物基因的缺失和黄山松群落生态系统稳定性的破坏.因此,研究不同海拔间黄山松、马尾松种内和同一海拔种间的抗氧化酶活性差异,了解松属植物对不同生境的适应性及对未来环境变化的响应,对保护松属种群具有理论和实践意义[22].本文对黄山松与马尾松针叶抗氧化酶活性对海拔梯度的影响进行研究,旨在揭示植物响应海拔梯度环境的适应方式与策略.
1材料与方法
1.1研究区概况
戴云山自然保护区于1985年建立,位于福建省德化县境内的上涌、赤水、大铭、雷锋、南埕、桂阳六镇交界处,东经118°05′22″—118°20′15″,北纬25°38′07″—25°43′40″,总面积达13 472.4 hm2.戴云山山脉是福建两大山脉之一,是福建中亚热带和南亚热带的自然分界,其中戴云山国家级自然保护区地处中亚热带向南亚热带的过渡区域,是中国单位面积生物多样性程度最高的自然保护区之一,同时拥有 6 400 hm2原生性黄山松群落,是目前中国大陆分布最南端、面积最大、分布最集中、保存最完好的天然黄山松群落,也是中国最大的黄山松种质基因基地.马尾松(Pinusmassioniana)和黄山松(P.hwangshanensis)是分布于戴云山的松科替代种,黄山松主要生长在海拔1 000~1 800 m;马尾松仅在低海拔1 000~1 400 m有少量分布.戴云山位于中亚热带与南亚热带的过渡带,为海洋季风气候区,气候温凉,四季分明,气候垂直变化大,小气候突出.保护区年平均气温15.6~19.5 ℃,年平均降雨量1 700~2 000 mm,相对湿度80%以上[23-25].
1.2样品的采集与处理
根据戴云山黄山松与马尾松沿海拔的分布范围(黄山松主要生长在海拔1 000~1 800 m;马尾松仅在低海拔1 000~1 400 m有少量分布,且黄山松、马尾松北坡的分布范围集中在1 100 m以上),于2014年3月在戴云山南北坡9个不同海拔梯度进行GPS定位取样,海拔梯度由低到高分别标记为:S0(800~900 m)、S1(900~1 000 m)、S2(1 000~1 100 m)、S3—N3(1 100~1 200 m)、S4—N4(1 200~1 300 m)、S5—N5(1 300~1 400 m)、S6—N6(1 400~1 500 m)、S7—N7(1 500~1 600 m)、S8—N8(1 600~1 700 m)、S9—N9(1 700~1 856 m).在每个海拔梯度随机选取5棵胸径大小基本一致的黄山松与马尾松成熟个体进行采样,并按东南西北4个方向分别采集针叶20束,混合后立即放入装有冰袋的泡沫盒中,封装后带回实验室于4 ℃冰箱中保鲜.
1.3抗氧化酶活性的测定
分别称取各待测叶片0.2 g,置于干燥并预冷的直径为8 cm的研钵中.加入0.05 mol·L-1、pH 7.0的磷酸钠缓冲液(PBS)2 mL(已加入聚乙烯毗咯烷酮(PVP))和少许石英砂,在冰裕中研磨至匀浆,然后转移至10 mL的离心管中,研钵用2 mL PBS冲洗至无色为止.洗脱液一并装入10 mL离心管,于4 ℃、1 5000g条件下离心15 min[26].
取上清液定容至4 mL,即为酶液,于4 ℃下保存,备用.
1.3.1MDA含量的测定采用硫代巴比妥酸TBA比色法[27].吸取以上酶液1.5 mL,加入2.5 mol·L-1TBA溶液2 mL,混匀之后在离心管里沸水浴上反应15 min,出现气泡后开始计时;然后迅速置于冰浴中冷却,再以4 000 r·min-1转速离心10 min;取上清液,测定其在532、600、450 nm波长下的光密度值.
MDA含量/(μmol·g-1)=(6.45×(D532 nm-D600 nm)-0.56D450 nm)×V/W
式中,V为提取液的总体积;W为提取酶液的植物样品的鲜重(0.2 g).
1.3.2SOD活性的测定SOD反应体系见表1.
共2支对照管,对照管的酶液均用0.1 mL pH 7.8的PBS代替,混匀后将1支对照管置于暗处,标记为对暗管,作为空白参比调零;其余各管置于4000 lx日光灯下反应15 min,要求各管光照情况一致.然后立即置于暗处终止反应.分别测定其他各管在560 nm处的光密度.以NBT被抑制50%为1个酶活性单位,以鲜重酶单位(U·g-1·h)表示.

表1 SOD反应体系
SOD活性=(D(CK)-D560 nm)×V/(D(CK)×W×Vt×50%)
SOD活性=(D(CK)-D560 nm)×4/(D(CK)×0.2×0.1×50%)=400(D(CK)-D560 nm)/D(CK)
式中,D(CK)为光照对照管在560 nm处的光密度;D560 nm为样品管在560 nm处的光密度;V为提取酶液的总体积(4 mL);W为提取酶液的植物样品鲜重(0.2 g);Vt为测定时加入酶液的体积(0.1 mL).
1.3.3过氧化氢酶(CAT)活性的测定采用紫外吸收法.反应体系:各管分别加入pH=7.8的0.05 mol·L-1的PBS 3 mL、待测酶液0.1 mL,最后逐管加入0.1 mol·L-1的H2O20.9 mL;每加完1管立刻计时,并摇匀后迅速倒入石英比色皿中,在240 nm下测定光密度;每隔1 min读数1次,共测4 min.待3支试管全部测定完后,计算酶活性(对照管以PBS缓冲液代替):
CAT活性=(ΔD240 nm×V)/(W×Vt×0.01×t)
CAT活性=(ΔD240 nm×4)/(0.2×0.1×0.01×t)
式中:V为酶提取液的总体积;W为提取酶液的样品鲜重(0.2 g);Vt为测定时加入酶液的体积(0.1 mL);t为反应时间(min).
1.3.4过氧化物酶(POD)活性的测定采用愈创木酚法[28].酶活性测定的反应体系为: pH=5.5的0.05 mol·L-1PBS 2.9 mL、2% H2O21 mL、0.05 mol·L-1愈创木酚1 mL,最后加入酶液0.1 mL以启动反应.以加热煮沸5 min的酶液为对照,反应体系加入酶液后,立即置于34 ℃水浴中保温3 min,然后在470 nm波长下测定光密度.测定4 min,每分钟测1次.以1 min内D470 nm变化0.01为1个酶活性单位,以ΔD470 nm/(min·g-1)表示.
POD活性=(ΔD470 nm×V)/(W×Vt×0.01×t)
式中:ΔD470 nm为反应时间内光密度的变化;V为酶液提取的总体积;W为提取酶液的植物样品鲜重;Vt为测定时加入酶液的体积(本试验取值0.1 mL).
1.4数据分析
采用SPSS 19.0软件进行分析,利用方差分析检验针叶的MDA含量、SOD活性的差异.采用Excel 2007进行作图分析.
2结果与分析
2.1黄山松、马尾松针叶MDA含量在南北坡的变化趋势
由表1、2可知,马尾松与黄山松针叶MDA含量随海拔梯度的变化呈现出一定规律性,即随海拔升高南北坡黄山松针叶MDA含量均呈现出先升后降的趋势,且在同一海拔北坡MDA含量高于南坡;马尾松MDA含量在南坡基本呈现出先升高后降低的趋势,北坡MDA含量呈先降低后升高的趋势,同一海拔北坡马尾松MDA含量显著高于南坡.方差分析结果表明,黄山松针叶MDA含量在南北坡的差异不显著(F=3.106,P=0.108),而马尾松MDA含量在南北坡间差异极显著(F=31.312,P<0.01).
2.1.1南坡针叶MDA含量随海拔的变化由表2可知,在低海拔区(S0—S2)马尾松针叶MDA含量总体上表现为先升后降的变化趋势,在海拔S2处含量较低,但低于中海拔区(S3—S5);中海拔区马尾松MDA含量较低,且随着海拔的升高呈先升后降的趋势,在海拔S5处含量最低;黄山松针叶MDA含量随海拔梯度的变化与马尾松有所差异,中海拔区黄山松MDA含量随海拔的升高而升高,其平均值为7.456 μmol·g-1;高海拔区(S6—S9),黄山松MDA含量随海拔的升高基本呈现出降低的趋势,其平均值为8.337 μmol·g-1.黄山松MDA含量与马尾松的比较结果表明,在S3—S4中海拔范围内,马尾松MDA含量高于黄山松;在S5处黄山松MDA含量高于马尾松,这可能是由于马尾松在临近海拔分布上限,受环境胁迫较强,产生较多的MDA.

表2 南坡黄山松—马尾松针叶MDA含量随海拔梯度的变化1)
1)同一列不同字母表示MDA含量差异达到显著水平(P<0.05).
方差分析表明,黄山松针叶MDA在各海拔梯度上差异极显著(F=23.187,P<0.01),马尾松MDA指标在不同海拔间差异极显著(F=125.269,P<0.01).
2.1.2北坡针叶MDA含量随海拔的变化由表3可知,在中海拔区(N3—N5),马尾松针叶MDA含量随着海拔升高呈现出先降低后升高的趋势,在海拔N4处含量最低;与马尾松不同,黄山松MDA含量在中海拔区呈现出升高趋势,且平均含量低于高海拔区.在高海拔区(N6—N9),MDA含量随海拔的升高而下降.表明黄山松针叶MDA含量在不同海拔上的差异极显著(F=33.365,P<0.01).黄山松MDA含量与马尾松对比,结果表明,在中海拔区(N3—N5),同海拔马尾松针叶MDA含量高于黄山松.

表3 北坡黄山松马尾松MDA含量随海拔梯度的变化1)
1)同一列不同字母表示MDA含量差异达到显著水平(P<0.05);-表示该海拔处无该树种.
2.2针叶抗氧化酶活性随海拔梯度的变化趋势
由表3、4可知,随着海拔的升高,南坡马尾松与黄山松的SOD含量均呈现出先升高后降低的趋势;北坡2种植物的SOD含量较低,马尾松SOD活性呈升高趋势,而黄山松SOD活性呈降低趋势.方差分析表明,黄山松SOD含量(F=56.699,P<0.01)以及马尾松SOD活性(F=21.217,P<0.01)在南北坡的差异均显著.随着海拔的升高,南坡黄山松CAT活性随海拔的升高呈现出升—降—升的趋势,马尾松CAT含量在中低海拔区呈现出先升后降的变化趋势;随着海拔的升高,北坡黄山松CAT活性呈先降后升的变化趋势,而马尾松CAT含量呈下降趋势.黄山松CAT含量在南北坡差异不显著(F=0.064,P=0.806),马尾松CAT含量在南北坡差异极显著(F=21.857,P<0.01).随海拔的升高,南坡马尾松针叶POD活性基本呈升高的趋势,黄山松针叶POD活性呈升—降—升的趋势;北坡马尾松针叶POD活性呈下降的趋势,黄山松针叶POD活性呈现出先降后升的趋势.方差分析表明,黄山松(F=0.2,P<0.664)以及马尾松(F=4.102,P=0.06)的POD活性在南北坡差异均不显著.
2.2.1南坡针叶抗氧化酶活性在海拔梯度上的变化由表4、5可知,在低海拔区(S0—S2),马尾松针叶SOD活性随海拔的升高而升高,但低于中海拔区;在中海拔区(S3—S5),随着海拔升高,SOD活性逐渐降低;黄山松针叶SOD活性随海拔梯度的变化趋势不同于马尾松,中海拔区黄山松针叶SOD活性逐渐升高,平均活性为204.897 U·g-1·h;而在高海拔区(S6—S7),SOD活性逐渐下降,平均活性为193.283 U·g-1·h.方差分析结果表明,南坡不同海拔梯度间马尾松SOD活性差异均极显著(F=532.574,P<0.01),不同海拔梯度间黄山松SOD活性差异也达到极显著水平(F=129.65,P<0.01).黄山松SOD活性与马尾松的对比结果表明,在海拔S3处,马尾松SOD活性高于同海拔黄山松,而在海拔S4、S5处黄山松的SOD活性高于马尾松.总体上中海拔区这2种植物的SOD活性差异不显著(F=2.816,P=0.113).
由表4、5可知,低海拔区,马尾松针叶CAT活性随着海拔的升高基本呈现出先降后升的趋势,且高于中海拔区.在中海拔区,随海拔的升高,其CAT活性逐渐降低;黄山松CAT活性的变化趋势与马尾松有所不同,黄山松CAT活性在中海拔区呈先升高后降低的趋势,平均值为53.333 U·min-1·g;高海拔区,其CAT活性随海拔的升高而升高,平均值为40.833 U·min-1·g,中海拔CAT活性高于低海拔.黄山松的CAT活性与马尾松的对比结果表明,在S4、S5海拔处黄山松CAT活性高于同海拔的马尾松,但在中海拔区这2种植物的CAT活性差异不显著(F=3.674,P=0.073).方差分析结果表明,南坡黄山松(F=43.139,P<0.01)以及马尾松(F=73.941,P<0.01)针叶CAT活性均在海拔梯度间差异显著.低海拔区,马尾松针叶POD活性随着海拔的升高呈先降后升的变化趋势;中海拔区,随着海拔的升高,马尾松针叶POD活性基本呈增高趋势,且中海拔区高于低海拔区;黄山松POD活性的变化趋势不同于马尾松,中海拔区,黄山松POD活性呈先降后升的变化趋势,其平均值为26.667 U·min-1·g;高海拔区,黄山松POD活性基本呈升高的趋势,其平均值为22.00 U·min-1·g.方差分析结果表明,黄山松POD活性(F=13.00,P<0.01)与马尾松POD活性(F=5.883,P=0.006)在海拔梯度间差异显著.中海拔区2种针叶植物的POD活性种间对比结果表明,中海拔区黄山松POD活性均高于同海拔马尾松,且中海拔区这2种植物POD活性种间差异不显著(F=0.062,P=0.806).
2.2.2北坡抗氧化酶活性在海拔梯度上的变化黄山松与马尾松的SOD活性对比结果(表6、7)表明:中海拔区,马尾松SOD活性随海拔的升高逐渐升高,但在海拔梯度间无明显差异(F=2.767,P=0.141).黄山松SOD活性在海拔N4处高于同海拔马尾松,而在N5处其活性低于同海拔马尾松.双因素方差分析结果表明,北坡这2种植物的SOD活性差异不明显(F=2.361,P=0.136);中海拔区黄山松SOD活性随海拔的升高而降低,其平均活性为93.501 U·g-1·h;高海拔区,黄山松SOD活性呈先升后降的趋势,其平均活性为86.322 U·g-1·h,低于中海拔区.方差分析结果表明,黄山松SOD活性在海拔梯度间差异极显著(F=8.715,P=0.001).
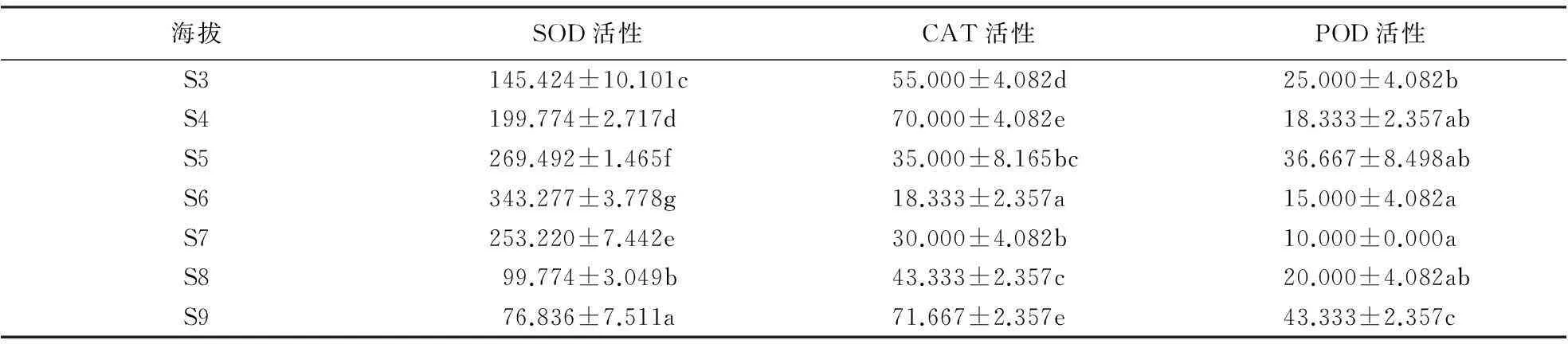
表4 南坡黄山松针叶抗氧化酶活性随海拔梯度的变化1)
1)同一列不同字母表示抗氧化酶活性差异达到显著水平(P<0.05).
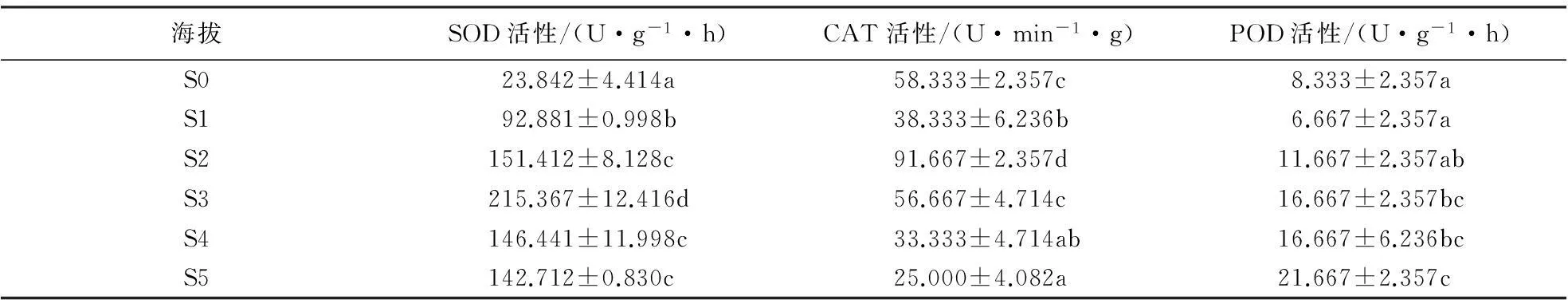
表5 南坡马尾松针叶抗氧化酶活性随海拔梯度的变化1)
1)同一列不同字母表示抗氧化酶活性差异达到显著水平(P<0.05).
中海拔区这2种植物的CAT、POD活性种间对比结果(表6、7)表明:中海拔区,随海拔的升高,马尾松与黄山松针叶CAT、POD活性均呈降低趋势,且马尾松CAT活性高于同海拔黄山松,但差异不显著(F=1.689,P=0.223).马尾松POD活性低于同海拔黄山松,且差异显著(F=9.494,P=0.012);中海拔区黄山松针叶的CAT、POD活性均呈下降趋势,CAT活性平均值为55.000 U·min-1·g,POD活性平均值为U·min-1·g;而在高海拔区这2种酶的活性均呈上升的趋势,CAT活性平均值为57.5 U·min-1·g,POD活性平均值为22 U·min-1·g.方差分析结果表明,北坡马尾松CAT活性在海拔梯度间无明显差异(F=2.773,P=0.140),POD活性在海拔梯度间差异显著(F=24.333,P=0.001);黄山松CAT活性在海拔梯度间差异显著(F=12.45,P<0.01),POD活性在海拔梯度间差异显著(F=21.982,P<0.01).
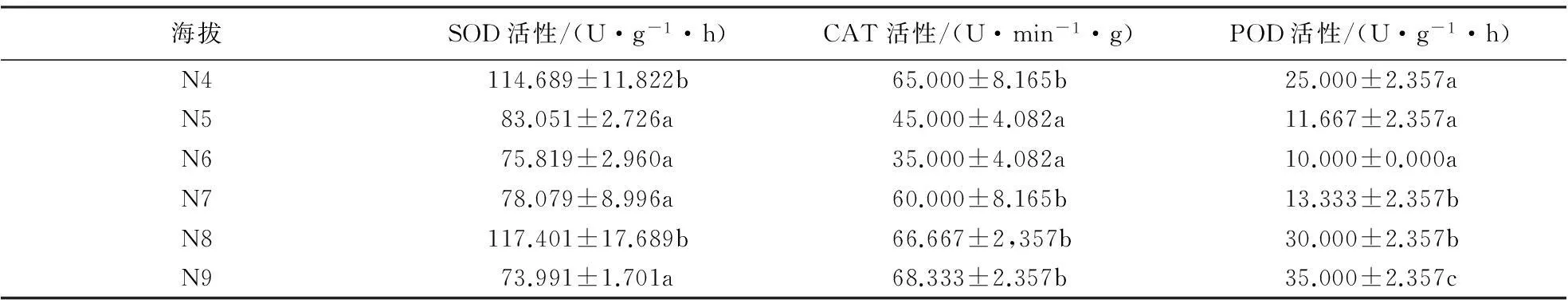
表6 北坡黄山松针叶抗氧化酶活性随海拔梯度的变化1)
1)同一列不同字母表示抗氧化酶活性差异达到显著水平(P<0.05).
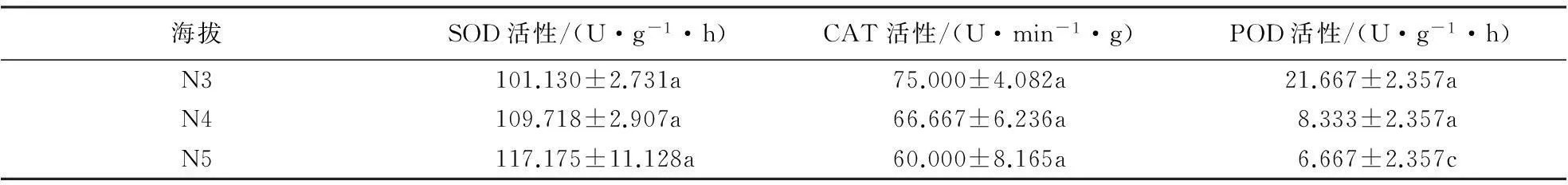
表7 北坡马尾松针叶抗氧化酶活性随海拔梯度的变化1)
1)同一行不同字母表示抗氧化酶活性差异达到显著水平(P<0.05).
3讨论
植物在环境的胁迫下,对环境的抵御力降低,破坏了活性氧的代谢平衡,导致活性氧大量产生,对膜质、蛋白质造成一定的损伤,体内自由基产生具有细胞毒性的物质(如MDA)[28-30].马尾松和黄山松针叶MDA含量随海拔的升高而提高,原因可能是随海拔的升高,低温胁迫程度增强,膜脂过氧化程度加剧.
黄山松、马尾松针叶中的MDA含量随着海拔的升高表现出先升后降的趋势,表明随海拔升高,针叶活性氧的产生与清除系统遭到破坏,膜受到了一定程度的伤害.而当海拔升高到1 600 m后,MDA含量开始下降,1 800 m处的MDA含量达到最低,表明林线附近黄山松针叶膜受伤害的程度相对较小.由于黄山松长期生长在这样的环境中,尽管林线附近的环境较低海拔更恶劣,黄山松已适应了这种环境,形成了一定的保护机制.
Wildi et al[32]认为,随着海拔的升高,植物体内的抗氧化系统有着各自不同的响应模式.本试验中,随着海拔的升高,南坡黄山松针叶中的POD、CAT活性表现出一致的规律性,即随着海拔的升高呈先升高后降低再升高的趋势,而SOD活性随着海拔的升高呈先升高后降低的趋势.说明虽然随着海拔的升高,温度下降,氧含量降低,致使植物所受的胁迫程度加大,但同时也增强了植物内部的保护系统,提高了活性氧的清除效率,从而使细胞内的活性氧水平降低,使植物细胞受到的损伤减小.由于植物对环境的长期适应,较高海拔区植物体内活性氧保持在较低水平,酶活性水平较低;而在高海拔区,太阳辐射以及紫外线使得植物体内活性氧超出正常水平,底物浓度升高,抗氧化酶被诱导合成,使其活性增强,这与Polle et al[33]对高海拔地区挪威云杉针叶中抗氧化酶活性的研究结果相似.高海拔区SOD活性随海拔的升高未呈现出明显的升高趋势,而呈现出降低的趋势,但叶片中的CAT、POD活性并未降低,这有利于细胞质中H2O2的清除.北坡POD、CAT、SOD活性随着海拔的升高先下降后上升.可能是因为北坡温度比南坡低,由于黄山松对北坡低温环境的长期适应,使得体内活性氧保持在较低水平,酶活性较低.与南坡相似,随着北坡海拔梯度的升高,太阳辐射以及紫外线增强,体内活性氧积累超过正常水平,抗氧化酶活性升高.本研究结果表明,随着海拔的升高黄山松3种抗氧化酶活性的变化趋势并不一致.植物抗氧化能力并不取决于单一的一种酶活性的变化,黄山松抗氧化酶系统之间可能存在一定的相互作用,这可能是黄山松适应高海拔环境的重要生理机制之一.与黄山松相似,马尾松随海拔的上升,南坡CAT、SOD、POD活性随着海拔的升高而升高,接近马尾松分布上限时CAT、SOD活性又逐渐下降.北坡CAT、POD活性随着海拔的升高而下降,SOD活性的变化并不明显.这与汪晓峰等[6]对红景天中AsA-POD酶的研究结果相类似,这可能是由于在恶劣环境条件下,植物体内产生了大量活性氧,超出细胞自身的防御能力,严重破坏了细胞的结构和功能,导致酶蛋白氧化变性、酶活性明显降低.说明在不同海拔梯度上,马尾松、黄山松抗氧化酶系统的变化主要受温度的影响,随着海拔的升高,温度降低,植物通过增强酶活性来是适应海拔上升的恶劣环境.
参考文献
[1] 吴栋栋,周永斌,于大炮,等.不同海拔长白山岳桦的生理变化[J].生态学报,2009,29(5):2 279-2 285.
[2] 潘红丽,李迈和,蔡小虎,等.海拔梯度上的植物生长与生理生态特性[J].生态环境学报,2009,18(2):722-730.
[3] 梁建萍,牛远,谢敬斯,等.不同海拔华北落叶松叶三种抗氧化酶活性与光合色素含量[J].应用生态学报,2007,18(7):1 414-1 419.
[4] 林小虎,秘树青,郭振清,等.不同海拔天女木兰叶抗氧化酶活性与光合特征[J].经济林研究,2011,29(2):60-64.
[5] 马中屾,王中生,余华,等.不同海拔梯度下黄山松与马尾松针叶形态光合生理特性的研究[J].安徽农业科学,2012,40(29):14 155-14 158.
[6] 汪晓峰,任红旭,孙国钧.四裂红景天与长鳞红景天叶片中抗氧化系统随海拔梯度的变化[J].植物生态学报,2005,29(2):331-337.
[7] 周党卫,朱文琰,腾中华,等.不同海拔珠芽蓼抗氧化系统的研究[J].应用与环境生物学报,2003,9(5):489-492.
[8] 包卓,孟祥英,张晓松,等.干旱胁迫对5种园林绿化植物生理生化的影响[J].经济林研究,2010,28(1):46-50.
[9] 纪炜炜.黄山地区黄山松针叶结构的海拔变异[D].北京:中国科学研究生院,2006.
[10] 洪淑媛.黄山松生理生态特性研究[D].合肥:安徽农业大学,2006.
[11] 陈茂铨,王根轩,刘术新.合成革主要化学污染物对黄山松生理生态特性的浓度效应研究[J].植物生态学报,2011,35(1):66-72.
[12] 翟大才,何芝兰,冯锦霞,等.利用ISSR标记分析黄山松与马尾松的基因渐渗[J].林业科技,2012(6):4-6.
[13] 杜华强,葛宏立,范文义.马尾松针叶光谱特征与其叶绿素含量间关系研究[J].光谱学与光谱分析,2009,29(11):3 033-3 037.
[14] 李祥光,孙芳芳.广州城郊环境梯度下马尾松针叶元素质量分数变化特征[J].生态环境,2006,16(6):1 602-1 607.
[15] 黄守程,刘爱荣,何华齐.1-MCP处理对双孢蘑菇采后生理生化特性的影响[J].湖北农业科学,2010,49(8):1 960-1 961.
[16] 李淑娴.马尾松和黄山松物种分化遗传机制研究[D].南京:南京林业大学,2012.
[17] 祁承经,林亲众.马尾松一新变种[J].植物研究,1988(3):143-145.
[18] FAJARDO A, PIPER F I. Intraspecific trait variation and covariation in a widespread tree species (Nothofaguspumilio) in southern Chile[J]. New Phytologist, 2011,189:259-271.
[19] HULSHOF C M, SWENSON N G. Variation in leaf functional trait values within and across individuals and species: an example from a Costa Rican dry forest[J]. Functional Ecology, 2010,24:217-223.
[20] ALBERT C H, THUILLER W, YOCCOZ N G, et al. Intraspecific functional variability: extent, structure and sources of variation[J]. Journal of Ecology, 2010,98:604-613.
[21] 朱德煌,刘金福,洪伟.戴云山黄山松群落主要树种更新生态位研究[J].热带亚热带植物学报,2012,20(6):561-565.
[22] 任国学,刘金福,徐道炜,等.戴云山国家级自然保护区黄山松群落类型与树种多样性分析[J].植物资源与环境学报,2011,20(3):82-88.
[23] 郑世群,刘金福,黄志森,等.戴云山罗浮栲林主要乔木树种营养生态位研究[J].热带亚热带植物学报,2012,20(2):177-183.
[24] 刘金福,朱德煌,等.戴云山黄山松群落与环境的关联[J].生态学报,2013,30(18):5 731-5 736.
[25] 郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社,2006.
[26] 汪婷.不同耐铝型杉木家系的筛选及抗性机理研究[D].福州:福建农林大学,2013.
[27] 陈晓莉.不同海拔青海云杉和祁连圆柏生理生态适应性研究[D].甘肃:甘肃农业大学,2008.
[28] 郭燕,朱杰,许自成.植物抗坏血酸氧化酶的研究进展[J].中国农学通报,2008,24(3):196-199.
[29] 李树斌,翁闲,王士亚,等.铝胁迫及营养复合作用对杉木幼苗抗氧化酶活性的影响[J].福建农林大学学报(自然科学版),2015,44(3):265-268.
[30] 姚凤琴,赖钟雄.香蜂花的离体保存及试管苗抗氧化酶活性的变化[J].福建农林大学学报(自然科学版),2014,43(3):264-268.
[31] 张绍先,苏智先,高菊.不同海拔对珙桐叶片生理指标的影响[J].四川林业科技,2013,34(2):10-15.
[32] WILDI B, L TZ C. Antioxidant composition of selected high alpine plant species from different altitudes[J]. Plant, Cell and Environment, 1996,19:138-146.
[33] POLLE A, RENNENBERG H. Field studies on Norway spruce trees at high altitude:Ⅱ. defrence systems against oxidative stress in needles[J]. New Phytol, 1992,121:635-642.
(责任编辑:叶济蓉)
The altitudinal gradient pattern of antioxidant enzyme activity inPinustaiwanensisandPinusmassoniananeedles
QI Lixia1,2, LIU Jinfu1,2,3, HUANG Jiahang2,3, SU Songjin1,2, HONG Wei1,2, TANG Rong1,2, ZHOU Shanshan1,2
(1.College of Forestry; 2.Cross-Strait Nature Reserve Research Center; 3.College of Computer and Information Science,Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Abstract:To elucidate the mechanism of adaptability to environment for needles, antioxidant enzyme activity of Pinus taiwanensis and Pinus massoniana at different altitude and slope aspect were compared in Daiyun Mountain. Results showed that MDA content of P.massonianawere was significantly higher than those of P.taiwanensis at the same altitude. Malondialdehyde content presented certain regularity along the altitude: MDA contents of P.taiwanensis at the northern slope were higher than those at the southern slope at altitude between 1400m and 1700m, after which MDA content increased and then went down. With increased elevation, catalase and peroxidase activities of two plants fluctuated in a similar patttern, which decreased after the first rise, and followed by a second rise to a higher level. Superoxide dismutase activity declined after a initial rise, and remianed at the same level at higher altitude. To summarize, this study provided insight into the mechanism of plant in response to stress and lay a foundation for adaptive strategy to climate change.
Key words:Pinus taiwanensis; Pinus massoniana; needles; antioxidant enzyme; enzyme activity
DOI:10.13323/j.cnki.j.fafu(nat.sci.).2016.01.007
中图分类号:Q948.15
文献标识码:A
文章编号:1671-5470(2016)01-0035-07
作者简介:祁丽霞(1989),女,硕士.研究方向:森林生态学、森林旅游.通讯作者刘金福(1966-),男,教授,博士生导师.研究方向:野生动植物保护与利用.fjljf@126.com.
基金项目:福建省科技厅资助项目(2015Y0042).
收稿日期:2015-04-20修回日期:2015-10-15

