一株海洋贝类肠道琼胶降解菌的筛选与鉴定
张林林, 江玉姬, 张龙涛, 郑宝东, 张 怡, 王培森, 李庆旺
(福建农林大学食品科学学院,福建 福州 350002)
一株海洋贝类肠道琼胶降解菌的筛选与鉴定
张林林, 江玉姬, 张龙涛, 郑宝东, 张怡, 王培森, 李庆旺
(福建农林大学食品科学学院,福建 福州 350002)
摘要:以琼胶为唯一碳源,从海洋贝类肠道微生物共筛选出44株降解琼胶的海洋细菌,通过初筛和DNS法测定酶活得到一株产酶最高的菌株A-001,酶活力可达到13.01 U·mL(-1).菌落形态为乳白色,革兰氏阴性菌,呈弯曲短杆状,通过微生物动力学实验,细菌A-001具有运动性.据生理生化特征和16SrDNA序列可鉴定A-001为溶藻弧菌(Vibrio alginolyticus).
关键词:贝类; 琼胶酶; 细菌; 筛选; 鉴定
琼胶,还被称为琼脂,具有水溶性,是一种复杂的混合物,三大海藻多糖之一.由于琼胶具有较好的稳定性与胶凝性等特性,在食品、医药等行业应用十分广泛[1].随着海藻多糖工业的持续健康发展,对琼胶多糖降解酶的研究深度与广度也在不断加大.琼胶酶及降解琼胶的菌株也成为近年来海洋生物资源研究、开发的焦点之一.
目前产琼胶酶的海洋微生物主要是从海水中富集筛选而获得的.海洋杂食动物中的贝类多以藻类为食物来源,其肠道微生物具有较高的藻类多糖降解酶,开发潜力较大.但目前为止,在无脊椎肠腔中筛选产多糖降解微生物的报道较少,仅见刘江涛等[2]从鲍肠道筛选出可降解琼胶的多食鞘氨醇杆菌.本研究主要是从海洋贝类肠道中筛选出产琼胶酶的菌株,以期获得具有独立知识产权的产酶菌株,为后续研发奠定基础.
1材料与方法
1.1材料与设备
1.1.1试验原料花蛤、文蛤和海蚌(购自福建省福州市马尾海产品交易市场);琼脂粉(分析纯,购自于北京康倍斯科技有限公司).
1.1.2主要仪器设备恒温培养箱(型号RXZ-280B,新江南仪器有限公司),恒温培养摇床(型号ZWY-2102C,上海智城分析仪器制造有限公司),紫外分光光度计(型号722,北京谱析通用有限责任公司),灭菌锅(型号HCO14-11-01),Tbermal Cycler PCR仪(型号S1000),超净工作台(型号SW-CJ-2FD,苏净集团苏州安泰空气技术有限公司),BIO RAD核酸电泳仪,冷冻离心机(型号Alleqra X-30R,美国贝克曼库尔特有限公司),超低温冰箱(型号TSE240V,赛默非世尔科技公司),高档电子数显卡尺(上海茳桦工量具有限公司),微生物生理生化鉴定试剂盒(广东环凯微生物科技有限公司),DNA试剂盒(购自北京康为世纪生物科技有限公司).
1.1.3培养基LB液体培养基:胰蛋白胨10 g·L-1,酵母抽提粉5 g·L-1,氯化钠10 g·L-1,pH调为约7.5.
2216E固体培养基(购自中国青岛高科园海博生物技术有限公司):蛋白胨5 g·L-1,酵母浸粉1 g·L-1,柠檬酸铁0.1 g·L-1,氯化钠19.45 g·L-1,氯化镁5.98 g·L-1,硫酸钠3.24 g·L-1,氯化钙1.8 g·L-1,氯化钾0.55 g·L-1,碳酸钠0.16 g·L-1,溴化钾0.08 g·L-1,氯化锶0.034 g·L-1,硼酸0.022 g·L-1,硅酸钠0.004 g·L-1,氟化钠0.0024 g·L-1,硝酸钠0.0016 g·L-1,磷酸氢二钠0.008 g·L-1,琼脂15 g·L-1,pH 7.6±0.2.
斜面培养基:同2216E固体培养基.
分离筛选培养基:琼脂粉20 g·L-1,氯化钠20 g·L-1,七水硫酸镁0.5 g·L-1,硝酸钠2 g·L-1,磷酸氢二钾1 g·L-1,七水硫酸亚铁0.02 g·L-1,氯化钙0.2 g·L-1,pH 7.5.
液体发酵培养基:琼脂粉20 g·L-1,氯化钠35 g·L-1,蛋白胨5 g·L-1,酵母浸膏10 g·L-1,七水硫酸铁0.1 g·L-1,去离子水1 L,pH 7.
种子发酵培养基:同液体发酵培养基相同,pH约为7.5.
上述培养基均采用121 ℃、20 min高压蒸汽灭菌;所有试验试剂均为分析纯或生化试剂.
1.1.4主要试剂pH 7磷酸氢二钠—柠檬酸缓冲液;DNS试剂;鲁戈氏碘液(碘1 g;碘化钾2 g;蒸馏水300 mL).
1.2样品处理
采用75%的酒精对海蚌、文蛤与花蛤的表面进行擦拭消毒处理,然后在超净工作台里分别获得该三种海产品的肠道,放入无菌的研钵里,加入1 mL的无菌生理盐水,快速研磨,静置5 min后吸取上清液1 mL进行梯度稀释为10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8备用.
1.3菌株筛选
1.3.1分离培养在2216E平板的上面分别接入稀释度不同的菌液0.2 mL,涂匀,28 ℃恒温倒置培养48 h,然后从平板上挑取单菌落在新鲜无菌的平板上再次进行划线分离纯培养,纯化后的菌株保存于2216E斜面培养基上并编号.
1.3.2初筛从2216E平板上共分离到90株菌株,将2216E斜面培养基上保存的90株菌株进行活化,将活化的菌株用无菌牙签接种到筛选培养基上,于28 ℃倒置培养48 h后,观察菌落周围现象,把周围有显著凹陷或者透明圈的菌落挑选出来,并在2216E斜面培养基上保存,得到可以降解琼胶的菌株.
1.3.3染色复筛将具有降解琼胶的菌株用无菌牙签接种在筛选培养基上,28 ℃恒温倒置培养48 h后,用鲁戈氏碘液进行染色观察.如果菌株产琼胶酶可以降解琼胶,则琼胶被降解后不会被染色,而菌落周围将形成透明圈[3],测定透明圈的直径.
1.3.4测酶活复筛取经过纯化的可降解琼胶菌株,按无菌操作各挑取一环转接到装有25 mL种子培养基的三角瓶里,于28 ℃、150 r·min-1的摇床中震荡培养24 h,再分别取10 mL种子培养液接种到90 mL液体发酵培养基中,28 ℃,150 r·min-1摇床震荡培养32 h,将发酵好的培养液于5000 r·min-1、4 ℃条件下离心15 min,取上清液作为胞外酶粗酶液测定酶活力,筛选出酶活最高的菌株.
1.4酶活力测定
琼胶酶活性测定采用DNS(3,5二硝基水杨酸)法[4-5],以原糖增加量作为指标:取1 mL粗酶液加入装有20 mL 0.2%琼胶底物的三角瓶中,于35 ℃摇床内震荡反应60 min,对照组用1 mL灭酶液和20 mL 0.2%琼胶底物混合液在同样条件下反应相同的时间.反应结束后,取2 mL反应液加入2 mL的DNS试剂于沸水中反应5 min,迅速冷却至室温,然后定容至6 mL并充分混匀,以灭酶的反应液为参比,于520 nm处测定吸光值.酶活力单位的定义:温度为35 ℃时,1 min内产生1 μg还原糖(以半乳糖计)所需要的酶量即为一个酶活力单位(U).
△A:吸光度;n:稀释倍数;t:反应时间60min;7.3:标准曲线的斜率;0.2526:标准曲线的截距.
1.5菌株鉴定
1.5.1形态观察和生理生化鉴定对生长48h后A-001菌体的形态进行观察,并进行革兰氏染色.生理生化的鉴定试验按照第八版《常见细菌系统鉴定手册》[6]与《伯杰氏细菌鉴定手册》[7]进行,本试验选用的是弧菌科细菌鉴定管(购自广东环凯微生物科技有限公司),根据GYZ-9V鉴定系统,一共有9项生化试验,分别是:赖氨酸、精氨酸、鸟氨酸、葡萄糖产气、蔗糖、甘露醇、水杨苷、6%氯化钠和枸橼酸盐.这些生化实验主要是对邻单胞菌属、气单胞菌属、弧菌属和属内不同的种进行区别.按本鉴定系统的要求,首先要确定被鉴定的菌株是弧菌科的,否则将无法鉴定.弧菌科细菌的代谢为发酵型,氧化酶为阳性,但在弧菌属中梅氏弧菌比较特殊,为氧化酶阴性.故在用GYZ-9V鉴定系统鉴定细菌前,须先确认分离菌株为氧化—发酵(OF)型代谢和氧化酶阳性.
1.5.216SrDNA序列测定及同源性分析对A-001菌株进行培养后收集菌体细胞,使用DNA试剂盒提取细菌全基因组,以提取得到的细菌基因为模板扩增16SrDNA,采用细菌鉴定的通用引物:正向引物为27F:5′-GAAGTTTGATCCTGGCTCAG-3′,反向引物为1492R:5′-GGTTACCTTACGACTT-3′.PCR反应体系(25uL):2×EcoTaqPCRSuperMix(+dye)12.5μL(包括TaqDNA聚合酶、dNTPs和优化的反应缓冲液,浓度为2倍);20μmol·L-1上下游引物各0.5μL;细菌DNA模板1.0μL;ddH2O10.5μL.扩增的条件为94 ℃预变性5min,94 ℃变性30s,58 ℃退火30s,72 ℃延伸90s,共35个循环,72 ℃总延伸10min.取PCR产物7μL上样于1%的琼脂糖凝胶孔中,于100V电压下电泳30min后,在凝胶成像系统中检测目的条带.将PCR产物送至铂尚生物技术有限公司进行细菌基因测序,再将测定的16SrDNA基因序列在核糖体数据库http://rdp.cme.msu.edu/index.jsp上进行比对.
2结果与分析
2.1产琼胶酶菌株的初筛与复筛
从90个菌株通过筛选培养基筛选得到44株降解琼脂的细菌,将这44株菌进行复筛,获得6株具有较大透明圈的菌株A-001、A-007、A-014、D-002、J-003、J-004,其透明圈的直径分别为29.00、26.17、28.00、13.23、14.71、27.29mm,其中A-001和A-014经鲁戈氏碘液染色后的透明圈最大,如图1所示.
2.2琼胶酶活的测定
将鲁戈氏染色后透明圈较大的6株菌,采用DNS法测定琼胶酶活性(表1).其中,A-001菌株具有较高的酶活性,酶活为13.01 U·mL-1,由表1可知酶活最高的菌株A-001是酶活最低菌株J-004的1.94倍.

表1 不同菌株产琼胶酶的活性
2.3菌落形态观察
菌株A-001在分离培养基上生长,菌落湿润,显乳白色,边缘整齐,圆形,如图2所示.菌株培养72 h菌落直径为2.6 mm.革兰氏染色为阴性,显微镜下观察菌体为弯曲短杆状.
2.4生理生化鉴定
在使用弧菌科细菌生化鉴定编码(GYZ-9V)系列之前,对A-001菌株进行了0-F试验和氧化酶试验.结果表明:A-001菌株为F(发酵型)型,氧化酶阳性.因此,属于弧菌科细菌.结合生理生化特性(表2),可判定A-001菌株为弧菌属.
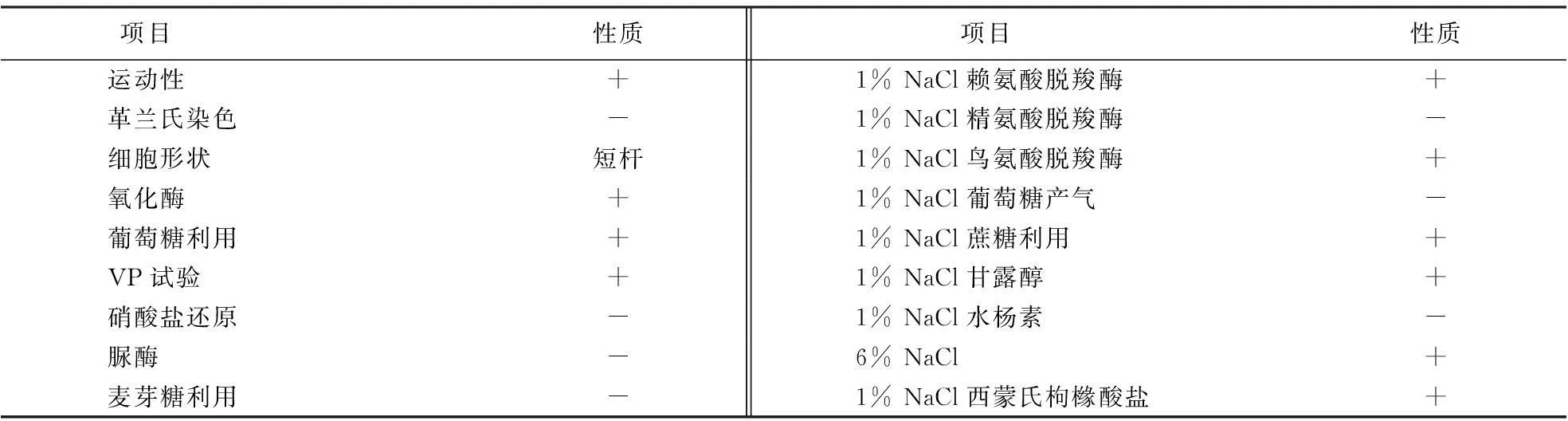
表2 菌株A-001的生理生化特性1)
1)“+”为阳性;“-”为阴性.
2.516SrDNA序列分析及同源性分析
将提取的A-001菌株总DNA,利用16SrDNA通用引物进行PCR扩增后,对照为2000 bp的Mark,根据电泳条带可知,菌株A-001的16SrDNA基因长度约为1500 bp,送至铂尚生物技术(上海)有限公司进行测序,确定16SrDNA基因序列长度为1420 bp.将测得的基因序列在核糖体数据库中进行比对,相似度在98%以上的菌株见表3.
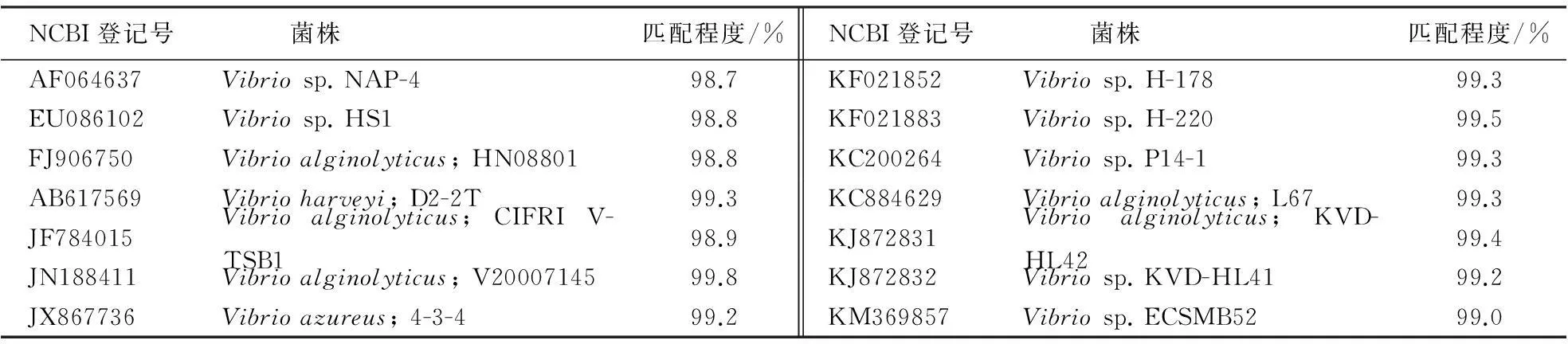
表3 核糖体数据库中与A-001相似度为98%以上的菌株
菌株A-001的16SrDNA序列与核糖体数据库中的14株弧菌(Vibriosp.)的16SrDNA序列相似度均达到98%以上,因此可以判断A-001菌株是弧菌属.由于A-001与Vibrioalginolyticus; V20007145,Vibrioalginolyticus; KVD-HL42,Vibrioalginolyticus; L67的同源性分别为99.8%、99.4%、99.3%,可以认为A-001是一株溶藻弧菌.虽然国内外从海水中已分离出多株可以降解琼胶的弧菌,如刘丽莉[4]在海水中分离到一株产琼胶酶的弧菌,酶活为32.1 U·mL-1;Wang et al[8]在海水中分离到的产琼胶酶弧菌的酶活为310 U·mL-1,虽然A-001酶活不高,但是在贝类肠道微生物筛选出可降解琼胶的溶藻弧菌,国内外少有报道.本研究从贝类肠道筛选到的溶藻弧菌具有特异性,对于贝类养殖具有潜在应用价值.目前已据报道可以降解琼胶的弧菌,有杜宗军等[9]从海水里得到Vibriotubiashii; Aoki et al[10]从海水里得到海洋细菌Vibriosp. AP-2;Sugano et al[11]得到Vibriosp. strain JT0107,因为在核糖体基因库中没有找到这些菌株的16SrDNA序列,因此无法进行同源性比对.
3结论
本研究从海洋贝类肠道分离到多株降解琼胶的菌株,经过比较各菌株产生透明圈的大小和DNS法测胞外酶活判断其降解琼胶的能力,得到了琼胶酶活最高的菌株是A-001,酶活力达到13.01 U·mL-1.通过生理生化实验和16SrDNA序列比对分析,可知该菌株与溶藻弧菌的同源性最高,初步鉴定为溶藻弧菌,命名为溶藻弧菌A-001.我们将对该菌株进行进一步的研究与诱变,以提高其产酶能力和酶活性,应用于生产.
参考文献
[1] 梅建凤,李莎,茅鹤婷,等.一株产琼胶酶海洋细菌的分离与鉴定[J].海洋科学,2014(2):71-75.
[2] 刘江涛,蔡俊鹏.鲍琼胶酶高产细菌的筛选和鉴定[J].水产科学,2005(8):17-19.
[3] HODGSON D, C HATER K. A chromosomal locus controlling extracellular agarase production by Streptomyces coelicolor A3(2), and its inactivation by chromosomal integration of plasmid SCP 1. Journal of General Microbiology, 1981,124(2):339-348.
[4] 刘丽莉,祖国仁.新型产琼胶酶海洋细菌的筛选和鉴定[J].湖北农业科学,2014(20):4831-4834.
[5] 江玉姬,陈汉青,童金秀,等.产纤维素酶菌株C_(真3)的筛选[J].福建农业科技,2003(3):45-46.
[6] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[7] 布砍南R E,吉本斯N E.伯杰氏细菌鉴定手册(第八版)[M].1984:338-340.
[8] WANG J X, JIANG X L, MOU H J, et al. Anti-oxidation of agar oligosacc harides produced by agarase form a marine bacterium[J]. Journal of Applied Phycology, 2004(16):333-340.
[9] 杜宗军,赵苑,李美菊,等.青岛近海琼胶降解细菌的筛选和多样性分析[J].中国海洋大学学报(自然科学版),2007(2):277-282.
[10] ARAKI T, HAYAKAWA M, LU Z, et al. Purification and characterization of agarases from a marine bacterium,Vibriosp, PO-303[J]. J Mar Biotechnol, 1998,6(4):260-265.
[11] SUGANO Y, TERADA I, ARITA M, et al. Purification and characterization of a new agarase from a marine bacterium,Vibriosp.Strain JT0107[J]. Appl Environ Microbiol, 1993,59(5):1549-1554.
(责任编辑:吴显达)
Screening and identification of agarase-producing microbes in sea shellfish gut
ZHANG Linlin, JIANG Yuji, ZHANG Longtao, ZHENG Baodong, ZHANG Yi, WANG Peisen,LI Qingwang
(College of Food Science, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Abstract:Agarase-producing microbes becomes hotspot for research and development on marine resources as agarase is mainly produced by microbes in sea shellfish gut. Agarose was used as the only carbon source. Forty-four strains of agar-degrading bacteria were initially screened from marine shelfish gut. Then 6 strains, which presented bigger transparent circle around colony by Lugosi iodine liquid staining than the rest, were re-screened. Among them, strain A-001 showed the maximum enzyme activity at 13.01 U·mL(-1) by DNS method. For the colony morphology, the strain A-001 was ivory, gram-negative and short rod. Through the dynamic experiment, the strain A-001 showed motility. Based on physiological and biochemical characteristics and 16SrDNA sequencing results, strain A-001 was identified as Vibrio alginolyticus.
Key words:shellfish; agarase; bacteria; screening; identification
DOI:10.13323/j.cnki.j.fafu(nat.sci.).2016.01.015
中图分类号:Q939.9
文献标识码:A
文章编号:1671-5470(2016)01-0089-05
作者简介:张林林(1987-),女,硕士研究生.研究方向:食品加工与安全.Email:zhanglinlin801@163.com.通讯作者江玉姬(1966-),女,教授,博士生导师.研究方向:食品微生物、食用菌.Email:jyi1209@163.com.
基金项目:海洋经济创新发展区域示范项目(12PYY001SF08).
收稿日期:2015-08-08修回日期:2015-09-21

