结直肠癌组织中EZp蛋白阳性表达及意义
姚坤厚,魏伦收,马万里,胡军红(河南大学淮河医院,河南开封475001)
结直肠癌组织中EZp蛋白阳性表达及意义
姚坤厚,魏伦收,马万里,胡军红(河南大学淮河医院,河南开封475001)
摘要:目的探讨果蝇zeste基因增强子同源物2(EZp)蛋白在结直肠癌发生、发展中的作用。方法选择结直肠癌组织52例份(结直肠癌组)及远癌正常肠组织22例份(正常组),采用免疫组化SP法检测两组EZp蛋白表达,并分析其阳性表达与结直肠癌患者临床病理参数及预后的关系。结果结直肠癌组EZp阳性表达率为69.2%(36/52),正常组为4.5%(1/22),二者比较P<0.05。结直肠癌组EZp阳性表达与患者性别、年龄、肿瘤部位及临床分型无关(P均>0.05),与组织分化程度、Duke分期及肿瘤直径有关(P均<0.05)。EZp阳性者3年无疾病进展生存率为49.8%,EZp阴性者为79.6%,EZp阳性者疾病进展风险显著高于阴性者(HR=2.91,95% CI为1.23~3.66,P<0.05)。结论EZp蛋白阳性表达变化与结直肠癌发生、发展密切相关,可作为判断预后不良的指标。
关键词:结直肠癌;EZp蛋白;免疫组化;临床病理特征;预后
结直肠癌是临床常见的消化系统肿瘤,近年来其发病率呈逐年上升趋势[1]。目前关于结直肠癌发生、发展、侵袭及转移的分子生物学机制尚不十分清楚[2],但普遍认为其恶性生物学行为是涉及多基因、多步骤的调控过程。研究发现,果蝇zeste基因增强子同源物2(EZp)在多种实体肿瘤组织中异常表达,并与肿瘤的恶性生物学行为密切相关[3,4],但其在结直肠癌组织中表达的研究报道较少。2010年4月~2015年8月,我们观察了结直肠癌组织中EZp蛋白阳性表达情况,并分析其阳性表达与患者临床病理参数及预后的关系。现报告如下。
1资料与方法
1.1临床资料选择同期我院收治的结直肠癌患者52例。纳入标准:术后经组织病理学检查确诊为结直肠癌;术前未接受过新辅助化疗;术后随访数据完整;组织标本获取经家属签署知情同意书。排除标准:术后病理诊断不明者;术前接受过放化疗或生物治疗者;合并其他恶性肿瘤者。其中,男28例、女24例,年龄36~75岁(58.6±12.3)岁。结肠癌20例、直肠癌32例,肿瘤直径1.2~10.3 cm;组织分化程度:高、中分化11例,低、未分化41例;Duke分期:A、B期30例,C、D期22例;临床分型:肿块型23例,浸润型20例,溃疡型9例。
1.2EZp蛋白表达检测取52例患者手术切除的癌组织标本(结直肠癌组),取其中22例患者远癌正常肠组织标本(正常组)。采用免疫组化SP法检测两组EZp蛋白表达。结果判定[5]:采用双盲法对染色结果进行判定,在400倍显微镜下每张切片选取5个视野,计数每个视野中的细胞总数及EZp阳性细胞数。EZp阳性染色定位于细胞核,呈棕黄色颗粒状。根据染色强度和染色面积综合计分。染色强度:不着色为0分,轻度着色为1分,中度着色为2分,强着色为3分;染色面积:无着色为0分,<25%为1分,25%~50%为2分,>50%为3分。两积分相加≤2分为EZp阴性表达,>2分为EZp阳性表达。
1.3随访术后定期随访,记录患者疾病进展或死亡事件的发生时间,采用Kaplan-Meier法绘制生存曲线,比较不同EZp表达者3年无疾病进展生存率。
2结果
2.1两组EZp阳性表达比较结直肠癌组EZp阳性表达率为69.2%(36/52),正常组为4.5%(1/22),二者比较P<0.05。
2.2EZp阳性表达与结直肠癌患者临床病理参数的关系EZp阳性表达与结直肠癌患者性别、年龄、肿瘤发生部位及临床分型无关(P均>0.05),而与组织分化程度、Duke分期及肿瘤直径有关(P均<0.05)。见表1。
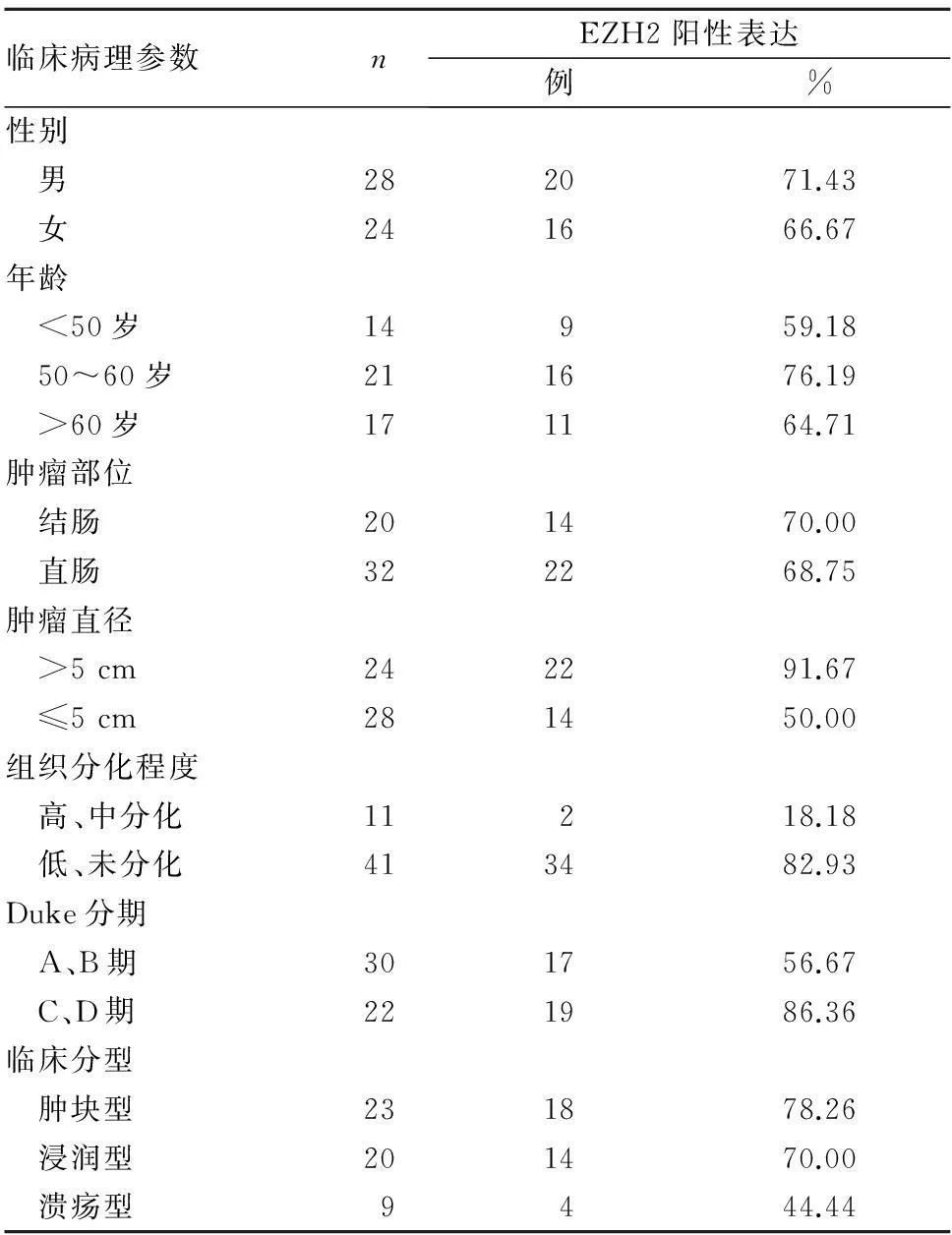
表1 EZp阳性表达与结直肠癌患者临床病理参数的关系
2.3不同EZp表达者预后比较EZp阳性者3年无疾病进展生存率为49.8%,EZp阴性者为79.6%,EZp阳性者随访期间疾病进展风险显著高于阴性者(HR=2.91,95%CI为1.23~3.66,P<0.05)。见图1。
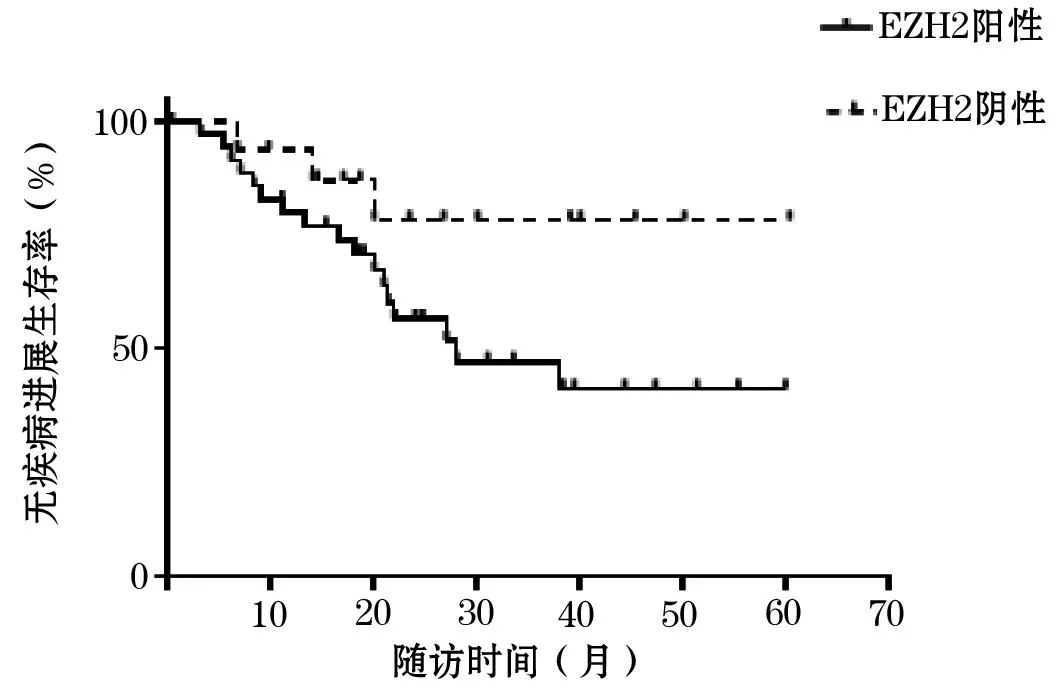
图1 不同EZp表达者预后状况生存曲线
3讨论
EZp是1996年发现的一个新基因,当时命名为ENX-1[6]。EZp在体内外均能与Vav相互作用,是果蝇zeste基因增强子[E(z)]的人类同源物[7,8]。EZp基因定位于人7号染色体3带5区,为多梳蛋白复合体PcG家族的重要成员之一[9]。EZp基因对干细胞表型的维持是必不可少的。既往研究发现,EZp表达产物可促进肿瘤细胞增殖及扩散,在多种恶性肿瘤(如前列腺癌、膀胱癌、乳腺癌等)组织中异常表达[7,10~12]。临床研究还发现,在人类前列腺癌演化过程中,EZp基因表达逐渐升高,并随着其表达水平逐渐升高,多个分化相关基因的表达受到抑制。EZp具有组蛋白甲基转移酶和多种基因的调控作用,参与多个基因的转录抑制[13]。EZp介导的基因沉默依赖HDAC活性,HDAC抑制剂可完全消除EZp的抑制作用。故EZp发挥功能既需要完整的SET结构域,又需要内源性HDAC的活性。提示HDAC抑制剂在EZp高表达的肿瘤中可能有效。但EZp与结肠癌的关系研究较少,其与结肠癌发生、发展、侵袭和转移等生物学行为及患者预后的关系不十分清楚[14]。我们前期研究发现,通过小干扰RNA下调人结肠癌细胞HCT116中EZp基因表达后,细胞凋亡比例增加,细胞增殖能力明显降低[15],表明EZp可能参与人结肠癌细胞增殖与凋亡过程。也有文献报道,EZp为典型的癌基因,在多种恶性肿瘤细胞(如乳腺癌、前列腺癌、肺癌等)高表达[16,17]。本研究结果显示,结直肠癌组EZp阳性表达率显著高于正常组;EZp阳性表达与患者性别、年龄、肿瘤部位及临床分型无关,与组织分化程度、Duke分期及肿瘤直径有关。在组织分化程度较低、Duke分期较高和肿瘤直径较大者EZp阳性表达率较高。说明EZp与结直肠癌的恶性行为有关,EZp阳性表达者恶性生物学行为明显高于阴性表达者。生存分析显示,EZp阳性者3年无疾病进展生存率明显低于EZp阴性者。说明EZp阳性表达与患者预后不良有关。
综上所述,EZp阳性表达变化与结直肠癌的发生、发展密切相关,且与患者预后有关,可作为判断预后不良的指标。
参考文献:
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015,65(1):5-29.
[2] Tejpar S, Shen L, Wang X, et al. Integrating biomarkers in colorectal cancer trials in the West and China[J]. Nat Rev Clin Oncol, 2015,12(9):553-560.
[3] Reijm EA, Timmermans AM, Look MP, et al. High protein expression of EZp is related to unfavorable outcome to tamoxifen in metastatic breast cancer[J]. Ann Oncol, 2014,25(11):2185-2190.
[4] Meng X, Huang Z, Wang R, et al. The prognostic role of EZp expression in rectal cancer patients treated with neoadjuvant chemoradiotherapy[J]. Radiat Oncol, 2014(9):188.
[5] 刘志勇,欧阳忠,邹小明.EZp在大肠癌中的表达及其临床意义[J].赣南医学院学报,2010,30(3):369-371.
[6] Fluge O, Gravdal K, Carlsen E, et al. Expression of EZp and Ki-67 in colorectal cancer and associations with treatment response and prognosis[J]. Br J Cancer, 2009,101(8):1282-1289.
[7] Xu B, Abourbih S, Sircar K, et al. Enhancer of zeste homolog 2 expression is associated with metastasis and adverse clinical outcome in clear cell renal cell carcinoma: a comparative study and review of the literature[J]. Arch Pathol Lab Med, 2013,137(10):1326-1336.
[8] Ciarapica R, Miele L, Giordano A, et al. Enhancer of zeste homolog 2 (EZp) in pediatric soft tissue sarcomas: first implications[J]. BMC Med, 2011(9):63.
[9] Xiao Y. Enhancer of zeste homolog 2: A potential target for tumor therapy[J]. Int J Biochem Cell Biol, 2011,43(4):474-477.
[10] Knudsen ES, Dervishaj O, Kleer CG, et al. EZp and ALDH1 expression in ductal carcinoma in situ: complex association with recurrence and progression to invasive breast cancer[J]. Cell Cycle, 2013,12(13):2042-2050.
[11] Au SL, Wong CC, Lee JM, et al. Enhancer of zeste homolog 2 epigenetically silences multiple tumor suppressor microRNAs to promote liver cancer metastasis[J]. Hepatology, 2012,56(2):622-631.
[12] Xu C, Hao K, Hu H, et al. Expression of the enhancer of zeste homolog 2 in biopsy specimen predicts chemoresistance and survival in advanced non-small cell lung cancer receiving first-line platinum-based chemotherapy[J]. Lung Cancer, 2014,86(2):268-273.
[13] Sasaki M, Nakanuma Y. Cellular senescence in biliary pathology. Special emphasis on expression of a polycomb group protein EZp and a senescent marker p16INK4a in bile ductular tumors and lesions[J]. Histol Histopathol, 2015,30(3):267-275.
[14] Yin Y, Qiu S, Peng Y. Functional roles of enhancer of zeste homolog 2 in gliomas[J]. Gene, 2016,576(1 Pt 2):189-194.
[15] 姚坤厚,魏伦收,马万里,等.shRNA下调EZp基因表达对人结肠癌细胞凋亡、增殖的影响[J].中国临床药理学杂志,2015,31(21):2125-2127.
[16] Kondo Y. Targeting histone methyltransferase EZp as cancer treatment[J]. J Biochem, 2014,156(5):249-257.
[17] McCabe MT, Creasy CL. EZp as a potential target in cancer therapy[J]. Epigenomics, 2014,6(3):341-351.
(收稿日期:2015-12-04)
中图分类号:R735.3
文献标志码:B
文章编号:1002-266X(2016)08-0052-03
doi:10.3969/j.issn.1002-266X.2016.08.020
通信作者:马万里(E-mail: wanlima_g@126.com)
基金项目:河南省科技公关计划项目(14A320064)。

