非小细胞肺癌患者血浆miR-10b、miR-122、miR-16和miR-183水平及其与总生存期的关系
王富民,张寰,曲金力,钱碧云(天津医科大学肿瘤医院,天津00060; 2天津医科大学研究生院;上海交通大学公共卫生学院)
非小细胞肺癌患者血浆miR-10b、miR-122、miR-16和miR-183水平及其与总生存期的关系
王富民1,2,张寰1,曲金力1,钱碧云3(1天津医科大学肿瘤医院,天津300060; 2天津医科大学研究生院;3上海交通大学公共卫生学院)
摘要:目的观察非小细胞肺癌(NSCLC)患者血浆miR-10b、miR-122、miR-16、miR-183水平,并探讨其与患者总生存期(OS)的关系。方法选择NSCLC患者40例,其中术后复发32例、无复发8例。采用实时荧光定量PCR法检测血浆miR-10b、miR-122、miR-16、miR-183。以各miRNA水平均数为界值,将NSCLC患者分为miRNA高水平和低水平,分析不同miRNA水平与患者OS的关系。结果无复发者血浆miR-183水平高于复发者(P<0.05),其余miRNA水平二者比较P均>0.05。miR-183低水平者OS高于高水平者(P<0.05),其余miRNA不同水平者OS比较P均>0.05。Cox比例风险回归模型分析显示,miR-183是NSCLC患者OS的独立影响因素(HR=2.854,95% CI为1.154~7.055,P<0.05)。结论miR-183可能是NSCLC患者OS的独立影响因素,而miR-10b、miR-122和miR-16与患者OS无关。
关键词:非小细胞肺癌;微小核糖核酸;总生存期
微小核糖核酸(miRNA)是一种小的内源性非编码单链小分子RNA。1993年第一个血浆miRNA被发现,目前已发现1 000多种miRNA。国外研究发现,血浆miRNA水平变化可能与肿瘤患者预后有关[1,2]。但目前国内关于血浆miRNA与肿瘤预后关系的报道较少。本研究选择国外研究认为可能与肿瘤预后有关的4种miRNA,即miR-10b、miR-122、miR-16和miR-183,观察其在不同预后非小细胞肺癌(NSCLC)患者血浆中的变化,并分析其与患者总生存期(OS)的关系。
1资料与方法
1.1临床资料选择2007年1月~2010年6月天津市肿瘤医院收治的NSCLC患者40例,均行手术治疗,术后经组织病理学检查明确诊断。其中,男25例、女15例,年龄33~77(57±9)岁;组织类型:腺癌17例,鳞癌11例,其他12例;临床分期:Ⅰ、Ⅱ期22例,Ⅲ、Ⅳ期18例。
1.2血浆miR-10b、miR-122、miR-16、miR-183检测①标本采集及处理:所有研究对象取肘静脉血10 mL,EDTA抗凝,室温静置30 min,4 ℃ 2 000 r/min离心20 min,收集血浆,-80 ℃冰箱冻存。②血浆RNA提取:加入1 mL TRIzol试剂并按试剂盒说明书提取RNA,采用微量紫外分光光度计进行紫外分光,总RNA A260/A280为1.48~1.62视为合格。1%琼脂糖凝胶电泳鉴定RNA完整性,稀释至50 mg/L,-80 ℃保存。③cDNA合成:采用miRNA茎环结构特异性逆转录引物和miRNA逆转录试剂盒说明进行。探针序列(5′→3′):miR-10b:UACCCUGUAGAACCGAAUUUGUG;miR-122:UGGAGUGUGACAAUGGUGUUUG;miR-16: UAGCAGCACGU-AAAUAUUGGCG;miR-183: UAUGGCACUGGUAGA-AUUCACU;cel-miR-39:UCACCGGGUGUAAAUCAG-CUUG。PCR总反应体系为15 μL,反应条件:16 ℃ 30 min、42 ℃ 30 min、85 ℃ 5 min。cDNA样本在-20 ℃保存。④miRNA水平检测:采用Real-time PCR法。PCR反应体系为15 μL,反应条件:95 ℃ 10 min、95 ℃ 15 s、60 ℃ 60 s,共进行50个循环,降温速度1.6 ℃/s。以cel-miR-39作为内参,以2-ΔΔCt计算miRNA相对水平,每样本重复3次,取平均值。
1.3随访患者出院后定期随访,随访截至2012年12月,随访时间3~69个月、中位时间35个月,失访1例。观察复发情况,采用Kaplan-Meier生存分析法计算不同miRNA水平者的OS。
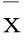
2结果
2.1NSCLC患者血浆miR-10b、miR-122、miR-16、miR-183水平观察40例NSCLC患者血浆miR-10b、miR-122、miR-16、miR-183水平分别为5.30±0.32、5.46±0.46、5.54±0.61、5.34±0.76,以其均数为界值,高于或低于此界值为miRNA高水平或低水平。其中,miR-10b低水平21例、高水平19例,miR-122低水平16例、高水平24例,miR-16低水平17例、高水平23例,miR-183低水平21例、高水平19例。
2.2血浆miR-10b、miR-122、miR-16、miR-183水平与患者OS的关系40例NSCLC患者患者术后复发32例、无复发8例。无复发与复发者血浆miR-10b、miR-122、miR-16、miR-183水平比较见表1。miR-10b低水平及高水平者中位OS分别为53、34个月;miR-122低水平及高水平者中位OS分别为37、34个月;miR-16低水平及高水平者中位OS分别为54、34个月;miR-183低水平及高水平者中位OS分别为54、32个月。miR-183低水平与高水平者OS比较P<0.05;其余miRNA不同表达者OS比较P均>0.05。见插页Ⅰ图3。
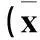
表1 无复发与复发者血浆miR-10b、miR-122、
注:与无复发比较,*P<0.05。
以患者性别(男=0,女=1)、年龄(≤60岁=0,>60岁=1)、病理类型(肺腺癌=0,肺鳞癌=1,其他=2)、临床分期(Ⅰ、Ⅱ期=0,Ⅲ、Ⅳ期=1)、复发(否=0,是=1)、miR-183表达(低水平=0,高水平=1)为自变量,OS为因变量,应用Cox比例风险回归模型分析影响患者OS的因素。结果显示,miR-183是NSCLC患者OS的独立影响因素(HR=2.854,95%CI为1.154~7.055,P<0.05)。
3讨论
NSCLC是临床常见的恶性肿瘤,约占肺癌的80%[3]。目前,临床尚无早期诊断NSCLC的特异标志物,多数患者就诊时已处于中晚期,预后极差。因此,寻找NSCLC早期诊断的特异标志物具有重要意义。
miRNA可与靶基因信使RNA(mRNA)的3′端非翻译区特异结合,抑制或降解mRNA的翻译,进而调控靶基因。miRNAs可在外周血中稳定存在,不易被RNA酶降解。有研究发现,肿瘤患者miRNAs表达差异,并可将特异性miRNAs作为肿瘤的标记物[4~6]。有证据表明,miRNAs的表达有组织特异性,能反映肿瘤的转移、复发等病理生理变化[7]。目前,在NSCLC中研究最多的生物标志物是Let-7a。有研究表明,NSCLC患者血清Let-7a水平显著低于健康人群,其机制是通过抑制细胞周期相关蛋白、癌基因和周期蛋白D2的表达,促进肿瘤发生[8]。Dou等[9]研究发现,NSCLC患者血浆Let-7c、miR-152水平明显下降,并与患者临床病理参数相关,因此认为血浆Let-7c、miR-152水平检测可作为一种无创的快速诊断NSCLC的方法。Li等[10]研究发现,miR-486和miR-150是NSCLC早期诊断的生物标志物。以上研究说明,血浆miRNAs水平变化可能对NSCLC的诊断和治疗具有重要意义。
miR-183的主要功能是参与细胞生长、分化、凋亡等的调控[11]。有研究发现,肿瘤患者血浆miR-183水平并不一致,在结直肠癌、前列腺癌和肝细胞癌等高水平,在卵巢癌、乳腺癌和骨肉瘤等中低水平,但其不同水平均与患者预后有关[12~14]。miR-10b是一种致癌基因,其高水平可促进肿瘤细胞的增殖和侵袭[15],与肿瘤患者预后不佳有关[16]。miR-122是一种肿瘤抑制基因,可抑制肿瘤的转移和上皮-间充质转化[17],其低水平与肿瘤患者预后不佳相关[18]。miR-16位于DLEU2基因的内含子区域,其低水平亦能抑制肿瘤的迁移和侵袭[19],是肺癌患者预后的独立危险因素。本研究发现,无复发者血浆miR-183水平高于复发者,miR-183低水平者OS高于高水平者,提示miR-183是NSCLC患者OS的独立影响因素。因此推测,miR-183是一种致癌基因,其高水平者预后较差。本研究无复发与复发者血浆miR-10b、miR-122和miR-16水平比较差异无统计学意义,且其水平与NSCLC患者OS无关。其原因可能与样本量小有关,也可能与NSCLC不同发展阶段miRNAs功能不完全一致有关。
综上所述,miR-183可能是NSCLC患者OS的独立影响因素,而miR-10b、miR-122和miR-16与患者OS无关。
参考文献:
[1] Shao Y, Geng Y, Gu W, et al. Prognostic significance of microRNA-375 downregulation in solid tumors: a meta-analysis[J]. Dis Markers, 2014,2014:626185.
[2] Tafsiri E, Darbouy M, Shadmehr MB, et al. Expression of miRNAs in non-small-cell lung carcinomas and their association with clinicopathological features[J]. Tumour Biol, 2015,36(3):1603-1612.
[3] Siegel R, Ma J, Zou Z, et al. Cancer statistics[J]. CA Cancer J Clin, 2014,64(1):9-29.
[4] Meng QC, Qiu WW, Wen ZQ, et al. Novel blood-based microRNA biomarkers for diagnosis of pancreatic cancer: a meta-analysis[J]. Tumori, 2015,101(2):199-205.
[5] Welberg L. Neurodegenerative disease: a social role for microRNA[J]. Nat Rev Neurosci, 2015,16(1):2-3.
[6] Sun XY, Lu J, Zhang L, et al. Aberrant microRNA expression in peripheral plasma and mononuclear cells as specific blood-based biomarkers in schizophrenia patients[J]. J Clin Neurosci, 2015,22(3):570-574.
[7] Joerger M, Baty F, Fruh M, et al. Circulating microRNA profiling in patients with advanced non-squamous NSCLC receiving bevacizumab/erlotinib followed by platinum-based chemotherapy at progression (SAKK 19/05)[J]. Lung Cancer, 2014,85(2):306-313.
[8] Jeong HC, Kim EK, Lee TH, et al. Aberrant expression of let-7a miRNA in the blood of non-small cell lung cancer patients[J]. Mol Med Rep, 2011,4(2):383-387.
[9] Dou H, Wang Y, Su G, et al. Decreased plasma let-7c and miR-152 as noninvasive biomarker for non-small-cell lung cancer[J]. Int J Clin Exp Med, 2015,8(6):9291-9298.
[10] Li W, Wang Y, Zhang Q, et al. MicroRNA-486 as a biomarker for early diagnosis and recurrence of non-small cell lung cancer[J]. PLoS One, 2015,10(8):e0134220.
[11] Lodrini M, Oehme I, Schroeder C, et al. MYCN and HDAC2 cooperate to repress miR-183 signaling in neuroblastoma[J]. Nucleic Acids Res, 2013,41(12):6018-6033.
[12] Shi XY, Gu L, Chen J, et al. Downregulation of miR-183 inhibits apoptosis and enhances the invasive potential of endometrial stromal cells in endometriosis[J]. Int J Mol Med, 2014,33(1):59-67.
[13] Xu F, Zhang H, Su Y, et al. Up-regulation of microRNA-183-3p is a potent prognostic marker for lung adenocarcinoma of female non-smokers[J]. Clin Transl Oncol, 2014,16(11):980-985.
[14] Chen L, Li Y, Fu Y, et al. Role of deregulated microRNAs in breast cancer progression using FFPE tissue[J]. PLoS One, 2013,8(1):e54213.
[15] Liu Y, Li M, Zhang G, et al. microRNA-10b overexpression promotes non-small cell lung cancer cell proliferation and invasion[J]. Eur J Med Res, 2013(18):41.
[16] Zhang J, Xu L, Yang Z, et al. microRNA-10b indicates a poor prognosis of non-small cell lung cancer and targets E-cadherin [J]. Clin Transl Oncol, 2015,17(3):209-214.
[17] Qin H, Sha J, Jiang C, et al. miR-122 inhibits metastasis and epithelial-mesenchymal transition of non-small-cell lung cancer cells[J]. Onco Targets Ther, 2015(8):3175-3184.
[18] Zhang H, Su Y, Xu F, et al. Circulating microRNAs in relation to EGFR status and survival of lung adenocarcinoma in female non-smokers[J]. PLoS One, 2013,8(11):81408.
[19] Ke Y, Zhao W, Xiong J, et al. Downregulation of miR-16 promotes growth and motility by targeting HDGF in non-small cell lung cancer cells[J]. FEBS Lett, 2013,587(18):3153-3157.
Plasma levels of miR-10b, miR-122, miR-16 and miR-183 in patients with non-small-cell lung cancer and their relationships with the overall survival
WANGFumin1,ZHANGHuan,QUJinli,QIANBiyun
(1TianjinMedicalUniversityCancerInstituteandHospital,Tianjin300060,China)
Abstract:ObjectiveTo observe the levels of miR-10b, miR-122, miR-16 and miR-183 in patients with non-small-cell lung cancer (NSCLC) and to explore their relationships with the overall survival. MethodsAccording to recurrence, 40 NSCLC patients were divided into two groups: non-recurrence group (n=8) and recurrence group (n=32). The expression levels of 4 miRNAs were detected by real time quantitative PCR. NSCLC patients were divided into the high miRNA expression group and low expression group according to the mean value of miRNAs expression. Kaplan-Meier survival analysis and Cox regression were performed to determine the associations between different levels of miRNAs expression and overall survival (OS). ResultsThe expression of miR-183 was higher in the non-recurrence group as compared with that of the recurrence group (P<0.05). The OS of patients with low miR-183 expression level was higher than that with high miR-183 expression (P<0.05), and there was no significant difference in the OS of patients with different miRNA expression levels (all P>0.05). Cox proportional hazard regression showed that miR-183 was the independent risk factor for the overall survival of NSCLC patients (HR=2.854, 95% CI=1.154-7.055, P<0.05). ConclusionThe plasma level of miR-183 in patients with NSCLC is related to the overall survival, but plasma levels of miR-10b, miR-122 and miR-16 are not associated with the overall survival of patients.
Key words:non-small-cell lung cancer; microRNA; overall survival
(收稿日期:2015-12-03)
中图分类号:R734.2
文献标志码:A
文章编号:1002-266X(2016)08-0017-03
doi:10.3969/j.issn.1002-266X.2016.08.006
通信作者简介:钱碧云(1971-),女,教授,主要研究方向为肿瘤分子与临床流行病学。E-mail: qianbiyun@126.com
作者简介:第一王富民(1988-),男,硕士在读,主要研究方向为肿瘤分子流行病学。E-mail: wangfumin57@163.com
基金项目:国家自然科学基金资助项目(81573231);天津市应用基础与前沿技术研究计划(13JCYBJC23100)。

