非酒精性脂肪肝大鼠肝组织FGF21 mRNA表达与脂质沉积、胰岛素抵抗的关系
申甜,徐碧林,盛霞,高月锦,汪红平,喻明(上海中医药大学附属普陀医院,上海200062)
非酒精性脂肪肝大鼠肝组织FGF21 mRNA表达与脂质沉积、胰岛素抵抗的关系
申甜,徐碧林,盛霞,高月锦,汪红平,喻明(上海中医药大学附属普陀医院,上海200062)
摘要:目的观察非酒精性脂肪肝(NAFLD)大鼠肝组织成纤维细胞生长因子21(FGF21)mRNA表达,并探讨其与脂质沉积、胰岛素抵抗的关系。方法选择SD大鼠40只,随机分为对照组10只、高脂组30只。对照组给予基础饲料喂养,高脂组给予高脂饲料喂养。喂养8周,两组均取10只,评价NAFLD模型建立情况。高脂组剩余大鼠继续高脂饲料喂养,分别于12、24周各取10只,腹主动脉取血,检测血清空腹血糖(FPG)、空腹胰岛素(FINS)、ALT、AST、TC、TG、FGF21、FFA水平,计算胰岛素抵抗指数(HOMA-IR);处死大鼠取肝组织,制备石蜡切片,行HE染色,观察肝细胞形态学变化;制备肝组织匀浆液,检测TG含量;采用RT-PCR法检测肝组织FGF21 mRNA表达。结果喂养8周时,高脂组体质量、肝湿重及血清TG、TC水平均高于对照组(P均<0.05),肝组织呈大泡性脂肪变性并出现炎症细胞浸润及点状坏死,提示NAFLD模型建立成功。高脂组喂养12、24周时,血清FFA水平、肝组织TG含量、HOMA-IR明显高于喂养8周时,且喂养24周时均高于喂养12周时(P均<0.05);而血清FGF21水平、肝组织FGF21 mRNA表达则呈先升高再下降趋势(P均<0.05)。结论NAFLD大鼠肝组织FGF21 mRNA表达、血清FGF21水平与肝组织TG含量有关,在NAFLD早期二者变化一致,胰岛素抵抗可间接抑制其表达。
关键词:非酒精性脂肪性肝病;成纤维细胞生长因子;脂质沉积;胰岛素抵抗;大鼠
非酒精性脂肪肝(NAFLD)与肥胖、高脂血症、2型糖尿病等代谢紊乱密切相关,被认为是胰岛素抵抗(IR)在肝脏的表现,故早期发现NAFLD尤为重要。Li等[1]研究发现,血清成纤维细胞生长因子21(FGF21)水平与脂肪肝指数一样,对NAFLD的早期诊断具有一定特异性。肝内脂质(TG)过度沉积是诱发NAFLD的启动因素,但血清FGF21水平与肝组织TG含量的关系目前尚未完全清楚;肝脏为血清FGF21的主要来源,血清FGF21水平是否与肝组织FGF21 mRNA表达一致鲜见报道。2014年4月~2015年4月,我们探讨了NAFLD大鼠肝组织FGF21 mRNA表达及其与脂质沉积、胰岛素抵抗的关系。现报告如下。
1材料与方法
1.1材料清洁级、雄性SD大鼠40只,体质量(180±10)g,购自河北医科大学动物实验中心,许可证号:SCXK(冀)2008-1-003。所有大鼠分笼喂养,动物房内通风良好,室温18~25 ℃,相对湿度40%~60%,光照时间每天12 h。胰岛素试剂盒,上海博谷生物科技有限公司;FGF21酶联免疫试剂盒,南京建成生物工程研究所;PrimeScriptTMRT和SYBR®Premix Ex TaqTM,日本TaKaRa Bio株式会社。
1.2动物分组及NAFLD模型建立大鼠适应性喂养1周,随机将SD大鼠分为对照组10只和高脂组30只。高脂组参照文献[2]建立营养性NAFLD模型:高脂饲料(基础饲料83%、猪油10%、蔗糖5%、胆固醇1.5%、胆盐0.5%);对照组给予基础饲料(含蛋白质21%、脂肪6%、碳水化合物55%)喂养。喂养8周,对照组及高脂组各取10只,称体质量;腹主动脉取血,分离血清,采用AU2700型全自动生化分析仪检测空腹血糖(FPG)、ALT、AST、TC、TG,ELISA法检测空腹胰岛素(FINS),并计算胰岛素抵抗指数(HOMA-IR)[3]。处死大鼠,取出肝脏,称湿重,计算肝脏指数(肝脏湿重/体质量)。取最大叶肝脏用10%中性甲醛固定,HE染色,参照文献[4,5]观察肝细胞脂肪变性程度。综上评价高脂组NAFLD模型建立情况。高脂组剩余大鼠继续高脂饲料喂养,喂养12、24周时各取10只,进行相关指标检测。
1.3相关指标检测
1.3.1血清FGF21、FFA水平高脂组分别于喂养8、12、24周,腹主动脉取血,分离血清,采用AU2700型全自动生化分析仪检测FPG,ELISA法检测血清FINS、FGF21、FFA,并计算HOMA-IR。
1.3.2肝组织TG含量取血后处死,取适量肝组织,放入玻璃匀浆管中,加入3倍体积甲醇,1 500 r/min匀浆5 min;然后倒入具塞离心管中,加入6倍体积氯仿,漩涡混合器混匀,制备10%组织匀浆。将匀浆分别抽提6、12、24 h,小心抽取下层有机溶剂层10 μL置于1 mL工作液中,37 ℃分别孵育10、15、20 min,6 000 r/min离心10 min。根据TG试剂盒测定肝组织TG含量。
1.3.3肝组织FGF21 mRNA表达采用RT-PCR法。TRIzol法抽提大鼠肝组织总RNA,紫外分光光度计和电泳检测RNA纯度、浓度及完整性,并计算RNA含量。RNA含量(μg/μL)=稀释倍数×OD260值×40/1 000。按Superscript Ⅲ逆转录酶试剂盒说明逆转录得到cDNA。引物设计和合成:FGF21基因序列均从GenBank中获取,引物用Primer5.0软件进行设计。FGF21上游引物:5′-GTGCGAGGCAT-
ACCCCATC-3′,下游引物:5′-CCGTCCTCCCTGATCT-CCA-3′;GAPDH上游引物:5′-CTCATGACCACAGT-CCATGC-3′,下游引物:5′-CACATTGGGGGTAGGAACAC-3′。PCR反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 31 s,45个循环。反应体系20 μL:Premix Ex Taq (2 X)10 μL,PCR Forward Primer (10 μmol/L)0.5 μL,PCR Reverse Primer (10 μmol/L)0.5 μL,cDNA模板2.0 μL,ddH2O 7 μL。反应结束,ABI7300 SDS Software自动分析荧光信号并将其转换为Ct值。Ct值取3个复管的平均值。ΔCt为目的基因Ct值与内参Ct值的差值。以2-ΔΔCt作为肝组织FGF21 mRNA的相对表达量。
2结果
2.1NAFLD模型建立情况喂养8周,高脂组体质量较对照组明显增加(P<0.05);血生化指标(FINS、ALT、AST、TC、TG)及HOMA-IR较对照组明显升高(P均<0.05);大鼠处死后,肝脏湿质量较对照组亦明显增加(P<0.05)。见表1、2。肝组织病理观察:肉眼观察,对照组肝脏形态正常,高脂组肝脏外形稍饱满、圆钝,色红,质地较脆;光镜下观察,对照组肝小叶结构完整,轮廓清晰,肝细胞以中央静脉为中心呈放射状排列,肝小叶中细胞分界清晰,胞核圆,位于细胞中央,胞质丰富,未见肝细胞脂肪变性或坏死及炎性细胞浸润;高脂组肝小叶结构模糊,肝索放射状排列不明显,大部分细胞肿胀,胞核消失或被脂肪空泡。以上结果证实,NAFLD模型建立成功。
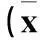
表1 两组体质量、肝脏湿质量及肝脏指数比较±s)
注:与对照组比较,*P<0.05。
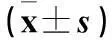
表2 两组血生化指标及HOMA-IR比较
注:与对照组比较,*P<0.05。
2.2高脂组不同喂养时间血清FGF21、FFA水平及肝组织TG含量、肝组织FGF21 mRNA表达、HOMA-IR比较见表3。
3讨论
NAFLD是以肝脏酶学指标升高、脂肪浸润为主要表现的代谢性疾病,而肝内脂质过度沉积与IR密切相关[6~8]。几乎所有NAFLD患者既存在外周IR又存在肝脏IR,肝脏病变程度与IR水平有一定相关性[9,10]。FGF21属于FGF家族成员,人类FGF21基因位于第19号染色体中,由209个氨基酸编码而成。FGF21主要由肝组织、脂肪组织和胰腺分泌,具有内源性调节糖脂代谢及胰岛素分泌作用;FGF21主要表达于肝脏,在骨骼肌、胰腺β细胞和脂肪组织也有少量表达。以往研究发现,NAFLD患者血清FGF21水平明显升高[11~13];Yan等[14]研究证实,血清FGF21水平是反映NAFLD患者肝脏脂肪含量的生物学指标,其水平与肝脏脂肪含量呈正相关。Bobbert等[15]研究认为, FGF21是代谢综合征和2型糖尿病的独立预测因子。上述研究证实,血清FGF21水平在肝脏脂肪含量变化、肝脏脂肪变性及糖代谢异常中扮演重要角色。然而,临床上无法探索不同程度肝脏脂质沉积与血清FGF21水平的关系;同时,肝脏作为血清FGF21水平的主要来源,肝组织mRNA变化是否与血清FGF21水平一致,相关报道较少。本研究采用连续单纯性高脂喂养建立营养性NAFLD模型,于喂养8周观察高脂组体质量、肝脏湿质量增加,血清FFA、FPG、FINS水平和HOMA-IR明显升高,均高于对照组;肝组织病理表现为大部分细胞肿胀,胞核消失,伴ALT增高,出现内脏型肥胖和IR,提示大鼠NAFLD模型建立成功。喂养12~24周,高脂组肝组织TG含量增加,血清FFA水平迅速升高,IR程度逐渐加重。
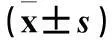
表3 高脂组不同喂养时间血清FGF21、FFA水平及肝组织TG含量、FGF21 mRNA表达、HOMA-IR比较
注:与喂养8周比较,#P<0.05;与喂养12周比较,△P<0.05。
早期代偿性高胰岛素血症可使肝脏增多的FFA大量转变为TG,进一步发展时,由于肝细胞损伤和载脂蛋白B合成相对减少,大量TG无法从肝脏内运出,而在肝细胞内大量沉积,导致肝细胞脂肪变性。本研究结果显示,高脂组喂养8~24周,肝组织TG含量增加且出现IR,血清FGF21水平及肝组织FGF21 mRNA表达量相应升高,二者变化呈一致性,而FPG无明显升高;喂养12~24周,IR虽逐渐加重,但血清FGF21水平、肝组织FGF21 mRNA表达却相应下降。其水平下降的原因可能是机体在病理条件下为提高FFA的氧化和葡萄糖利用,抵消其在组织内糖脂毒性的一种表现,但需要进一步研究证实。鉴于NAFLD演变至非酒精性脂肪性肝炎过程中肝组织FGF21 mRNA异常表达及血清FGF21水平与肝组织TG含量及IR之间的特殊关系,推测早期血清FGF21水平变化为保护性,而后期受外周IR的相对抑制,今后需进一步研究加以证实。本研究还发现,血清FGF21水平与肝组织FGF21 mRNA变化呈一致性,且脂肪肝早期FGF21 mRNA与肝脏TG含量呈正相关,故认为血清FGF21水平可作为NAFLD早期诊断的血清标记物。
有学者发现,FGF21为一种防御糖脂代谢紊乱的保护因子[16~18],对糖尿病及肥胖有潜在治疗作用。但在某些病理条件下,血清FGF21水平升高的原因及机制,可用FGF21抵抗的概念来解释,即类似于高瘦素血症和高胰岛素血症,但仍需进一步研究。
参考文献:
[1] Li H, Dong K, Fang Q, et al. High serum level of fibroblast growth factor 21 is an independent predictor of non-alcoholic fatty liver disease: A 3-year prospective study in China[J]. J Hepatol, 2013,58(3):557-563.
[2] 徐芳,刘颖,王斌胜,等.调脂合剂对大鼠高脂血症性脂肪肝的保护作用[J].中国实验方剂学杂志,2012,18(10):267-270.
[3] Bonora E, Targher G, Alberiche M, et al. Homeostasis model assessment closely mirrors the glucose clamp technique in the assessment of insulin sensitivity: studies in subjects with various degrees of glucose tolerance and insulin sensitivity[J]. Diabetes Care, 2000,23(1):57-63.
[4] Dixon JB, Bhathal PS, Hughes NR, et al. Nonalcoholic fatty liver disease: Improvement in liver histological analysis with weight lose[J]. Hepatology, 2004,39(6):1647-1654.
[5] 中华医学会传染病与寄生虫病学分会,中华医学会肝病学分会.病毒性肝炎防治方案[J].中华内科杂志,2001,40(1):62-68.
[6] Park SH, Kim BI, Yun JW, et al. Insulin resistance and C-reactive protein as independent risk factors for non-alcoholic fatty liver disease in non-obese Asian men[J]. J Gastroenterol Hepatol, 2004,19(6):694-698.
[7] Sakurai M, Takamura T, Ota T, et al. Livers teatosis, but not fibrosis, is associated with insulin resistance in nonalcoholic fatty liver disease[J]. J Gastroenterol, 2007,42(4):312-317.
[8] Chalasani N, Deeg MA, Persohn S, et al. Metabolic and anthropometric evaluation of insulin resistance in nondiabetic patients with nonalcoholic steatohepatitis[J]. Am J Gastroenterol, 2003,98(8):1849-1955.
[9] Bugianesi E, Gastaldelli A, Vanni E, et al. Insulin resistance in non-diabetic patients with non-aleoholle fatty liver disease: sites and mechanisms[J]. Diabetologia, 2005,48(48):634-642.
[10] Pagano G, Pacini G, Musso G, et al. Nonalcoholic steatohepatitis, insulin resistance, and metabolic syndrome: futher evidence for an efidogic association[J]. Hepatology, 2002,35(2):367-372.
[11] Li H, Fang Q, Gao F, et al. Fibroblast growth factor 21 levels are increased in nonalcoholic fatty liver disease patients and are correlated with hepatic triglyceride[J]. J Hepatol, 2010,53(5):934-940.
[12] Dushay J, Chui PC, Gopalakrishnan GS, et al. Increased fibroblast growth factor 21 in obesity and nonalcoholic fatty liver disease[J]. Gastroenterology, 2010,139(2):456-463.
[13] Yilmaz Y, Eren F, Yonal O, et al. Increased serum FGF21 levels in patients with nonalcoholic fatty liver disease[J]. Eur J Clin Invest, 2010,40(10):887-892.
[14] Yan H, Xia M, Chang X, et al. Circulating fibroblast growth factor 21 levels are closely associated with hepatic fat content: a cross-sectional study[J]. PLoS One, 2011,6(9):e24895.
[15] Bobbert T, Schwarz F, Fischer-Rosinsky A, et al. Fibroblast growth factor 21 predicts the metabolic syndrome and diabetes type 2 mellitus in Caucasians[J]. Diabetes Care, 2013,36(1):145-149.
[16] Kharitonenkov A, Shiyanova TL, Koester A, et al. FGF-21 as a novel metabolic regulator[J]. J Clin Invest, 2005,115(6):1627-1635.
[17] Kharitonenkov A, Wroblewski VJ, Koester A, et al. The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J]. Endocrinology, 2007,148(2):774-781.
[18] Xu J, Lloyd DJ, Hale C, et al. Fibroblast growth factor 21 reverses hepatic steatosis, increases energy expenditure, and improves insulin sensitivity in diet-induced obese mice[J]. Diabetes, 2009,58(1):250-259.
Correlations of FGF21 mRNA expression with fat deposition and insulin resistance in rat liver with NAFLD
SHENTian,XUBilin,SHENGXia,GAOYuejin,WANGHongping,YUMing
(ShanghaiPutuoDistrictCentralHospital,Shanghai200062,China)
Abstract:ObjectiveTo observe the fibroblast growth factor 21 (FGF21) mRNA expression level in rat liver with non-alcoholic fatty liver disease (NAFLD) and to investigate its relationship with fat deposition and insulin resistance. MethodsForty SD male rats were randomly divided into the control group (n=10, NC group) fed with basic food and high-fat group (n=30, HF group) fed with high-fat diet. After 8-week feeding, 10 rats were selected to observe whether the NAFLD models were built successfully in the HF group. After that the rest of rats in the HF group were fed with high-fat diet, and at week 12, 10 rats were selected and at week 24, the other 10 were selected. The fasting blood-glucose (FPG), fasting insulin (FINS), alanine transamianse (ALT), aspartate transamianse (AST), total cholesterol (TC), triglyceride (TG), serum FGF21, serum FFA, and homeostasis model assessment of insulin resistance (HOMA-IR) were calculated. The pathological change of liver was observed by HE staining; liver triglyceride (TG) content was tested and the expression of FGF21 mRNA in liver was detected by RT-PCR. ResultsAt the 8 th week, the body mass, liver-wet weight, serum TG and TC of the HF group were higher than those of the NC group (all P<0.05), liver tissues of the HF group changed to bullous steatosis and had inflammatory cell infiltration and spotty necrosis, so that NAFLD model was built successfully. In the end of 12 and 24th weeks, the serum FFA, TG content and HOMA-IR were significantly higher than those of the 8th week, and the 24th week was also higher than the 12th week (all P<0.05). During the week 8-12, the serum FGF21 and expression of FGF21 mRNA in liver of the HF group increased first and then decreased (all P<0.05). ConclusionThe expression of FGF21 mRNA in liver and serum FGF21 of NAFLD rats were related with the liver TG content. Besides, both of them have the same change in the early stage of NAFLD, and insulin resistance may inhibit the expression of FGF21mRNA indirectly.
Key words:non-alcoholic fatty liver disease; fibroblast growth factors; lipidoses; insulin resistance; rat
(收稿日期:2015-06-30)
中图分类号:R575.5
文献标志码:A
文章编号:1002-266X(2016)08-0010-04
doi:10.3969/j.issn.1002-266X.2016.08.004
通信作者简介:喻明(1956-),男,主任医师,主要研究方向为糖尿病的诊断及治疗。E-mail: mgyu403@aliyun.com
作者简介:第一申甜(1980-),女,主治医师,主要研究方向为肥胖及胰岛素抵抗。E-mail: shentian2017@163.com
基金项目:上海市卫生局青年科研项目(2013Y079);上海市中医药大学后备业务专家培养计划。

