M3受体在低氧引起H9c2细胞损伤中的作用及其机制※
司立宁,甘桂芬,赵延礼,严海萍,党国全,于冬悦,王 嵘*
(1.青海大学附属医院,西宁 810001;2.青海大学医学院基础医学研究中心,西宁 810001;3.中国药科大学,南京 211198)
M3受体在低氧引起H9c2细胞损伤中的作用及其机制※
司立宁1,甘桂芬1,赵延礼2,严海萍1,党国全2,于冬悦3,王 嵘2*
(1.青海大学附属医院,西宁 810001;2.青海大学医学院基础医学研究中心,西宁 810001;3.中国药科大学,南京 211198)
目的 探讨M3受体激动对低氧诱导H9c2细胞损伤的作用及机制。方法 采用三气培养建立H9c2细胞低氧损伤模型。实验组分为对照组(A)、低氧组(B)、CCh+低氧组(C)、4DAMP+CCh+低氧组(D)。采用CCK-8法测定细胞存活率,通过流式细胞术检测H9c2细胞凋亡情况;Western blot法检测凋亡蛋白Caspase-3、抗凋亡蛋白Bcl-2及HIF-1α和HO-1的表达。结果 M3受体激动剂CCh(10mmol/L)可减少低氧诱导的心肌细胞损伤,并可增加心肌Bcl-2、HIF-1α、HO-1的表达,减少Caspase-3表达。但预先应用4DAMP(10nmol/L)阻断M3受体可逆转胆碱作用。结论 激动M3受体对低氧诱导H9c2细胞的损伤有保护作用,其机制可能与HIF-1α、HO-1的表达增加有关。
M3受体 细胞损伤 低氧 低氧诱导因子-1 血红素加氧酶-1
研究表明,M3受体激动剂胆碱通过激动心肌细胞M3受体产生负性肌力和负性频率的作用[1]。然而,激动M3受体对低氧诱导心肌细胞损伤的影响尚不清楚。本实验通过低氧诱导H9c2细胞损伤,研究激动M3受体对低氧引起心肌细胞损伤的作用及其机制。
1 材料与方法
1.1 主要试剂和仪器选择
H9c2细胞株(中国科学院上海细胞库);卡巴胆碱、4DAMP(Sigma公司),胎牛血清、DMEM高糖培养基(Hyclone公司);CCK-8(cellcounting kit-8)、AnnexinV-PI染色试剂盒(南京建成生物工程公司);HIF-1α、Bcl-2、Caspase-3、HO-1、GAPDH抗体(Santa Cruz公司) ;CO2恒温培养箱(Thermo Electron公司);YCP-50S三气培养箱(长沙华曦电子科技有限公司)。
1.2 细胞培养与实验分组
细胞培养:将H9c2细胞按(1~3)×105个/mL等量接种于35 mm培养皿中,于含10%胎牛血清的DMEM高糖培养基中置于细胞培养箱(5%CO2、饱和湿度、37℃)无菌培养,待细胞密度达70%~80%之间时进行实验。实验前采用无血清DMEM高糖培养基过夜培养12 h。
实验分组:正常对照组(A,常氧正常培养);低氧组(B,细胞培养于37℃,5%CO2的三气培养箱中,通入纯度为99.9%的N2平衡培养箱中的O2,排气口检测O2浓度≤1%,培养24h);CCh+低氧组[C,培养条件同B组,培养时加入CCh(10mmol/L)];4DAMP+CCh+低氧组[D,该组细胞在按照C组培养前2 h加入4DAMP(10nmol/L)]。
1.3 细胞损伤的测定
按照CCK-8法细胞活性检测试剂盒的操作步骤,对各组细胞活性进行测定,每组实验重复6次。
1.4 细胞凋亡检测
将各组细胞用PBS液洗涤2次,用适量1×Binding缓冲液重悬,使细胞浓度达到1×106个/mL。然后取100 μL重悬液,加入5 μL FITC Annexin V和5 μL碘化丙啶(PI),室温避光15 min。最后加入400 μL Binding缓冲液,利用流式细胞仪进行检测。
1.5 蛋白表达检测
收集细胞并用PBS液洗涤3次,加入适量裂解液在冰浴中裂解细胞,收集蛋白做考马斯亮蓝法蛋白定量,行十二烷基磺酸钠/聚丙烯酰胺凝胶电泳,电转移至PVDF膜,用5%脱脂牛奶封闭后加入第1抗体孵育(4℃)过夜,用PBST缓冲液洗涤3次,10 min/次,加入第2抗体于室温孵育2 h,再用PBST缓冲液洗涤3次,10 min/次,加入发光试剂ECL显色曝光,采用Image-Pro图像分析软件进行灰度分析,GAPDH作为内参。
1.6 统计学处理
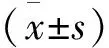
2 结果
2.1 M3受体对低氧H9c2细胞活力的影响(表1)


Table 1 Survival of mediated myocyte in each group
*:与A组比较,P<0.01;#:与B组比较,P<0.01;▲:与C组比较,P<0.01.
表1显示,与A组相比,B组细胞进行24 h低氧培养后细胞活力明显降低(P<0.01);C组细胞低氧处理时给予M3受体激动剂CCh后,细胞活力较B组显著升高(P<0.01)。但是,D组细胞在给予低氧和M3受体激动剂处理前2 h先给予4DAMP,明显逆转了CCh保护低氧导致细胞活力下降的现象。
2.2 M3受体对低氧H9c2细胞凋亡的影响(图1,表2)

图1 各组细胞流式细胞术结果图
Figure 1 Flow cytometry in each group

图2 Westernblot法检测各组细胞Caspase-3和Bcl-2蛋白结果图


Table 2 2Apoptosis of Mediated myocyte in each group
*:与A组比较,P<0.01;#:与B组比较,P<0.01;▲:与C 组比较,P<0.05.
图1、表2显示,与A组相比,B组细胞低氧培养24 h后细胞凋亡数明显增加(P<0.01);与B组相比,给予M3受体激动剂CCh后明显减少了低氧导致的细胞凋亡数(P<0.01);利用4DAMP预先阻断M3受体后可逆转CCh的抗凋亡作用。
2.3 M3受体对低氧H9c2细胞Bcl-2和Caspase-3蛋白表达的影响(图2,表3)


Table 3 The expression of Caspase-3 and Bcl-2 in each group
*:与A组比较,P<0.01;#:与B组比较,P<0.01;▲:与C组比较,P<0.01.
图2、表3显示,与A组相比,B组低氧培养的细胞内Bcl-2蛋白的表达降低(P<0.01)、Caspase-3蛋白的表达升高(P<0.01);与B组相比,C组结果显示CCh可增加Bcl-2蛋白的表达(P<0.01)、降低Caspase-3蛋白的表达(P<0.01);给予M3受体阻断剂4DAMP后明显逆转C组现象。
2.4 M3受体对低氧H9c2细胞HIF-1α和HO-1蛋白表达的影响(图3,表4)

图3 Westernblot法检测各组细胞HIF-1α和HO-1蛋白结果图
Figure 3 The expression of HIF-1αand HO-1 byWesternblot in each group


Table 4 The expression of HIF-1αand HO-1 in each group
*:与A组比较,P<0.01;#:与B组比较,P<0.01;▲:与C组比较,P<0.01.
图3、表4显示,与A组相比,B组细胞低氧培养24 h后细胞内HIF-1α、HO-1蛋白的含量明显增加(P<0.01);与B组相比,激活M3受体可显著增加低氧条件下心肌细胞内HIF-1α、HO-1蛋白的表达(P<0.01);而预先阻断M3受体可明显降低由CCh引起的HIF-1α、HO-1蛋白表达的增加(P<0.01)。
3 讨论
本研究结果表明,给予胆碱可保护低氧引起的心肌细胞损伤,并诱导HIF-1α、HO-1表达增加,预先给予4DAMP可逆转胆碱的保护作用,提示胆碱是通过激动心肌M3受体发挥心肌保护作用,其机制可能与诱导HIF-1α、HO-1表达增加有关。
以往研究认为,心肌细胞中只有M2受体。但近年研究发现,心肌细胞中也存在M3受体等其他类型,并且M3受体在很多心脏疾病中发挥重要的作用[2]。Liu课题组研究发现,心肌过表达M3受体可通过抑制MAPK通路明显减弱血管紧张素II诱导的心肌肥厚[3]。另有研究发现,激动心肌M3受体可抑制H2O2诱导的心肌细胞凋亡[4]。张伟志课题组研究发现,在H9c2细胞中,氨甲酰胆碱通过M3受体调控MEK1/2-ERK1/2信号通路促进细胞的生存[5]。本研究利用M3受体激动剂CCh和抑制剂4DAMP发现,心肌M3受体在低氧引起的心肌细胞损伤中发挥保护作用。
慢性低氧会引起心肌组织结构的异常,如心肌细胞肥大、凋亡和间质纤维化等[6,7]。研究认为,低氧能够通过调节生长因子、应激蛋白和酶等基因的表达调控心肌细胞的生长和分化[8,9]。本研究发现,给予低氧处理H9c2细胞24 h后,心肌细胞增殖能力明显降低,心肌细胞凋亡明显增加,促凋亡蛋白Caspase-3表达增加,抑制凋亡蛋白Bcl-2表达减少。但是,低氧时给予CCh处理可明显增加心肌细胞的增殖和减少心肌细胞的凋亡,并且促凋亡蛋白Caspase-3表达减少,抑制凋亡蛋白Bcl-2表达增加。进一步发现,该现象可在预先给予4DAMP后明显逆转。该结果提示低氧对心肌细胞的生长有抑制作用,激动心肌M3受体可抑制低氧诱导的心肌细胞活力降低和凋亡增加。
研究证实,低氧可诱导心肌、肝脏、肾脏、骨骼肌等组织中HIF-1α和HO-1表达增加,并发挥重要的保护作用[10,11]。Hui课题组研究发现,激动心肌M3受体可通过HIF-1α/HO-1/VEGF通路抑制依托泊苷诱导的心肌细胞凋亡[12]。本研究同样发现,低氧培养H9c2细胞24 h可明显诱导HIF-1α、HO-1表达增加;低氧条件下激动心肌M3受体可明显诱导HIF-1α、HO-1表达增加,预先给予4DAMP后可阻断胆碱的作用,提示激动心肌M3受体可保护低氧诱导的心肌细胞损伤的作用可能是通过诱导HIF-1α、HO-1表达增加实现的。
激动心肌M3受体可能是通过诱导HIF-1α、HO-1的表达增加抑制低氧引起的心肌细胞损伤。本研究为低氧条件下心肌M3受体与HIF-1α/HO-1之间的关系提供了新的证据。
[1]LiuY,Wang Y,Ma ML,et al.Cardiac-Hemodynamic effect of M3receptor agonist on rat and rabbit hearts[J].Acta Pharm Sin,2001,36(2):84-87.
[2]Wang S,Han HM,Jiang YN,et al.Activation of cardiac M3muscarinic acetylcholine receptors has cardioprotective effects against ischaemia-induced arrhythmias[J].Clin Exp Pharmacol Physiol,2012,39(4):343-9.
[3]Liu Y,Wang S,Wang C,et al.Upregulation of M3muscarinic receptor inhibits cardiac hypertrophy induced by angiotensin II[J].J Transl Med,2013,11:209.
[4]Liu Y,Sun HL,Wu H,et al.Protective effect of M3receptor on H2O2-induced apoptosis of rat myocardial cells in vitro[J].Yao Xue Xue Bao,2004,39(11):887-91.
[5]张伟志,黄灿,杨一峰.M3受体通过激活MEK1/2-ERK1/2信号通路促进H9c2心肌细胞生存[J].中南药学,2011,9(3):161-5.
[6]Li JW,He SY,Feng ZZ,et al.MicroRNA-146b inhibition augments hypoxia-induced cardiomyocyte apoptosis[J].Mol Med Rep,2015,12(5):6903-10.
[7]Duan L,Lei H,Zhang Y,et al.Calcitonin Gene-Related Peptide Improves Hypoxia-Induced Inflammation and Apoptosis via Nitric Oxide in H9c2 Cardiomyoblast Cells[J].Cardiology,2016,133(1):44-53.
[8]Chen WK,Kuo WW,Hsieh DJ,et al.CREB Negatively Regulates IGF2R Gene Expression and Downstream Pathways to Inhibit Hypoxia-Induced H9c2 Cardiomyoblast Cell Death[J].Int J Mol Sci,2015,16(11):27921-30.
[9]Zhao C,Liu J,Zhang M,et al.Semaphorin 3A deficiency improves hypoxia-induced myocardial injury via resisting inflammation and cardiomyocytes apoptosis[J].Cell Mol Biol(Noisy-le-grand),2016,62(2):8-14.
[10]Tekin D,Dursun AD,Xi L.Hypoxia inducible factor 1(HIF-1)and cardioprotection[J].Acta Pharmacol Sin,2010,31(9):1085-94.
[11]Dawn B,Bolli R.HO-1 induction by HIF-1:a new mechanism for delayed cardioprotection[J].Am J Physiol Heart Circ Physiol,2005,289(2):522-4.
[12]Hui Y,Zhao Y,Ma N,et al.M3-mAChR stimulation exerts anti-apoptotic effect via activating the HIF-1α/HO-1/VEGF signaling pathway in H9c2 rat ventricular cells[J].J Cardiovasc Pharmacol,2012,60(5):474-82.
Protective effect of M3receptor on hypoxia damage of H9c2 cell※
Si lining1,Gan Guifen1,Zhao Yanli2,Yan Haiping1,Dang Guoquan2,Yu Dongyue3,Wang Rong2
(1.Qinghai University Affiliated Hospital,Xining 810000;2.Basic Science Research Center of Qinghai University Medical College,Xining810000;3.China Pharmaceutical University,Nanjing 211198)
Objective To observe the effect of activation of M3receptor on hypoxia damage in cultured H9c2 cell and to investigate its possible mechanisms.Methods A model of Hypoxia damage was performed as cells cultured in a tri-gas incubator.Cells were divided into four groups,including control(A),hypoxia(B),CCh+hypoxia(C)and 4DAMP+ CCh+hypoxia(D).The viability of cells was determined by CCK-8 assay.Western blot was used to determine Caspase-3,Bcl-2,HIF-1α and HO-1 levels.Results Hypoxia mediated myocyte damage was attenuated by M3receptor agonist choline(10mmol/L).Pretreatment of cardiac myocytes with choline also increased Bcl-2,HIF-1α and HO-1,decreased Caspase-3 expression in hypoxia stimulated H9c2 cell.However,blockade of M3receptor by 4DAMP(10nmol/L)completely inhibited the effects of choline on hypoxia stimulated H9c2 cell.Conclusions Activation of M3receptor showed protective effect on hypoxia induced damage in cultured H9c2 cell and this effect might be related tomodulating the expression of some genes including HIF-1α and HO-1.
M3receptor Cell damage Hypoxia HIF-1α HO-1
※:国家自然科学基金项目(81060162);国家自然科学基金项目(81460284);青海省自然科学基金青年项目(2014-ZJ-944Q);青海省自然科学基金项目(2015-ZJ-744) 司立宁(1980~),女,汉族,主治医师.* :通讯作者,qhwr2007@163.com
R331.3
A
10.13452/j.cnki.jqmc.2016.02.004
2015-11-09

