青海地区幽门螺杆菌感染、p53基因Arg72Pro单核苷酸多态性与胃癌易感性#
马晓玲,王学红,马臻奇,杨生森,韩庆华,王 芳,李源华
(1.青海大学医学院; 2.青海大学附属医院)
青海地区幽门螺杆菌感染、p53基因Arg72Pro单核苷酸多态性与胃癌易感性#
马晓玲1,王学红2##,马臻奇2,杨生森2,韩庆华2,王 芳2,李源华2
(1.青海大学医学院; 2.青海大学附属医院)
目的 检测青海地区幽门螺杆菌在胃癌患者中的感染情况,并探讨青海地区Hp感染及p53Arg72Pro基因多态性与胃癌的关系。方法 用14C尿素呼气试验或快速尿素酶试验检测研究对象的Hp感染情况;采用TaqMan探针和实时定量PCR技术检测青海地区健康人群和胃癌患者p53Arg72Pro的基因多态性。并行相关分析。结果 Hp感染率在对照组和胃癌组分别为42.2%,63.1%,Hp感染率在两组间具有显著差异(P<0.05 )。p53Arg72Pro有Arg/Arg、Arg/Pro、Pro/Pro 3种基因型,其频率在胃癌患者中分别为11.3 %、58.9 %、29.8%;在健康人群中分别为16.4%、49.2%、34.3%。与Arg/Arg基因型相比,Pro/Pro基因型携带者在胃癌组和对照组间差异有统计学意义(OR 值为1.256,95%CI:1.057~2.845)。等位基因Arg和等位基因Pro在胃癌组中的频率分别为35.1%、64.9%,在对照组中分别为41.0%、59.0%,两组间有差异(P<0.05 );携带等位基因Pro患胃癌的风险为对照组的1.286倍。按Hp是否感染对p53Arg72Pro等位基因频率在胃癌组和对照组中进行分析,结果是三种基因型在胃癌组和对照组间的分布无差异。并将Pro/Pro与Arg/Arg、Arg/Arg与Pro/Pro+ Pro/Arg做比较,分析其与胃癌发病的相关风险发现亦无相关性。结论 青海地区幽门螺杆菌感染率在胃癌患者中偏高;青海地区Hp感染及p53Arg72Pro基因多态性与胃癌的发生不存在关联。青海地区P53Arg72Pro位点基因多态性与胃癌发病的风险相关,若同时携带Pro等位基因,胃癌发生风险明显增加。
青海地区 幽门螺杆菌 p53Arg72Pro 单核苷酸 基因多态性 胃癌
2014年全球癌症报告显示,我国胃癌发病率与死亡率均居世界首位,全球接近50%的新发胃癌病例来自中国[1],而青海又为中国的高发区。幽门螺杆菌(Helicobacter pylori,Hp)被认为是胃癌发生的独立危险因素。然而,在Hp感染人群中仅有少数个体发展为胃癌,说明胃癌发生是一个多基因、多步骤的进行性癌变过程,其中癌基因的活化和抑癌基因的失活显得举足轻重。研究表明p53在已发现抑癌基因中与人类肿瘤相关性最高[2],是重要的细胞周期调节、凋亡基因。在绝大多数肿瘤细胞中均可发现P53蛋白的积聚现象,并与P53基因突变或缺失有关。在国外不同种族和人群中对P53 基因多态性(P53Arg72 Pro)与多种肿瘤易感性的研究均有大量报道,但结果不一。本研究旨在探讨青海地区Hp感染、P53Arg72 Pro多态性与胃癌易感性的关系。
1 材料与方法
1.1 研究对象
2012年4月至2015年11月在青海大学附属医院胃镜和组织活检病理诊断为胃癌的309例患者为研究组,其中男214 例,女 95例,平均年龄(53.27±8.95)岁;同时期在同医院体检排除肿瘤和消化系统疾病的健康体检人群329例为对照组,其中男210例,女119例,平均年龄(52.14±8.05)岁。研究对象为两周内未用过H2RA和PPI,1月内未用过抗生素、铋剂和有抗菌作用的中药,无活动性消化道出血者。两组性别、年龄无差异,P>0.05。
1.2 实验方法
1.2.1 Hp感染检测
14C尿素呼气实验:嘱患者在安静状态下空腹口服14C尿素胶囊15~20 min后,向集气卡中吹气3~5 min,当集气卡上橘红色标识变为黄色时将集气卡置于14C分析仪(深圳海得威公司)检测,结果≥100 dpm视为Hp阳性,结果<100 dpm为阴性。
快速尿素酶试验:取胃窦小弯黏膜组织1块,用快速尿素酶诊断试剂(广州贝思奇诊断试剂有限公司)在3~5 min内观察颜色变化,红色或紫红色视为阳性,颜色不变为阴性。
结果判定:参照2012年中华医学会消化病分会制订的《第四次全国幽门螺杆菌感染处理共识报告》中的诊断标准,14C尿素呼气实验或快速尿素酶试验任何一项呈阳性即视为Hp感染。
1.2.2 血液标本采集
用真空采集管抽取胃癌组、对照组个体空腹静脉血5 mL,EDTA抗凝,转移2 mL至EP管,置于-80 ℃冰箱保存待检。
1.2.3 外周血基因组DNA的提取
使用血液基因组DNA快速抽提试剂盒(SK8224)抽提外周血白细胞DNA,严格按照说明书操作,试剂盒购自Sangon Biotech Shanghai Co.,Ltd(上海生工生物工程有限公司,简称上海生工)。将提取的基因组DNA调整浓度后置于-20 ℃冰箱保存,用于PCR扩增模板。
1.2.4 P53基因Arg72Pro单核苷酸多态性检测
采用TaqMan探针和实时定量PCR技术检测研究对象P53Arg72Pro的基因多态性。探针及其引物由上海生工合成。
(7)公众满意程度。在农业绿色发展过程中,本文使用农村居民家庭人均可支配收入(千元)来表示公众满意程度,用x7来表示。从经济理论和实际情况可以发现,农业生产方式、农业生产技术、农业自然资源利用效率等都与农村收入有着极大的关系,当农村收入较高时,居民的消费水平提高,消费观念有所变动,对产品从之前追求高产量转向追求高品质,有利于促进绿色农产品的生产,推动农业的绿色发展。绿色农产品又是目前市场上所需要的,这反过来又会提高农村收入水平,形成一个良性循环,提高了公众满意度。
Primer引物序列:
正向引物5′-CCCAAGCAATGGATGATTTGA-3′;
反向引物5′-GGGCCGCC-GGTGTAG-3′。
特异性TaqMan探针序列:
FAM-CTCCCCGCGTGGCCCC-TAMRA;
TEX-CTCCCCCCGTGGCCCCT-TAMRA。
1.3 统计学方法
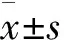
2 结果
2.1 研究对象Hp感染情况(表1)
胃癌组研究对象309例,其中Hp阳性数195例,Hp阳性率63.1%;对照组Hp阳性数139例,Hp阳性率42.2%。胃癌组与对照组间有统计学差异(χ2=27.79,P=0.001)。
表1 不同组别研究对象Hp感染情况(%)

Table 1 Situation of Hp infection in different groups(%)
2.2 研究对象p53Arg72Pro基因型和基因频率分布情况(表2)
P53Arg72Pro多态性位点有Arg/Arg、Arg/Pro和Pro/Pro 3种基因型。经检验基因型分布符合Hardy-Weinberg平衡规律(P>0.05)。Arg/Arg、Arg/Pro和Pro/Pro其频率在胃癌组中分别为11.3%,58.9%和29.8%,在对照组中分别为16.4%,49.2%和34.3%。经χ2检验胃癌组与对照组间有统计学差异(P<0.05)。与P53基因Arg/Arg纯合子基因型相比,携带Pro/Pro纯合子基因型的个体在胃癌组显著增高,OR值为1.256,(95%CI:1.057~2.845)。将Arg+Pro基因合并后在对照组与胃癌组间比较未见统计学差异(χ2=3.434,P=0.064)。携带Pro等位基因的个体在胃癌组是健康对照组的1.286倍(OR=1.286,95%CI:1.025~1.613)。
表2 P53Arg72Pro基因型和基因频率在两组中的分布(n,%)
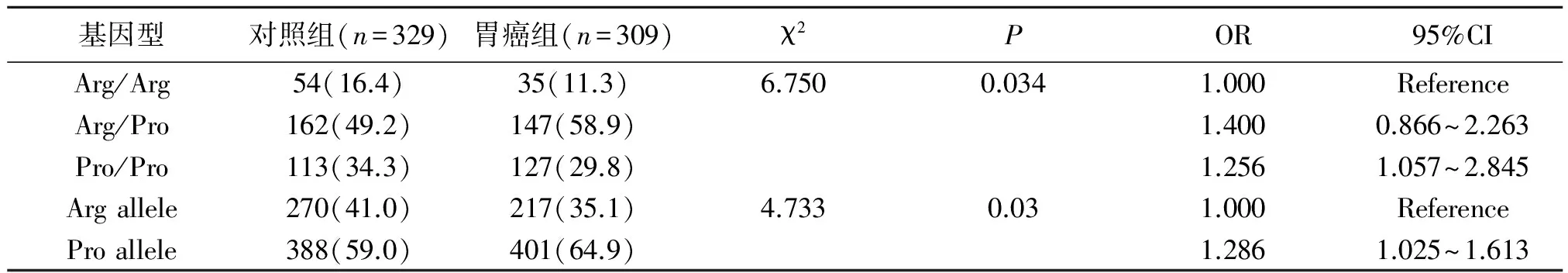
Table 2 distribution of P53Arg72Pro genotype and gene frequency in the two groups(n,%)
2.3 Hp阳性者P53Arg72Pro基因型和基因频率及与胃癌发病风险相关性(表3~4)
按Hp是否感染对P53Arg72Pro等位基因频率在胃癌组和对照组中进行分析,结果是三种基因型在胃癌和对照组间的分布无差异。并将Pro/Pro与Arg/Arg、Arg/Arg与Pro/Pro+ Pro/Arg做比较分析:与胃癌发病相关风险无相关性。
表3 Arg/Arg、Pro/Pro基因型与胃癌发病风险(%)

Table 3 Arg/Arg,Pro/Pro genotype and their relation with the risk of gastric cancer(%)
表4 Arg/Arg、Pro等位基因型与胃癌发病风险(%)
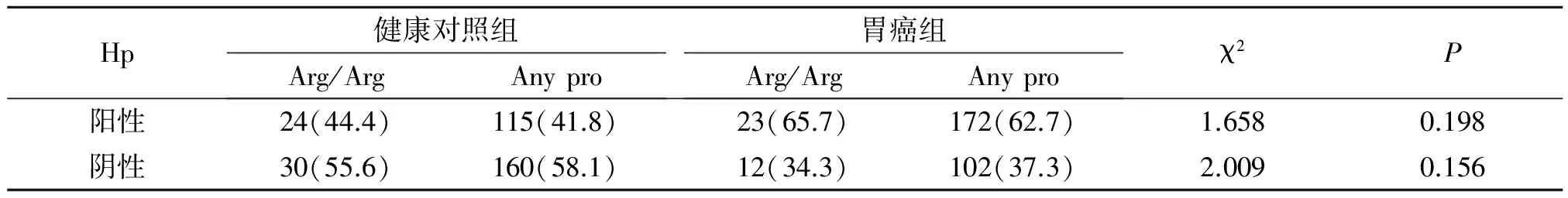
Table 4 Arg/Arg,Pro allele and their relation with the risk of gastric cancer(%)
3 讨论
青海地区平均海拔在3 000米以上,气候属典型的高原内陆性气候,表现为低压、低氧、多风,日温差、年温差大,世居人群长期处于高寒、低氧环境中,易造成人体血管的收缩,血液黏稠度增高并加重组织缺血缺氧,胃黏膜亦处于低氧状态,可导致胃黏膜屏障受损和Hp的定植[3-4];饮食不规律及刺激性食物摄入等造成胃黏膜的机械性损伤,长期刺激引起胃黏膜病变,如慢性浅表性胃炎、慢性萎缩性胃炎、胃溃疡及或胃黏膜肠上皮化生等。胃黏膜慢性炎性反应、胃黏膜上皮细胞分泌功能的紊乱,黏膜屏障的破坏及胃黏膜微环境的改变造成Hp的定植与生长,上述综合因素极易造成胃黏膜的癌变。这其中Hp感染是胃癌发生的主要生物因素[5]。有许多研究结果提示Hp是胃癌发生发展的第一致癌物质[6]。人体一旦发生感染将终身携带,除根除治疗,别无他法。本研究显示青海地区胃癌患者Hp阳性率为63.1%,明显高于对照组,Hp阳性者患胃癌的风险是阴性者的2.338倍。P53是Deleo等[7]在猿病毒40转染细胞研究中首先发现,具有调控细胞周期和保护细胞染色体免受损伤的功能。该基因定位于17号染色体,约有20个碱基对,由11个外显子和10个内含子组成。P53基因表达蛋白生物学功能体现在G1/S期校正点的监测上,P53蛋白G1/S期短暂活化,延长其进入S期的时间,从而引起细胞周期阻滞,使得DNA及时修复[8]。胃癌常见的遗传学改变就是该基因的突变,主要发生在5~8外显子高度保守序列上,产生野生型和突变型两种基因,其中突变型P53基因能促进细胞增殖转化,引起凋亡受阻,具有致癌作用。P53基因是一个重要的抑癌基因,当细胞严重损害时,P53可以使细胞发生凋亡[9]。
最新研究发现,P53基因多态性除存在于第5~8外显子的序列上外,在第4外显子亦存在,72密码子具有CGT/CCT单核苷酸多态性。而Tara等通过研究也发现其多态性在胃癌发生中是大概率事件[10]。编码该基因多态性由精氨酸或脯氨酸碱基对的改变实现:纯合的精氨酸(Arg/Arg)、纯合的脯氨酸(Pro/Pro)、杂合子(Pro/Arg)[11-12]。这些多态性转录的蛋白通过电泳检测和体外功能分析,P53(Pro/Pro)基因型蛋白的转录诱导能力强于Arg型蛋白;而P53(Arg/Arg)基因型蛋白诱导凋亡能力却强于Pro型蛋白。目前关于P53Arg72Pro基因多态与胃癌易感性关系的研究报道不多,且结论不尽相同。Hiyama T[13]等报道日本人等位基因Arg在胃癌组和对照组中分布无显著性差异。Zhang 等[14]在随后的研究中得到了类似的结论。魏桃[15]等研究亦显示P53基因第72密码子多态性与胃癌发生无相关性。Shen[16]等研究报道基因型Pro/Arg以及Pro/Arg+Arg/Arg发生胃癌的风险分别为1.5和1.44,95%CI分别为0.97~2.32和0.95~2.18。单勇等[17]采用TaqMan实时荧光定量PCR方法检测研究对象P53基因Arg72Pro的多态性,结果显示Pro基因型携带者的胃癌发病风险是Arg/Arg基因型携带者的1.846倍,这与我们的研究结果相似:与P53基因Arg/Arg纯合子基因型相比,携带Pro/Pro纯合子基因型的个体在胃癌组显著增高,OR值为1.256,(95%CI:1.057~2.845)。携带Pro等位基因的个体在胃癌组是健康对照组的1.286倍(OR=1.286,95%CI:1.025~1.613)。究其原因,可能与pro基因型使p53 基因抑癌功能改变、凋亡能力降低相关。
Ierardi、高歌等[18-19]发现在Hp感染的癌前病变及胃癌中常伴有P53基因突变。范惠珍[20]等研究的结果也提示Hp感染增强野生型P53(wt-P53)变异表达,进而参与胃癌发生。朱克祥等[21]认为Hp对携带P53Pro等位基因诱导突变能力强于携带Arg/Arg基因型,从而发生胃癌。而本研究按Hp是否感染P53Arg72Pro等位基因频率在胃癌组和对照组中进行分析,结果发现Arg/Arg、Arg/Pro、Pro/Pro三种基因型在胃癌组和对照组间的分布无差异。并将Pro/Pro与Arg/Arg、Arg/Arg与Pro/Pro+Pro/Arg做比较分析其与胃癌发病的相关风险发现亦无相关性,提示P53基因Arg72Pro多态性与胃癌组Hp感染情况无显著相关性。
中国属于国际胃癌高发国之一,青海又是国中高发区,胃癌检出率为7.79%[22]。将青海地区胃癌病例作为研究对象具有重要的地域性意义。本研究结果显示,Hp感染率较高,与胃癌高发可能存在关联;p53Arg72Pro多态性与胃癌组Hp感染情况无显著相关性。青海地区P53Arg72Pro位点基因多态性与胃癌发病的风险相关,若同时携带Pro等位基因,胃癌发生风险明显增加。关于青海地区Hp与P53Arg72Pro位点基因多态性与胃癌发病风险所得结论只能视为初步研究结果,进一步结论需要扩大样本论证。
[1]薛卫成,樊祥山,孟刚.胃癌相关标志物免疫组化指标选择专家共识[J].临床与实验病理学杂志,2014,30(9):951-953.
[2]张毅.抑癌基因失活在多原发性恶性肿瘤发生中的意义[J].中国普外基础与临床杂志,2000,7(6):418.
[3]燕速,白振忠,赵建信,等.CYP2E1DraI基因多态性与青海地区人群胃癌易感性的相关性研究[J].中国癌症杂志,2013,23(4):281-286.
[4]燕速,白振忠,赵建信,等.CYP2E1RsaI基因多态性与青海地区人群胃癌易感性研究[J].青海医学院学报,2013,34(1):7-14.
[5]Konturek PC,Konturek SJ,Brzozowski T.Gastric cancer and Helicobacter pylori infection[J].J Physiol Pharmacol 2006,57(3):51-65.
[6]Sugiyama T,Asaka M.Helicobacter pylori infection and gastric cancer[J].Med Electron-Microse,2004,37(3):149-157.
[7]DeleoAB,JayG,AppellaE,et al.Detection ofa transformation-related antigen in chemically induced sarcomas and other transformed cells of the mouse[J].Proc Natl Acad Sci USA,1979,76(5):2420-2424.
[8]Yang Y,Forslund A,Remotti H,et al.P53 Mutation in Primary Tumors and Subsequent Liver Metastases Are Related to Survial in Patients with Colorectal Carcinoma who Undergo Liver Resection[J].Cancer,2001,91(4):727-736.
[9]Murray-Zmijewski F,Lane DP,Bourdon JC,et al.p53/p63/p73 isoforms:an orchestra of isoforms to harmonise cell differentiation and response to stress[J].Cell Death Differ,2006,13(6):962-972.
[10]Tara Shwpherd,Dawn Tolbert,Jacqueline,et al.Alterations in exon 4 of the p53 gene in gastric carcinoma[J].Gastoenterology,2000,118:1039-1044.
[11]Matlashewski GJ,Tuck S,Pim D,et al.Primary structure polymorphismat amino acid residue 72 of human p53[J].Mol Cell Biol,1987,7:961-963.
[12]Thomas M,Kalita A,Labrecque S,Pim D,et al.Two polymorphic variants of wild-type p53 differ biochemically and biologically[J].Mol Cell Biol,1999,19:1092-1100.
[13]Hiyama T,Tolbert D,Benedetti J,et al.P53 condon 72 polymorphism in susceptibility in patients with Helicobacter-pylori associated chronic gastritis[J].Int J Cancer,2002,100:304-308.
[14]ZunWu Zhang,PaulNewcomb,Andrew Hollowood,et al.Age-associated increase of condon 72 arginine p53 frequency in gastric cardia and non-cardia adenocarcinoma[J].Clin Cancer Res,2003,9:2151-2156.
[15]魏桃,王学红,马臻奇.p53基因第72密码子多态性与青海地区胃癌易感性[J].青海医学院学报,2014,35(1):41-45.
[16]Shen H,Solari A,Wang X,et al.P53 condon 72 polymorphism andrisk of gastric cancer in a Chinese population[J].Oncol Rep,2004,11(5):1115-1120.
[17]单勇,李玉民,李汛,等.甘肃胃癌高发区人群p53基因Arg72Pro多态性的初步研究[J].中国普外基础与临床杂志,2009,16(1):12-17.
[18]Ierardi E,Francavilla R,Panella C.Effect of Helicobacter pylori eradication on intestinal metaplasia and gastric epithelium proliferation[J].Ital J Gastroenterol Hepatol,1997,29:470-475.
[19]高歌,周长玉,林种玉.胃癌与Hp感染及c-myc,p53基因表达的关系[J].世界华人消化杂志,2000,8:941-943.
[20]范惠珍,盛建文,钟谷平.Hp感染及p53蛋白表达与江西宜春地区胃炎、胃癌的相关性[J].山东医药,2010,50(25):45-46.
[21]朱克祥,李玉民,李汛,等.P53Arg72Pro多态性及H pylori感染与胃癌高发区甘肃河西地区胃癌的关系[J].世界华人消化杂志,2009,17(36):3734-3739.
[22]卢永福.青海地区胃癌发病的临床及病理特点( 附3537例分析)[J].高原医学杂志,2006,16(2):16-18.
The relationship between Helicobacter pylori infection,single nucleotide polymorphism of p53 gene Arg72Pro and gastric cancer in Qinghai area#
Ma Xiaoling1,Wang Xuehong2##,Ma Zhenqi2,Yang Shengseng2,Han Qinghua2,Wang Fang2,Li Yuanhua2
(1.Qinghai University Medical College;2.Affiliated Hospital of Qinghai University)
Objective To investigate the situations of Helicobacter pylori infection in patients with gastric cancer at Qinghai province,then explore the relationship between the polymorphism of P53Arg72Pro as well as the Helicobacter pylori infection and gastric cancer in Qinghai.Methods To determine the infection rate of Helicobacter pylori with the14C urea breath test(14C-UBT)as well as the rapid urease test(RUT).To detect the polymorphism of P53Arg72Pro through the real-time PCR(TaqMan)among the patients with gastric carcinoma and the normal individuals in the region of Qinghai.And carried out the correlation analysis as well.Results The rates of Helicobacter pylori infection were 63.1% in the gastric carcinoma patients and 42.2% in the healthy control group,with a significant difference between the two groups(P<0.05).Three genotypes of P53Arg72Pro were identified:Arg/Arg,Arg/Pro and Pro/Pro.The frequencies of these three genotypes are 11.3%,58.9% and 29.8 %,respectively,among the patients with gastric cancer,and the corresponding values were 16.4%,49.2%and34.3%,respectively,among the control group.Compared with Arg/Arg genotype,the results of Pro/Pro genotype have a significant difference between cancer patients and controls(The value of OR is 1.256,95%CI:1.057-2.845).The frequencies of Arg and Pro alleles are 35.1% and 64.9%,respectively,for the patients with gastric cancer and those values are 41.0% and 59.0%,respectively,for the control group of healthy people,which showed a significant difference(P<0.05 ).The risk of gastric cancer for the carriers with Pro alleles was 128% of the value for the control group.The frequencies of p53Arg72Pro allele in the patients with gastric cancer and the group of healthy people were analyzed whether or not infected with Helicobacter pylori.The result showed that there were no difference between the three genotypes in gastric cancer and control group.And the comparative analysis for Pro/Pro and Arg/Arg,Arg/Arg and Pro/Pro +Pro/Arg showed that there was no risks associated with gastric cancer susceptibility.Conclusion The rate of Helicobacter pylori infection in patients with gastric cancer is high in Qinghai area;There is no association between Hp infection and p53Arg72Pro gene polymorphism or the susceptibility of gastric cancer in Qinghai region.P53Arg72Pro loci polymorphisms are associated with the risk of gastric cancer in Qinghai area,if carry Pro allele at the same time,significantly increased the susceptibility risk of gastric cancer.
Qinghai area Helicobacter pylori Arg72Pro p53 Single nucleotide Gene polymorphism Gastric cancer
R394
A
10.13452/j.cnki.jqmc.2016.02.005
2016-01-09
#:青海省自然科学基金(2012-Z-908);##:通讯作者,主任医师,E-mail:lindawang0710@ hotmail.com 马晓玲(1988~),女,回族,青海籍,青海大学医学院2013级内科班硕士研究生

