沉默GOLPH3基因对胃癌细胞增殖、凋亡的影响及机制探讨
谢芳,赖铭裕,农云翠,苏婷
(1 广西医科大学第一附属医院,南宁530021;2 广西民族医院;3南宁市第二人民医院)
沉默GOLPH3基因对胃癌细胞增殖、凋亡的影响及机制探讨
谢芳1,赖铭裕1,农云翠2,苏婷3
(1 广西医科大学第一附属医院,南宁530021;2 广西民族医院;3南宁市第二人民医院)
摘要:目的观察特异性沉默高尔基体磷蛋白3(GOLPH3)基因对胃癌细胞增殖、凋亡的影响,并探讨其机制。方法将人胃癌SGC-7901细胞随机分为3组,A、B组分别转染LV-GOLPH3-RNAi-1、无义链,C组不转染。转染72 h后,采用MTT法检测细胞增殖能力,流式细胞术检测细胞凋亡,Western blot法检测细胞GOLPH3、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)和mTOR。结果A组细胞增殖的OD值较B、C组低,细胞凋亡率(2.70%±0.11%)高于B组(0.42%±0.02%)和C组(0.31%±0.02%),细胞GOLPH3、p-mTOR蛋白表达量较B、C组少,P均<0.05;B、C组间各指标比较,P均>0.05。结论沉默GOLPH3基因能抑制胃癌细胞增殖、促进胃癌细胞凋亡,其机制可能与下调mTOR信号通路中关键因子p-mTOR表达有关。
关键词:胃癌细胞;高尔基体磷蛋白3;小干扰核糖核酸;细胞增殖;细胞凋亡;哺乳动物雷帕霉素靶蛋白
高尔基体磷蛋白3(GOLPH3)是一个新发现的癌基因[1],在多种恶性肿瘤中存在过量表达[2~6],能通过激活哺乳动物雷帕霉素靶蛋白(mTOR)信号通路促进肿瘤发生。有研究发现,GOLPH3在胃癌组织中高表达,提示其在胃癌发生、发展中起重要作用,但机制尚不清楚[7]。2013年3月~2015年1月,我们观察了特异性沉默GOLPH3基因对胃癌细胞增殖、凋亡的影响,为寻找胃癌的基因靶向治疗奠定实验基础。现报告如下。
1材料与方法
1.1材料人胃癌细胞株SGC-7901购自中国科学院上海细胞所;本实验室共设计3条针对GOLPH3基因的siRNA序列,选择其中沉默效率最高的LV-GOLPH3-RNAi-1进行实验;胎牛血清(FBS)购自杭州四季青生物工程有限公司;RPMI 1640培养基购自Hyclone公司;逆转录试剂盒及实时荧光定量PCR试剂均购自日本TaKaRa公司;MTT购自北京索来宝生物科技有限公司;Annexin V-PE/7-AAD凋亡试剂盒购自美国BD公司;GOLPH3兔抗人多克隆抗体购自美国Abcam公司、 mTOR和磷酸化mTOR(p-mTOR)兔抗人单克隆抗体购自美国Cell Signaling Technology公司。
1.2方法
1.2.1细胞培养与分组处理将SGC-7901置于含10% FBS的RPMI 1640培养基中,37 ℃ 5% CO2条件下培养,常规更换培养液、传代。取第5代细胞,随机分为3组。A、B组分别采用Lipofectamine 2000转染LV-GOLPH3-RNAi-1、无义链,C组不转染。A、B组细胞均转染72 h。
1.2.2细胞增殖观察采用MTT法。收集各组细胞,以5×103/孔接种于96孔板,每组设5个复孔。于接种后24、48、72、96、120、144、168 h在培养基中加入20 μL的 MTT溶液,使MTT终浓度为0.5 mg/mL,置于培养箱中继续培养4 h。吸净上清后,加入等体积DMSO,置于摇床振荡10 min;酶标仪检测492 nm波长处各孔光密度(OD)值,以此表示细胞增殖能力。
1.2.3细胞凋亡观察收集各组细胞,按照Annexin V-PE/7-AAD凋亡试剂盒使用说明书操作,采用流式细胞术检测凋亡细胞,计算细胞凋亡率。
1.2.4细胞GOLPH3、mTOR和p-mTOR蛋白检测采用Western blot法。收集各组细胞,用RIPA及PMSF裂解液提取各组细胞总蛋白;将总蛋白液及上样缓冲液按5∶1混合,沸水煮5 min变性后制成蛋白质样品;配制5%浓缩胶和10%分离胶,将等量样品加入凝胶孔道中电泳;100 mA稳流状态下转膜,将蛋白转至聚偏二氟乙烯膜;用5%蛋白封闭液室温于摇床上摇动封闭1 h,用TBST漂洗后置于一抗(GOLPH3、β-actin均1∶10 000稀释) 中4 ℃孵育过夜;再次TBST漂洗后加入稀释的山羊抗兔二抗(1∶5 000) ,室温置于摇床上孵育1 h,TBST洗膜(5次×5 min)后进行显影定影。以目的蛋白与β-actin条带的OD比值表示目的蛋白表达量。

2结果
2.1各组细胞增殖能力比较A组各时点细胞增殖较B、C组缓慢(P均<0.05),而B、C组比较无统计学意义(P均>0.05)。见表1。

表1 各组细胞增殖能力比较±s)
注:与C组比较,*P<0.05;与B组比较,#P<0.05。2.2各组细胞凋亡率比较A组细胞凋亡率(2.70%±0.11%)高于B组(0.42%±0.02%)和C组(0.31%±0.02%),P均<0.05;B、C组间比较,P>0.05。
2.3各组GOLPH3、mTOR和p-mTOR蛋白表达比较 见表2。
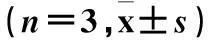
表2 各组GOLPH3、mTOR和p-mTOR蛋白表达
注:与C组比较,*P<0.05;与B组比较,#P<0.05。
3讨论
GOLPH3蛋白是一种高度保守的高尔基体基质蛋白,相对分子量为34 kD,其编码基因位于人类染色体5p13区域上。2000年,Wu等[8]首次发现位于高尔基体反面网络结构(GN)的GOLPH3。GOLPH3与高尔基体正常形态保持有关,并参与蛋白质的加工、修饰和转运:GOLPH3与磷脂酰肌醇-4-磷酸结合[ptdlns(4)p],影响高尔基体的分泌和转运功能[9];GOLPH3与糖基酰转移酶的N末端相连接,使蛋白质锚定于高尔基体上,从而影响蛋白质的糖基化修饰[10,11];GOLPH3与肌球蛋白MY018A、ptdlns(4)p及细胞骨架肌动蛋白F-actin相连组成复合体,参与高尔基体正常形态的保持和囊泡转运[12]。有研究者发现,将横纹肌肉瘤细胞中的GOLPH3基因敲除后可抑制横纹肌肉瘤细胞的增殖。体外实验发现,慢病毒介导的GOLPH3沉默有明显的抗食管鳞癌作用,是治疗食管癌的潜在分子靶点[13]。Hu等[7]研究发现,GOLPH3表达与胃癌的肿瘤大小、浸润深度、淋巴结转移、远处转移、病理分级等显著相关,提示GOLPH3过表达有可能是胃癌预后不良的独立预测指标。
RNAi技术是利用外源性或内源性的双链RNA(dsRNA)特异性的将细胞内的同源mRNA降解为21~23个核苷酸的小片段,从而导致靶基因沉默的技术,具有特异性、高效性等特点,目前广泛应用于恶性肿瘤的基因治疗、病毒感染性疾病等的研究[14]。本研究结果表明,RNAi沉默GOLPH3表达能显著抑制胃癌细胞SGC-7901的增殖,但机制尚不清楚。
细胞增殖、凋亡受多种信号通路的调控,信号传导系统异常可引起细胞增殖、凋亡改变,甚至恶变[15]。Scott等[1]认为,GOLPH3能通过激活mTOR信号通路诱导正常细胞发生转化,促使细胞增殖、分化过程失去平衡,最终导致细胞恶性转化以及肿瘤发生,并增加肿瘤细胞对雷帕霉素的敏感性。国内有研究发现,PI3K/mTOR双重抑制剂PF-04691502能通过阻滞细胞周期来抑制SGC-7901细胞增殖[16]。本研究结果表明,抑制GOLPH3基因可下调mTOR信号转导通路中关键因子p-mTOR的表达,GOLPH3可能是通过mTOR信号转导通路影响胃癌细胞的增殖、凋亡。因此,GOLPH3可作为潜在靶点在胃癌早期治疗中发挥重要作用,也为进一步阐明GOLPH3与胃癌发生的可能机制提供了实验基础。
参考文献:
[1] Scott KL, Kabbarah O, Liang MC, et al. Golph3 modulates mtor signalling and rapamycin sensitivity in cancer[J]. Nature, 2009,459(7250):1085-1090.
[2] Kunigou O, Nagao H, Kawabata N, et al. Role of golph3 and golph3L in the proliferation of human rhabdomyosarcoma[J]. Oncology reports, 2011,26(5):1337-1342.
[3] Wang JH, Chen XT, Wen ZS, et al. High expression of golph3 in esophageal squamous cell carcinoma correlates with poor prognosis[J]. PLoS One,2012,7(10):e45622.
[4] Zhou J, Xu T, Qin R, et al. Overexpression of golgi phosphoprotein-3 (golph3) in glioblastoma multiforme is associated with worse prognosis[J]. J Neurooncol, 2012,110(2):195-203.
[5] Zhou X, Zhan W, Bian W, et al. Golph3 regulates the migration and invasion of glioma cells though RhoA[J]. Biochem Biophys Res Commun, 2013,433(3):338-344.
[6] Wang Z, Jiang B, Chen L, et al. Golph3 predicts survival of colorectal cancer patients treated with 5-fluorouracil-based adjuvant chemotherapy[J]. J Transl Med, 2014,12(1):15.
[7] Hu BS, Hu H, Zhu CY, et al. Overexpression of golph3 is associated with poor clinical outcome in gastric cancer[J]. Tumour Biol, 2013,34(1):515-520.
[8] Wu CC, Taylor RS, Lane DR, et al. Gmx33: A novel family of trans-golgi proteins identified by proteomics[J]. Traffic,2000,1(12):963-975.
[9] D′Angelo G, Vicinanza M, Di Campli A, et al. The multiple roles of ptdins(4)p -- not just the precursor of ptdins(4,5)p2[J]. J Cell Sci,2008,121(Pt 12):1955-1963.
[10] Schmitz KR, Liu J, Li S, et al. Golgi localization of glycosyltransferases requires a vps74p oligomer[J]. Dev Cell,2008,14(4):523-534.
[11] Wood CS, Schmitz KR, Bessman NJ, et al. Ptdins4p recognition by vps74/golph3 links ptdins 4-kinase signaling to retrograde golgi trafficking[J]. J Cell Biol, 2009,187(7):967-975.
[12] Scott KL, Chin L. Signaling from the golgi: Mechanisms and models for golgi phosphoprotein 3-mediated oncogenesis[J]. Clin Cancer Res, 2010,16(8):2229-2234.
[13] Wang Q, Wang X, Zhang CB. Lentivirus mediated golph3 shrna inhibits growth and metastasis of esophageal squamous cancer[J]. Asian Pac J Cancer Prev, 2013,14(9):5391-5396.
[14] Singh S, Narang AS, Mahato RI. Subcellular fate and off-target effects of sirna, shrna, and mirna[J]. Pharm Res, 2011,28(12):2996-3015.
[15] Klinke DJ 2nd. Signal transduction networks in cancer: quantitative parameters influence network topology[J]. Cancer Res, 2010,70(5):1773-1782.
[16] 费洪荣,赵莹,王桂玲,等.PI3K/mTOR双重抑制剂PF-04691502诱导人胃癌SGC-7901细胞凋亡[J].中国病理生理杂志,2013,29(11):1962-1965.
Effect of silencing GOLPH3 on proliferation and apoptosis of gastric cancer cells
XIEFang1,LAIMingyu,NONGYuncui,SUTing
(1TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Abstract:ObjectiveTo observe the effects of specifically silencing Golgi phosphoprotein 3 (GOLPH3 ) gene on proliferation and apoptosis of gastric cancer cells, and to investigate the mechanism.MethodsThe human gastric carcinoma cells SGC-7901 were randomly divided into 3 groups. Cells of group A were transfected with lentiviral-mediated siRNA sequences while cells of group B were transfected with lentiviral-mediated scramble sequences and group C without transfection. The cell proliferation was detected by methyl thiazol tetrazolium (MTT) at 72 h after transfection. The apoptotic rate was detected by flow cytometry. The protein expression of GOLPH3, mammalian target of rapamycin (mTOR) and p-mTOR was examined by Western blotting. ResultsThe OD value of group A was lower than those of groups B and C at different time points, the apoptotic rate of A group (2.70%±0.11%) was statistically higher than that of group B (0.42%±0.02%) and group C (0.31%±0.02%), and the relative expression of GOLPH3 and p-mTOR protein of group A was lower than that of groups B and C (all P<0.05); no significant differences in the above indexes were found between groups B and C (all P>0.05). ConclusionSilencing GOLPH3 can inhibit the cell proliferation and promote the apoptosis of gastric cancer cells and the mechanism may be related with the down-regulated expression of p-mTOR in SGC-7901 cells.
Key words:gastric carcinoma cells; Golgi phosphoprotein 3; small interfering RNA; cell proliferation; cell apoptosis; mammalian target of rapamycin
(收稿日期:2015-10-21)
中图分类号:R735.2
文献标志码:A
文章编号:1002-266X(2016)10-0007-03
doi:10.3969/j.issn.1002-266X.2016.10.003
通信作者简介:赖铭裕(1969-),男,主任医师,主要研究方向为胃癌发病机制。E-mail: 2411423770@qq.com
作者简介:第一谢芳(1986-),女,在读硕士研究生,主要研究方向为胃癌发病机制。E-mail: 993661989@qq.com
基金项目:广西医疗卫生适宜技术研究与开发资金资助项目(S201415-01)。

