TLR2和TLR4在人慢性根尖周病组织肥大细胞上的表达*
桃子玺, 范挽亭, 李 娟, 黄世光
(暨南大学医学院口腔医学系,广东 广州 510632)
TLR2和TLR4在人慢性根尖周病组织肥大细胞上的表达*
桃子玺▲,范挽亭▲,李娟,黄世光△
(暨南大学医学院口腔医学系,广东 广州 510632)
[摘要]目的: 观察人不同类型慢性根尖周病组织中肥大细胞(mast cells, MCs)上Toll样受体2(Toll-like receptor 2, TLR2)和TLR4的表达情况,探讨TLR2-类胰蛋白酶(tryptase)和TLR4-tryptase双阳性MCs在慢性根尖周疾病发病机制中的作用。方法: 将60例自愿参与本研究的受试者按根尖周病分类标准分为3组:(1)正常对照组;(2)根尖周肉芽肿组;(3)根尖周囊肿组。将根尖周组织标本置于4%甲醛固定液中浸泡48 h以上,制作连续组织切片。HE染色,光学显微镜下观察各组根尖周标本的组织学变化;免疫荧光双染色后于荧光显微镜下观察TLR2-tryptase和TLR4-tryptase双阳性MCs在根尖周组织中的分布情况。结果: 根尖周病变组TLR2-tryptase和TLR4-tryptase双阳性MCs比正常牙周膜组明显增多(P<0.01);与根尖肉芽肿组相比,根尖囊肿组TLR2-tryptase及TLR4-tryptase双阳性MCs数目明显增高(P<0.01)。结论: TLR2及TLR4在慢性根尖周疾病组织中MCs上表达增加,提示TLR2-tryptase及TLR4-tryptase双阳性MCs可能参与慢性根尖周病发病过程的免疫调节。
[关键词]慢性根尖周病; 肥大细胞; Toll样受体2; Toll样受体4
慢性根尖周疾病是口腔常见疾病之一,主要由来源于感染根管的细菌及其代谢产物扩散至根尖周组织所致,表现为根尖周组织的炎症与骨吸收。传统认为,肥大细胞(mast cells, MCs)是过敏性炎症反应的主要效应细胞,近年的研究发现, MCs作为效应和调节性免疫细胞在固有免疫的建立和适应性免疫反应中发挥重要作用[1]。我们前期研究结果显示MCs的募集和脱颗粒、肥大细胞Toll样受体4(Toll-like receptor 4, TLR4)与牙周病及其炎症程度密切相关,肥大细胞转化生长因子β和干细胞因子在慢性根尖周疾病致病过程,尤其在根尖周囊肿的纤维组织形成中发挥重要作用;提示MCs在牙周病的发病及病理过程中起重要作用,SCF-tryptase及TGF-β-tryptase双阳性MCs与慢性周病的炎症损害有关[2-5]。TLR2和TLR4作为TLRs家族的重要成员,能够识别各种病原微生物表达的病原识别受体(pathogen recognition receptors, PRRs),属于Ⅰ型跨膜蛋白受体[6],能广泛识别病原体相关分子模式(pathogen-associated molecular patterns, PAMPs),介导炎症反应。已有研究证实在人类根尖周病变组织中有TLR2和TLR4表达,提示TLR2和TLR4在机体对病原体免疫识别,以及固有免疫和适应性免疫过程中发挥着重要作用。目前,关于TLR2和TLR4在MCs上的表达及其在慢性根尖周病发病机制中作用尚未见报道。本文通过免疫荧光双染色法,观察不同类型人慢性根尖周炎组织中MCs上TLR2与TLR4表达情况,探讨MCs的TLR2和TLR4在根尖周感染中的作用及机制。
材料和方法
1研究对象
1.1根尖周病例选择慢性根尖周炎病例选择2013年7月~2014年6月在暨南大学荔湾口腔教学医院就诊的15~62岁患者共60例,其中男性27例,(32.0±15.5)岁,女性33例,(30.0±14.2)岁,所有患者均排除患有系统性疾病,就诊时为非急性炎症期,且2个月内没使用过抗生素,所有患者均签署知情同意书。
1.2分组及取材(1)正常对照(control)组:取自因正畸治疗需要拔除的根尖周组织健康且牙根发育完全的前磨牙的根尖牙周膜组织。纳入标准:活髓牙;X线显示根尖区未见低密度的透射影;牙周膜光滑连续且拔牙过程未伤及根尖区牙周膜;组织学观察未见毛细血管增生及炎症细胞浸润。(2)根尖周肉芽肿(periapical granuloma)组:取自因根尖周病变无法通过非手术方法治愈须行根尖刮治术获取的根尖周组织。纳入标准:非活髓牙;X线显示患牙的根尖区有圆形或椭圆形边界清晰的低密度透射影,直径≤1 cm;手术过程中发现根尖区存有病变实性软组织;组织学观察显示根尖周病变组织为肉芽组织团块,伴毛细血管增生及大量炎症细胞浸润。(3)根尖周囊肿(periapical cyst)组:取自因根尖周病变无法通过非手术方法治愈须行刮治术的根尖周组织。纳入标准:非活髓牙;X线显示患牙的根尖区有圆形或椭圆形低密度透射影,直径≥1 cm,边缘有明显的白色阻射线;手术过程中发现根尖区病变组织为内含液体或半固体的囊性组织;组织学观察显示根尖周病变组织含大量的胶原纤维,为非角化复层鳞状上皮完全或部分覆盖的囊腔或组织。
2实验方法
2.1组织标本采集、处理与观察根尖肉芽肿和根尖囊肿标本是在根尖刮治手术时取得的根尖周病变组织。正常对照组标本取自因正畸需要拔除的牙周健康的前磨牙,用无菌刀片将牙周膜从牙根上刮取。样本取出后立即固定于4%甲醛中浸泡48 h以上,经脱水、透明、浸蜡、包埋,制备成5 μm厚度连续组织切片。HE染色,光学显微镜下观察各组标本的组织学改变。
2.2TLR2和TLR4阳性MCs免疫荧光双染色Ⅰ抗: tryptase 抗体(Abcam),稀释浓度为1∶200;TLR2和TLR4 抗体(武汉博士德)稀释浓度为1∶100。Ⅱ抗: 山羊抗鼠IgG(H+L)Alexa Fluor 488 和山羊抗兔IgG(H+L)Alexa Fluor 555(CST),稀释浓度为1∶200。DAPI(MP Biomedicals),稀释浓度1∶200。组织切片经过常规脱蜡、乙醇复水,柠檬酸盐缓冲液微波抗原修复、山羊血清封闭,Ⅰ抗孵育,避光条件下Ⅱ抗孵育荧光染色后,立即在荧光显微镜下观察。阴性对照组用PBS代替Ⅰ抗和Ⅱ抗,DAPI核染,立即在荧光显微镜下观察。Tryptase 免疫荧光阳性信号为绿色荧光,TLR2和TLR4信号均显示红色荧光,定位于细胞浆或细胞膜,同一视野下tryptase 绿色荧光分别与TLR2和TLR4 红色荧光重叠后为橘色荧光,DAPI 信号显示为蓝色,定位于细胞核。由2 名病理医师于免疫荧光显微镜下观察到MCs 均表达有TLR2 和TLR4,从而对各组实验标本中TLR2和TLR4阳性MCs 计数并计算各组TLR2 和TLR4 阳性MCs 密度(cells/mm2)。每张切片在高倍镜下(×400)选取橘色荧光最多的5个视野进行计数,计算5个视野中TLR2和TLR4阳性的MCs的密度(cells/mm2)。
3统计学处理
数据以均数±标准差(mean±SD)表示,采用统计软件SPSS 13.0分析处理。各组标本组织中TLR2-tryptase和TLR4-tryptase双阳性MCs平均密度的比较采用Kruskal-Wallis 检验,采用Nemenyi 检验进行多重比较。以P<0.05为差异有统计学意义。
结果
1组织学观察
正常对照组:根尖周牙周膜组织结构完整,纤维组织丰富,以成纤维细胞为主,未见明显的炎症细胞浸润;根尖肉芽肿组:根尖周牙周膜组织结构破坏,主要由新生的毛细血管、成纤维细胞和浸润的中性粒细胞、淋巴细胞、浆细胞和巨噬细胞等炎症细胞构成,部分病变内部见上皮条索及上皮岛;根尖周囊肿组:根尖周牙周膜组织结构破坏,毛细血管扩张,镜下可见根尖周囊肿组织上皮层表现为细胞间水肿,上皮层下方见大量慢性炎症细胞浸润;纤维组织层以胶原纤维为主,未见明显的炎症细胞浸润。同时部分囊壁内见含铁血黄素和胆固醇晶体沉积的梭形间隙,见图1。

Figure 1.Histology of human periapical tissues(HE staining, ×400). A: healthy control; B: periapical granuloma; C: the epithelial layer of periapical cyst; D: the fibrous tissue area of periapical cyst.
图1各实验组组织学观察
2TLR2阳性MCs免疫荧光双染色结果
各组标本组织中TLR2-tryptase双阳性MCs 免疫荧光双染色结果见图2。结果显示,各组标本组织MCs 均表达TLR2。正常对照组:根尖周牙周膜组织中见少量散在分布的TLR2-tryptase双阳性MCs;根尖肉芽肿组:与正常对照组对比,根尖周组织中可见TLR2-tryptase双阳性MCs 数目显著增多,且MCs 有脱颗粒现象;根尖囊肿组:根尖周病变组织中出现大量的TLR2-tryptase双阳性MCs,且MCs 伴明显脱颗粒现象;各组标本组织的阴性对照组均未见TLR2和tryptase阳性表达,可见DAPI核染,见图3。
各组标本组织中TLR2-tryptase双阳性MCs密度的比较见图4,结果显示:2组慢性根尖周病组织中TLR2-tryptase双阳性MCs的数量较正常对照组明显增多(P<0.01);根尖周囊肿组TLR2-tryptase双阳性MCs的数量较根尖周肉芽肿组明显增多(P<0.01)。
各标本组织中TLR2-tryptase双阳性MCs及脱颗粒MCs密度比较见图5。与正常对照组相比,2组慢性根尖周病组织中MCs密度及脱颗粒MCs密度显著上升(P<0.01),且根尖囊肿组的MCs密度及脱颗粒MCs明显高于根尖肉芽肿组(P<0.05)。
3TLR4阳性MCs免疫荧光双染色结果
各组标本组织中TLR4-tryptase双阳性MCs 免疫荧光双染色结果见图6。结果显示,各组标本组织MCs 均表达TLR4。正常对照组牙周膜组织中见少量散在分布的TLR4-tryptase双阳性MCs;根尖肉芽肿组组织中TLR4-tryptase双阳性MCs数目显著增多,且MCs有脱颗粒现象;根尖囊肿组组织中出现大量的TLR4-tryptase双阳性MCs,且MCs伴明显脱颗粒现象;各组标本组织的阴性对照组均未见TLR4和tryptase阳性表达,可见DAPI核染,见图7。
Figure 2.TLR2-tryptase double-positive mast cells in human gingival tissues (double immunofluorescence staining, ×400). Scale bar=50 μm.
图2各实验组中TLR2-tryptase双阳性肥大细胞
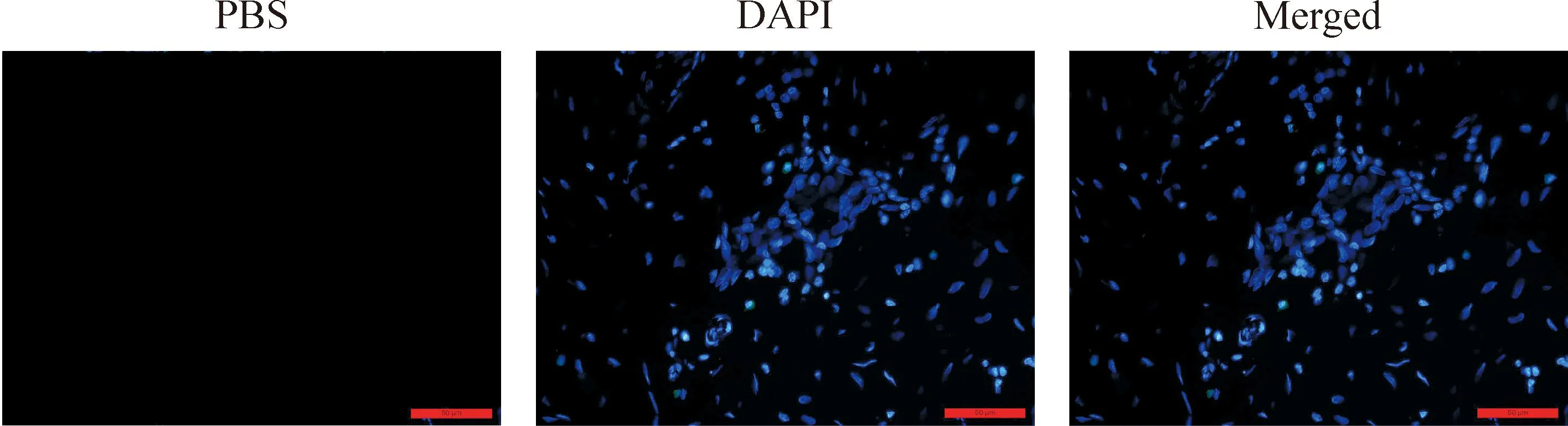
Figure 3.Negative control group for TLR2 and tryptase staining (double immunofluorescence staining, ×400). Scale bar=50 μm.
图3TLR2 和tryptase染色的阴性对照组

Figure 4.The density of TLR2-tryptase positive MCs. Mean±SD.n=20.**P<0.01vshealthy control;##P<0.01vsperiapical granuloma.
图4各组标本组织中TLR2-tryptase双阳性肥大细胞密度的比较
各组标本组织中TLR4-tryptase 双阳性MCs 密度见图8,结果显示:2组慢性根尖周病组织中TLR4-tryptase双阳性MCs的数量较正常对照组明显增多(P<0.01);根尖周囊肿组TLR4-tryptase双阳性MCs的数量较根尖周肉芽肿组明显增多(P<0.01)。
各标本组织中tryptase阳性MCs及脱颗粒MCs密度比较见图9。与正常对照组相比,2组慢性根尖周病组织中MCs密度及脱颗粒MCs密度显著上升(P<0.01),且根尖囊肿组的MCs密度及脱颗粒MCs明显高于根尖肉芽肿组(P<0.05)。
讨论
目前研究认为,根尖周疾病的发病与革兰氏阳性菌及革兰氏阴性菌混合感染相关[7]。感染根管的细菌或细菌毒素扩散侵入根尖周组织区域,启动机体免疫炎症反应,产生一系列引起根尖周局部组织损伤的介质[8]。根尖周组织抗原提呈细胞(antigen-presenting cells, APCs)通过对病原微生物PRRs进行特异性抗原识别,上调共刺激分子并分泌细胞因子,从而激活适应性免疫系统[9]。研究显示,在健康根尖周组织中仅有少量APCs存在;受病原微生物入侵刺激,根尖周组织中APCs的表达明显增加[7]。
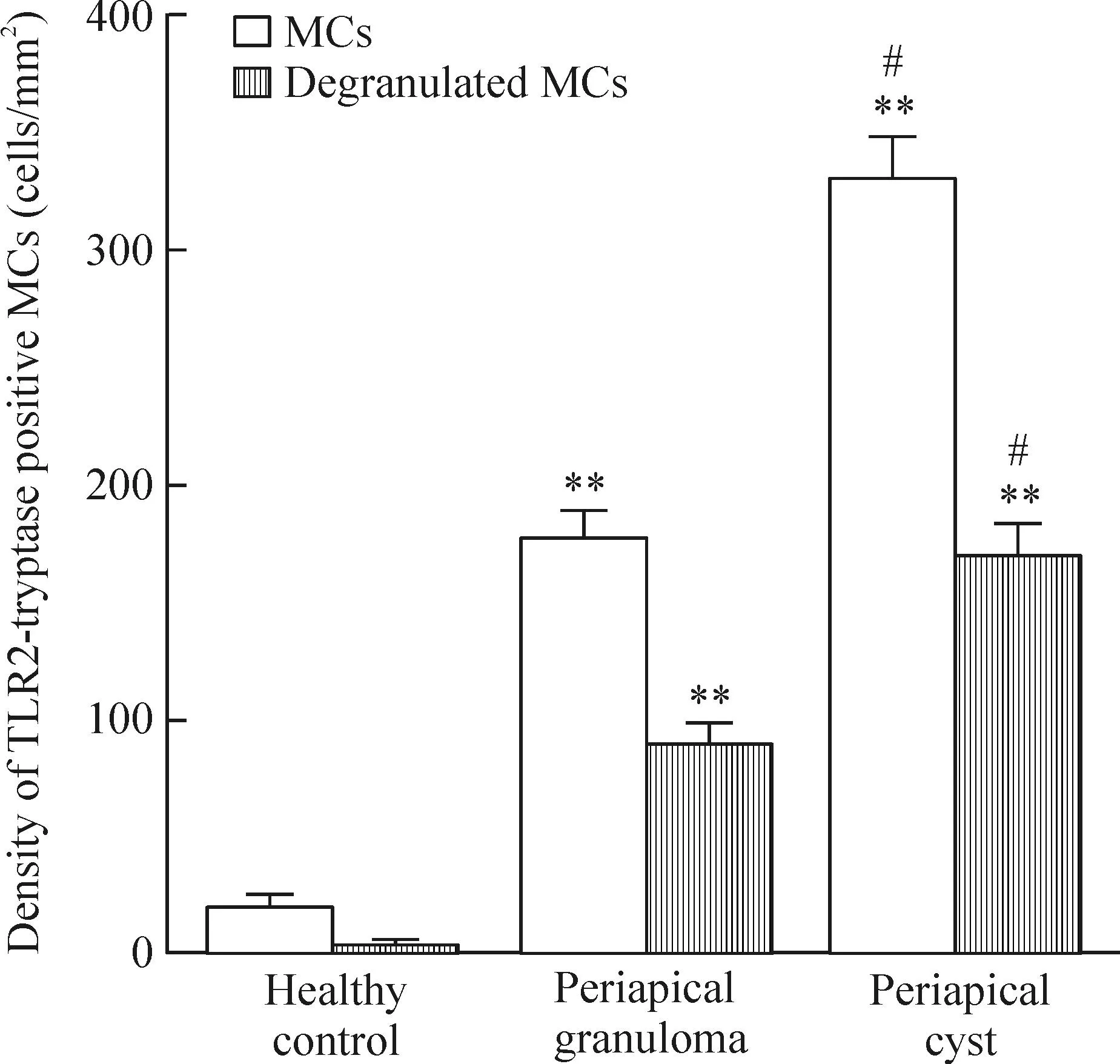
Figure 5.Density of TLR2-tryptase positive MCs and degranulated MCs. Mean±SD.n=20.**P<0.01vshealthy control;#P<0.05vsperiapical granuloma.
图5各标本组织中TLR2-tryptase双阳性MCs及脱颗粒MCs密度的比较
MCs是机体固有免疫细胞,参与特殊炎症反应或机体防御反应,发挥多种免疫功能[10]。研究证实MCs能表达多种PRRs,包括TLRs。MCs通过其表面的TLRs,如TLR2和TLR4识别广泛的PAMPs,此过程与其抗菌防御和炎症反应的进展密切相关[11-12]。MCs可被TLRs激活剂直接激活,合成分泌TNF-α、IL-1β、IL-5、IL-8等细胞因子;此外,TLRs活化也可引起MCs脱颗粒,释放组胺、蛋白酶、趋化因子等细胞介质。TLR受体信号通路已被证实与FcεRI通路间有交联反应,两者协同调节MCs的功能[13]。Konopka等[14]体外实验显示,TLRs和FcεRI同时活化可促使MCs释放细胞因子。
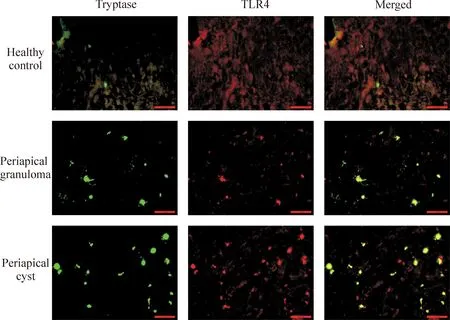
Figure 6.TLR4-tryptase double-positive mast cells in human gingival tissues (double immunofluorescence staining, ×400). Scale bar=50 μm.
图6各实验组中TLR4-tryptase双阳性肥大细胞

Figure 7.Negative control group for TLR4 and tryptase staining (double immunofluorescence staining, ×400). Scale bar=50 μm.
图7TLR4T和tryptase染色的阴性对照组
TLRs活化导致多效应分子的释放,如诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、抗菌肽,起到抑制病原体的作用[15]。TLR2能与TLR1或TLR6形成功能性复合体[16-17],识别革兰氏阳性菌肽聚糖(PGN)及脂磷壁酸(LTA)、革兰氏阴性菌脂蛋白脂肽、牙龈卟啉单胞菌非典型脂多糖等。粪肠球菌是难治性根尖周病根管内主要细菌,能使人成牙本质细胞中TLR2/TLR1复合体的活化[18]。在以T淋巴细胞为主导的慢性根尖肉芽肿中,在CD4+CD3+CD14-T细胞上有TLR2表达[19]。TLR4是最先被发现于哺乳动物的TLRs,其主要配体是革兰氏阴性菌的LPS[20]。TLR4能与髓样细胞分化蛋白2(myeloid differentiation protein 2, MD2),形成复合物发挥作用,参与LPS信号的识别和转导,这在MCs上有所表现[21]。Vosskuhl 等[22]研究表明,经TLR4激活的MCs,能够使自然杀伤细胞的干扰素γ(interferon-γ,IFN-γ)分泌量增长20倍,增强MCs在固有免疫调控中的作用。
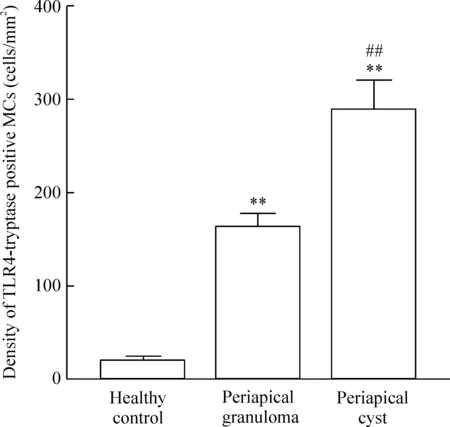
Figure 8.The density of TLR4-tryptase positive MCs. Mean±SD.n=20.**P<0.01vshealthy control;##P<0.01vsperiapical granuloma.
图8各组标本组织中TLR4-tryptase双阳性肥大细胞密度的比较
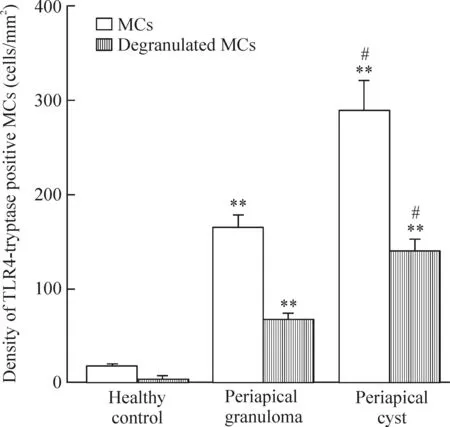
Figure 9.Density of TLR4-tryptase positive MCs and degranulated MCs. Mean±SD.n=20.**P<0.01vshealthy control;#P<0.05vsperiapical granuloma.
图9各标本组织中TLR4-tryptase双阳性MCs及脱颗粒MCs密度的比较
本实验中我们发现TLR2-tryptase和TLR4-tryptase双阳性MCs的数量在慢性根尖周病组织中较正常牙周膜组的数量显著增多,而TLR2-tryptase和TLR4-tryptase双阳性MCs在根尖囊肿组的数量明显多于根尖肉芽肿组。本实验结果是该领域的首次发现,提示TLR2-tryptase与TLR4-tryptase双阳性MCs在根尖周病的发病中具有重要作用。因此,通过调控肥大细胞Toll样受体可能成为阻止根尖周病发展的一个治疗目标,从而为根尖周病的治疗提供新的方向。
[参考文献]
[1]Zhang J, Alcaide P, Liu L, et al. Regulation of endothe-lial cell adhesion molecule expression by mast cells, macrophages, and neutrophils[J]. PLoS One, 2011, 6(1):e14525.
[2]潘倩茹, 吕芳丽, 黄博, 等. 肥大细胞脱颗粒在牙周炎病理中的作用[J]. 实用口腔医学杂志, 2012, 28 (3):316-319.
[3]蓝田, 吕芳丽, 李娟, 等. 肥大细胞Toll 样受体4在人慢性牙周炎牙龈组织中的表达[J]. 中国病理生理杂志, 2013, 29(8):1476-1480.
[4]靳华, 施庆颜, 梁经文, 等. 肥大细胞干细胞因子在人慢性根尖周病中的表达[J]. 中国病理生理杂志, 2014, 30(12):2243-2248.
[5]尹小萍,陈柯,谢锦强,等. 肥大细胞转化生长因子β在人慢性根尖周病组织中的表达[J]. 中国病理生理杂志, 2015, 31(7):1247-1252.
[6]Takeda K, Akira S. Toll-like receptors in innate immunity[J]. Int Immunol, 2005, 17(1):1-14.
[7]Desai SV, Love RM, Rich AM, et al. Antigen recognition and presentation in periapical tissues: a role for TLR expressing cells?[J]. Int Endod J, 2011, 44(2):87-99.
[8]Stashenko P, Teles R, D’Souza R. Periapical inflammatory responses and their modulation[J]. Crit Rev Oral Biol Med, 1998, 9 (4):498-521.
[9]Akira S, Takeda K, Kaisho T. Toll-like receptors: critical proteins linking innate and acquired immunity[J]. Nat Immunol, 2001, 2(8):675-680.
[10]Shelburne CP, Abraham SN. The mast cell in innate and adaptive immunity[J]. Adv Exp Med Biol, 2011, 716:162-185.
[11]Dawicki W, Marshall JS. New and emerging roles for mast cells in host defence[J]. Curr Opin Immunol, 2007, 19 (1):31-38.
[12]Pietrzak A, Wierzbicki M, Wiktorska M, et al. Surface TLR2 and TLR4 expression on mature rat mast cells can be affected by some bacterial components and proinflammatory cytokines[J]. Mediators Inflamm, 2011, 2011:427473.
[13]Avila M, Gonzalez-Espinosa C. Signaling through Toll-like receptor 4 and mast cell-dependent innate immunity responses[J]. IUBMB Life, 2011, 63(10):873-880.
[15]Stenger S, Engele M, Bölcskei PL, et al. Induction of direct antimicrobial activity through mammalian Toll-like receptors[J]. Pneumologie, 2002, 56(2):103-107.
[16]Lee CC, Avalos AM, Ploegh HL. Accessory molecules for Toll-like receptors and their function[J]. Nat Rev Immunol, 2012, 12(3):168-179.
[17]Uematsu S, Akira S. Toll-like receptors and innate immunity[J]. J Mol Med (Berl), 2006, 84(9):712-725.
[18]Horst OV, Tompkins KA, Coats SR, et al. TGF-β1 inhibits TLR-mediated odontoblast responses to oral bacteria[J]. J Dent Res, 2009, 88(4):333-338.
[19]Komai-Koma M, Jones L, Ogg GS, et al. TLR2 is expressed on activated T cells as a costimulatory receptor[J]. Proc Natl Acad Sci U S A, 2004, 101(9):3029-3034.
[20]Georgel P, Jiang Z, Kunz S, et al. Vesicular stomatitis virus glycoprotein G activates a specific antiviral Toll-like receptor 4-dependent pathway[J]. Virology, 2007, 362 (2):304-313.
[21]Ushio H, Nakao A, Supajatura V, et al. MD-2 is required for the full responsiveness of mast cells to LPS but not to PGN[J]. Biochem Biophys Res Commun, 2004, 323 (2):491-498.
[22]Vosskuhl K, Greten TF, Manns MP, et al. Lipopolysaccharide-mediated mast cell activation induces IFN-gamma secretion by NK cells[J]. J Immunol, 2010, 185(1):119-125.
(责任编辑: 卢萍, 罗森)
Expression of TLR2 and TLR4 on mast cells in human chronic periapical diseases
TAO Zi-xi, FAN Wan-ting, LI Juan, HUANG Shi-guang
(FacultyofDentistry,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:thshg@126.com)
[ABSTRACT]AIM: To observe the expression of TLR2 and TLR4 on mast cells (MCs) in the periapical tissues from different types of human chronic periapical diseases, and to analyze the role of TLR2 and TLR4 on tryptase-positive MCs in the immunopathogenesis of human chronic periapical diseases. METHODS: A total of 60 donors, including healthy control group, periapical granuloma group and periapical cyst group, were enrolled in the study. The periapical tissue specimens were fixed in 10% buffered formalin and stained with hematoxylin and eosin for histopathology, or stained with double-immunofluorescence for identification of TLR2-tryptase and TLR4-tryptase double-positive MCs in the periapical tissues. RESULTS: Compared with the healthy control, the densities of TLR2-tryptase and TLR4-tryptase double-positive MCs in periapical tissues were significantly increased in human chronic periapical diseases (P<0.01). The densities of TLR2-tryptase and TLR4-tryptase double-positive MCs in periapical cyst group were significantly higher than those in periapical granuloma group (P<0.01). CONCLUSION: TLR2 and TLR4 were expressed on the MCs in the periapical tissues of human chronic periapical diseases. TLR2-tryptase and TLR4-tryptase double-positive MCs may participate in the pathogenesis of chronic periapical diseases.
[KEY WORDS]Chronic periapical diseases; Mast cells; Toll-like receptor 2; Toll-like receptor 4
doi:10.3969/j.issn.1000- 4718.2016.03.021
[中图分类号]R781
[文献标志码]A
通讯作者△Tel: 020-85221165; E-mail: thshg@126.com
*[基金项目]广东省社会发展领域科技计划 (No. 2013B021800043; No. 2014A020212212)
[收稿日期]2015- 08- 31[修回日期] 2015- 09- 30
[文章编号]1000- 4718(2016)03- 0516- 06
杂志网址: http://www.cjpp.net
▲并列第1作者

