小鼠腹腔及骨髓源性肥大细胞的培养与鉴定
邵亦心 王朵勤 沈燕芸 朱奕锜 徐金华 唐慧
200040上海,复旦大学附属华山医院皮肤科
肥大细胞作为固有免疫细胞之一,广泛分布于皮肤、呼吸道、消化道黏膜等外界屏障组织,通过IgE依赖及非IgE依赖性途径释放各种致敏介质、细胞因子,参与免疫调节和炎症反应,在过敏性、感染性、炎症性及免疫性疾病中发挥重要作用[1]。目前常用的肥大细胞株,包括人肥大细胞系HMC⁃1、LAD2,大鼠嗜碱性粒细胞来源的RBL2H3,小鼠肥大细胞系P815等,都不同程度地缺乏成熟肥大细胞的功能与特性,如HMC⁃1细胞IgE高亲和力受体(FcεRⅠ)表达水平低,LAD2细胞培养成本高、周期长,一些细胞因子表达水平较低等[2]。因此原代培养高纯度的哺乳动物肥大细胞将成为研究肥大细胞生物学特性及功能的有效手段。本研究旨在通过简单方法分别对小鼠腹腔及骨髓细胞进行白细胞介素3(IL⁃3)和干细胞因子(SCF)联合诱导培养,以获得大量高纯度肥大细胞,并鉴定其脱颗粒功能,为相关疾病免疫机制及治疗后续研究奠定细胞学基础。
材料与方法
一、材料
1.实验动物:雌性C57BL/6小鼠12只,6~8周龄,SPF级,体重18~22 g,健康状态良好,来自上海灵畅生物科技有限公司,许可证号SCXK(沪)2013⁃0018,合格证号2013001816972。
2.主要试剂:小鼠重组IL⁃3和SCF来自美国Peprotech公司,RPMI1640培养基、胎牛血清来自美国Gibco公司,藻红蛋白(PE)⁃CD117、异硫氰酸荧光素(FITC)-FcεRⅠα来自美国eBioscience公司,4-硝基苯-N-乙酰基-β-D-氨基葡萄糖苷来自美国Sigma公司。
二、方法
1.小鼠腹腔源性肥大细胞(peritoneal⁃derived mastcells,PMC)分离培养:脱颈椎处死小鼠后,无菌环境下对小鼠腹腔穿刺,注入5Ml无菌PBS,按摩腹部1min,沿腹中线剪开皮肤,暴露腹膜,小心抽出腹腔灌洗液(如出现血管破裂需裂解红细胞),离心弃上清液,调整细胞密度至5×105/ml加入到培养体系中(含RPMI 1640培养基、10%胎牛血清、青霉素100 U/Ml、链霉素100mg/L、小鼠重组IL⁃3和SCF各20μg/L),接种于培养板,37℃、5%CO2培养箱内培养,每7天收集悬浮细胞转移至新培养板中培养,在培养第2周时收集部分细胞,对其进行形态及功能鉴定,其他细胞继续培养直至开始凋亡。
2.小鼠骨髓源性肥大细胞(bone marrow⁃derivedmast cells,BMMC)分离培养:脱颈椎处死小鼠后,无菌环境下分离小鼠双侧股骨,尽量剔除肌肉组织,剪断两端骨骺,用1Ml注射器吸取RPMI1640培养基,反复冲洗骨髓腔收集细胞悬液,100μm细胞滤网过滤后离心,弃上清液,调整细胞密度至1×106/Ml加入到培养体系中(含RPMI 1640培养基、10%胎牛血清、青霉素100 U/Ml、链霉素100mg/L、小鼠重组IL⁃3和SCF各10μg/L),接种于培养板,37℃、5%CO2培养箱内培养,每7天收集悬浮细胞转移至新的培养板中培养,在培养第4周时收集部分细胞,对其进行形态及功能鉴定,其他细胞继续培养直至开始凋亡。
3.肥大细胞鉴定:
(1)甲苯胺蓝染色:将培养2周的PMC及培养4周的BMMC滴到多聚赖氨酸包被的载玻片上,风干,加入1%pH7.4的甲苯胺蓝染液静置约30 s,用95%乙醇分色,三蒸水洗涤,光镜下观察。
(2)流式细胞仪检测:分别收集培养2周的PMC及培养4周的BMMC,PBS洗2次,调整细胞密度至1× 106/ml,每管取100μl,单染管分别加入0.5μl PE⁃CD117及0.2 μl FITC⁃FcεRⅠα,双染管同时加入两种抗体,空白管不加抗体,4℃避光孵育30min,PBS洗2次,上机检测。
4.脱颗粒功能检测:
(1)肥大细胞脱颗粒率测定:将培养2周的PMC及培养4周的BMMC以5×105/ml铺于12孔板(1ml/孔),分别加入0(空白对照)、1、10、100、1 000 mg/L的Compound48/80刺激1 h,收集细胞悬液进行甲苯胺蓝染色,每张玻片镜下计数1 000个肥大细胞。肥大细胞脱颗粒率=脱颗粒肥大细胞数/肥大细胞总数×100%
(2)肥大细胞β己糖胺酶释放率测定:将培养2周的PMC及培养4周的BMMC以5×105/Ml铺于12孔板(1 ml/孔),分别加入0(空白对照)、10、100mg/LCompound48/80刺激1 h,离心,分别收集细胞沉淀及上清液。将上清液转入96孔板,80μl/孔,每孔加入80μl反应缓冲液(含40mmol/L柠檬酸,2mmol/L 4-硝基苯-N-乙酰基-β-D-氨基葡萄糖,pH4.5)37℃孵育 1.5 h,加入 60μl终止反应液(0.4mol/L甘氨酸,pH10.7),立即于405 nm处测量吸光度(A值)。用1Ml裂解液(含0.5%Triton X⁃100)冰浴裂解细胞沉淀10min,离心取上清液,其余步骤和上清液处理方式相同。β己糖胺酶释放率=上清液A405值/(上清液A405值+胞内A405值)×100%。
5.统计学分析:用GraphPad软件对所得数据进行统计分析,数据用x±s表示,两组间比较采用独立样本t检验,多组间均数比较采用单因素方差分析,组间两两比较采用SNK⁃q检验。P<0.05为差异有统计学意义。
结 果
一、细胞形态学观察
PMC培养24 h及BMMC培养48 h时出现贴壁细胞,呈梭形及类圆形,可见大小不等悬浮细胞。随培养时间延长,悬浮细胞逐渐增多,贴壁细胞逐渐减少。PMC培养2周及BMMC培养4周时贴壁细胞基本消失,悬浮细胞形态、大小、分布趋于一致且折光性良好,表现为大小相近、向中央聚集的类圆形细胞,高倍镜下可见胞膜上丝状突起,偶可见处于自发脱颗粒状态的不规则细胞。一般于培养10周后细胞开始凋亡。见图1。
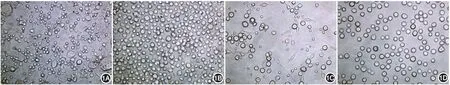
图1 光镜下不同诱导时期肥大细胞形态(×400) 1A:小鼠骨髓源性肥大细胞(BMMC)培养第7天,细胞大小形态不一,存在较多贴壁细胞;1B:BMMC培养第4周,贴壁细胞消失,可见大小形态相近的类圆形悬浮细胞;1C:小鼠腹腔源性肥大细胞(PMC)培养第3天,可见类圆形悬浮细胞及梭形贴壁细胞;1D:PMC培养第2周,贴壁细胞消失,悬浮细胞大小形态趋于一致
二、肥大细胞成熟度
对培养2周的PMC及培养4周的BMMC行甲苯胺蓝染色,可见细胞核呈蓝色,胞质内含紫红色异染颗粒的细胞数达95%以上,证实所获得的细胞为成熟肥大细胞(图2)。
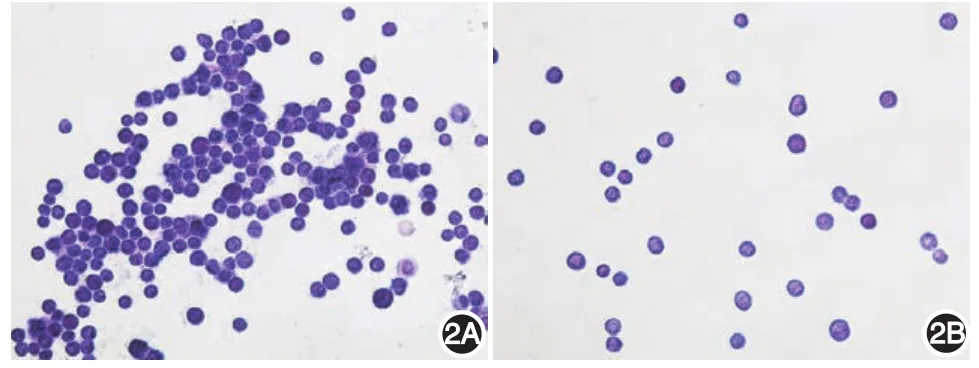
图2 肥大细胞甲苯胺蓝染色(×400)
三、肥大细胞表面CD117及FcεRⅠα分子表达
培养2周的PMC(n=8)及培养4周的BMMC(n=12)CD117单阳性率分别为97.00%±1.21%及98.43%±0.22%,FcεRⅠα单阳性率分别为98.56%±0.47%及95.86%±0.70%,双阳性率分别为97.68%±0.80%及96.12%±0.76%,两种细胞双阳性率差异无统计学意义(t=1.366,P >0.05)。见图3。
四、肥大细胞脱颗粒率
Compound48/80刺激1 h后,培养2周PMC及培养4周BMMC的脱颗粒率在各组间差异有统计学意义(F=36.382、29.887,均P<0.001)。1、10、100、1 000μg/mlCompound48/80均可增加培养4周BMMC及培养2周PMC脱颗粒率,其中100mg/L和1000mg/L剂量组与空白对照组相比,差异均有统计学意义(P<0.01)。见表1。
五、肥大细胞β己糖胺酶释放率
Compound48/80作用1 h后,培养2周PMC及培养4周BMMC的β己糖胺酶释放率在各组间差异有统计学意义(F=40.013、66.991,均P<0.001)。10mg/L和100mg/LCompound48/80均可增加两种细胞β己糖胺酶释放率,与空白对照组比较,100mg/L剂量组BMMC(P < 0.000 1)以及10mg/L、100mg/L剂量组PMC(P <0.05、0.000 1)β己糖胺酶释放率显著升高,差异有统计学意义(表2)。
讨 论
肥大细胞起源于骨髓造血干细胞,迁移至组织定植前为未成熟状态,组织环境是其分化成熟的必要条件。根据定居组织位置不同,肥大细胞分为结缔组织型肥大细胞和黏膜型肥大细胞。不同类型肥大细胞的生物学特性及功能不尽相同[3⁃4]。肥大细胞是荨麻疹、血管性水肿等皮肤病发病的中心环节,在肥大细胞增生症、特应性皮炎、银屑病、类天疱疮、皮肤念珠菌病等多种皮肤病中也发挥重要作用。由于人原代肥大细胞培养仍是难题,获得不同类型鼠源肥大细胞将有助于深入研究肥大细胞在这些皮肤病中的发病机制,并对其治疗提供新的选择。本文介绍了小鼠骨髓与腹腔来源肥大细胞的原代培养方法。该方法克服了密度梯度离心法、磁珠分离法、流式分选法等传统方法获得的细胞数量少、纯度低、成本高的缺陷[5],分别由未成熟肥大细胞前体和结缔组织型肥大细胞诱导分化增殖,在较短时间内可获得大量两种不同类型高纯度成熟肥大细胞。肥大细胞在培养时呈悬浮生长,我们在原代培养过程中通过不断传代,逐渐剔除贴壁细胞,由于PMC及BMMC分别在培养2周及4周时,贴壁细胞基本消失,故选择该时间节点收集悬浮细胞进行后续鉴定。
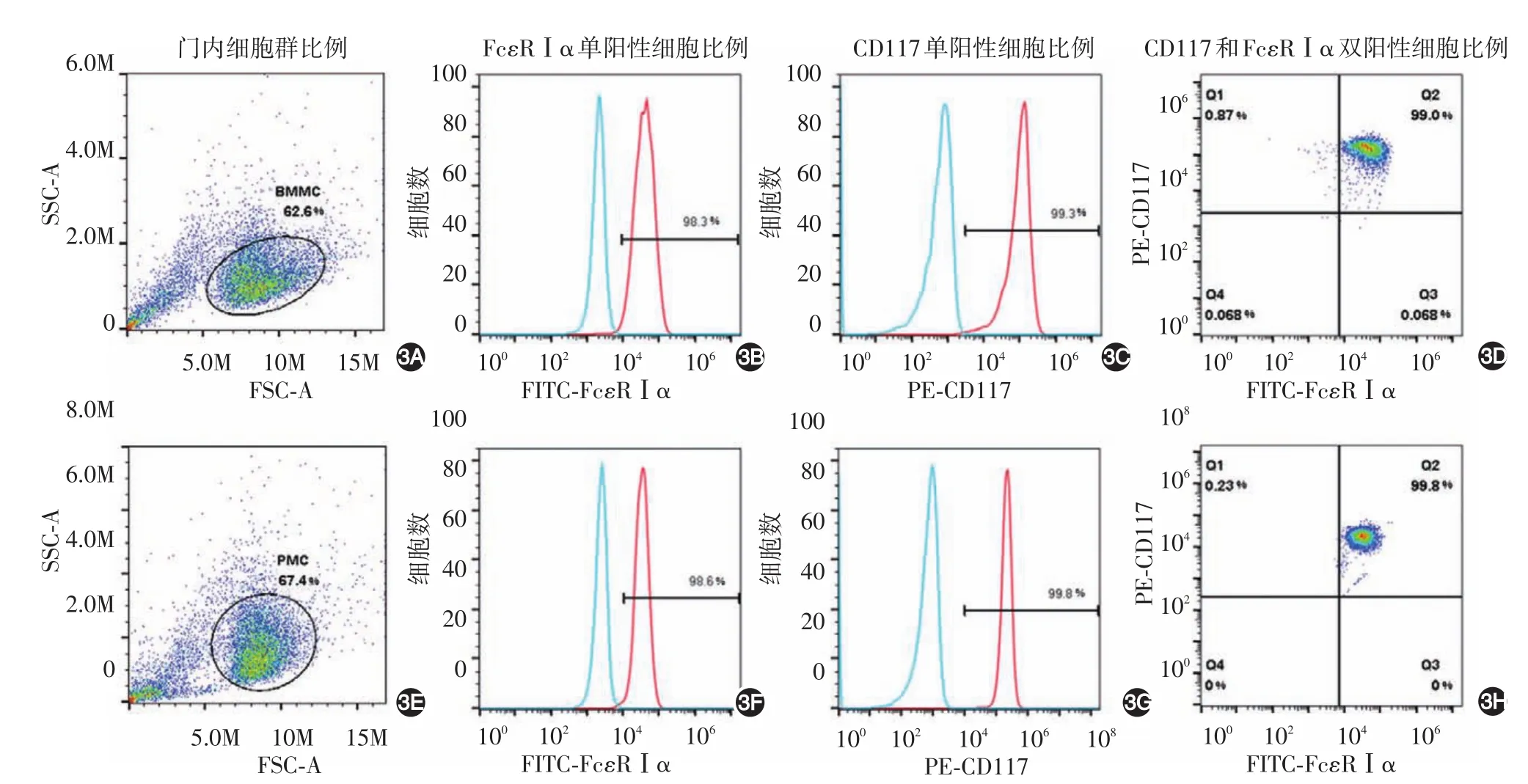
图3 流式细胞仪检测肥大细胞表面CD117及FcεRⅠα分子表达 3A~3D:培养4周小鼠骨髓源性肥大细胞;3E~3H:培养2周腹腔源性肥大细胞
表1 不同浓度Compound48/80刺激对PMMC及PMC脱颗粒率的影响(%±s)

表1 不同浓度Compound48/80刺激对PMMC及PMC脱颗粒率的影响(%±s)
注:n=6。与空白对照组比较,a P<0.01,b P<0.001,c P<0.000 1。BMMC:小鼠骨髓源性肥大细胞,PMC:小鼠腹腔源性肥大细胞
Compound48/80浓度0(空白对照组)1mg/L 10mg/L 100mg/L 1 000mg/L F值P值4周BMMC 14.33±8.25 21.33±9.26 36.67±6.12 84.00±5.57a 93.67±0.88b 29.887<0.001 2周PMC 12.60±4.71 24.40±5.99 31.40±7.74 74.00±5.30c 89.20±2.60c 36.382<0.001
表2 不同浓度Compound48/80刺激对PMMC及PMC β己糖胺酶释放率的影响(%±s)
注:n=6。与空白对照组比较,a P<0.05,b P<0.000 1。BMMC:小鼠骨髓源性肥大细胞,PMC:小鼠腹腔源性肥大细胞
Compound48/80浓度0(空白对照组)10mg/L 100mg/L F值P值4周BMMC 15.56±2.79 19.42±3.93 64.32±3.11b 66.991<0.001 2周PMC 13.89±2.70 30.96±5.01a 59.54±2.73b 40.013<0.001
IL⁃3又称多集落刺激因子或肥大细胞生长因子,被认为是调节肥大细胞生长、分化、迁移和效应的重要细胞因子。它主要由活化T细胞、天然杀伤(NK)细胞和肥大细胞产生,并且支持SCF对肥大细胞前体的生长、分化、扩增的促进作用[6⁃7]。CD117(c⁃kit)是SCF的配体,除存在于肥大细胞表面外,还广泛表达于各种造血祖细胞、淋巴祖细胞、黑素细胞、某些干细胞等。成熟肥大细胞表达大量高亲和力IgE受体FcεRⅠα,驱动IgE介导速发型变态反应。但FcεRⅠα还表达于嗜酸性粒细胞、嗜碱性粒细胞、朗格汉斯细胞等表面,只有肥大细胞同时表达CD117和FcεRⅠα[8]。成熟肥大细胞胞质内充满强嗜碱性颗粒,颗粒内含有组胺、5羟色胺、肝素等介质。甲苯胺蓝可使组胺、肝素等物质呈异染性紫红色,细胞核呈蓝色,因此常用于肥大细胞的识别和鉴定[9]。故本研究通过甲苯胺蓝染色及细胞表面CD117和FcεRⅠα的表达鉴定来评估肥大细胞纯度和成熟度,结果显示IL⁃3和SCF诱导培养2周及4周后小鼠腹腔及骨髓来源肥大细胞甲苯胺蓝染色阳性率及共表达CD117和FcεRⅠα的比例均达到95%以上,且PMC和BMMC同时表达CD117和FcεRⅠα的双阳性率差异无统计学意义。
肥大细胞脱颗粒是肥大细胞区别于其他细胞的一种特异性功能状态,在速发型变态反应中是肥大细胞活化的重要标志,因此有必要对诱导培养获得的小鼠骨髓及腹腔来源肥大细胞进行脱颗粒功能评估。Compound48/80是一种常用促肥大细胞脱颗粒人工合成化合物[10]。组胺、类胰蛋白酶、β己糖胺酶常被用作定量测定肥大细胞脱颗粒水平的生物标志物。组胺由于相对分子质量小、无免疫原性、生理状态下半衰期短,较类胰蛋白酶及β己糖胺酶检测结果重复性差[11⁃12]。本研究利用镜下计数肥大细胞脱颗粒率及定量测定β己糖胺酶释放率两种方法,检测不同浓度Compound48/80刺激后小鼠骨髓及腹腔来源肥大细胞的脱颗粒水平,结果显示,Compound48/80可促进培养2周PMC及培养4周BMMC脱颗粒。与培养4周BMMC相比,较低浓度Compound48/80即可使培养2周的PMCβ己糖胺酶释放率显著提高,提示培养2周PMC较培养4周BMMC对Compound48/80更敏感。这一结论需要进一步测定肥大细胞脱颗粒的其他代表性生物标志物加以验证。
综上,本研究通过形态学及功能学两方面鉴定诱导培养的小鼠腹腔及骨髓来源肥大细胞,证实获得细胞具有成熟肥大细胞的生物学特性及功能,使后续基础及临床研究成为可能。

