葡萄糖-6-磷酸异构酶混合肽段诱导的DBA/1小鼠类风湿性关节炎模型的建立*
张雪娇, 刘嘉琳,2, 杨 飞, 娄永富, 王 强, 陈冬志, 孟 明△
(1河北大学医学部,河北 保定 071000; 2中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
葡萄糖-6-磷酸异构酶混合肽段诱导的DBA/1小鼠类风湿性关节炎模型的建立*
张雪娇1,刘嘉琳1,2,杨飞1,娄永富1,王强1,陈冬志1,孟明1△
(1河北大学医学部,河北 保定 071000;2中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
[摘要]目的: 利用葡萄糖-6-磷酸异构酶(GPI)单一肽段及混合多肽片段免疫DBA/1小鼠,建立类风湿性关节炎(RA)模型,分析其主要评价指标及特点,为探讨RA的免疫机制及治疗提供新的理想动物模型。方法: hGPI325-339、hGPI469-483多肽片段和hGPI325-339单一肽段分别与完全弗氏佐剂充分乳化后,于小鼠尾根部皮下注射进行造模,并从体重变化、足踝关节症状评分、足踝关节病理改变、外周血及脾组织CD4+T细胞的表达、外周血iNKT细胞比例以及血清TNF-α和IL-6水平等方面进行模型鉴定及分析。结果: 模型小鼠在造模第8 天,后爪最先出现红肿,逐渐加重累及四肢,第14 天红肿达到高峰,足踝肿胀,行动不利,此后开始逐渐缓解;组织形态学观察发现足踝关节有炎症细胞浸润,以单核细胞与淋巴细胞为主,浆细胞少量出现,混合肽段的炎症状况明显强于单肽片段。与健康对照组和单肽片段模型组相比,混合肽段模型组体重增长缓慢;外周血、脾脏CD4+T细胞数量明显增多;炎症高峰期外周血iNKT细胞比例下降明显(P<0.05),血清中TNF-α水平显著升高(P<0.05)。结论: 混合GPI肽段诱导的RA模型小鼠在免疫学特征,特别是iNKT细胞免疫病理方面与RA患者尤为接近,可作为RA免疫机制研究和治疗的良好工具。
[关键词]DBA/1小鼠; 葡萄糖-6-磷酸异构酶; 类风湿性关节炎; iNKT细胞
类风湿性关节炎(rheumatoid arthritis,RA)是一种病因复杂的慢性自身免疫性疾病,以慢性、进行性、侵袭性为特点,具有高患病率、高致残率,严重影响患者生活质量[1],发病机制尚未完全阐明,且缺乏特效药物和治疗方法。近年发现恒定自然杀伤T细胞(invariant nature killer T cells,iNKT细胞)是T细胞的一个亚群,表达CD4+膜分子,具有调控炎性因子释放的功能,与RA发病密切相关。通过研究iNKT细胞在RA中的作用机制,有可能发现RA治疗的新靶标。
理想动物模型的建立对于RA发病机制研究和治疗具有重要意义。目前应用广泛且较成熟的整体动物模型有胶原诱导性关节炎、佐剂性关节炎、酵母多糖诱导的关节炎、多聚糖蛋白诱导的关节炎等十几种[2-4],但尚无一种模型可以完全模拟人RA的所有特征。根据研究目的构建合理的动物模型显得尤为重要。葡萄糖-6-磷酸异构酶(glucose-6-phosphate isomerase,GPI)被认为是广泛应用于RA诊断及判断活动性的一个检测指标,利用重组人的GPI作为抗原可诱导小鼠发生与人RA病变特点相似的关节炎症[5]。相比胶原诱导性关节炎 (collagen-induced arthritis,CIA)模型,在对CD4+T细胞的依赖性和对生物制剂反应性方面,GPI诱导的关节炎更加接近人RA特点[6]。Lisa 等[7]报道GPI325-339和GPI469-483作为GPI的活性肽片段,可诱导DBA/1小鼠RA的发生,但单一肽段的诱导效果不如整个GPI蛋白。根据结构免疫学,不同肽段有不同的作用靶点,由此推测GPI325-339和GPI469-483可能通过结合不同的靶点参与RA的病理发生。在本实验中,我们使用hGPI325-339和hGPI469-483的混合多肽片段以及hGPI325-339单一肽段分别免疫DBA/1小鼠,并从体重变化、足踝关节症状评分、足踝关节病理改变、外周血及脾组织CD4+T细胞的表达、外周血iNKT细胞比例以及血清中细胞因子TNF-α和IL-6水平等多方面进行模型鉴定及特点分析,为深入RA的免疫病理研究奠定基础。
材料和方法
1动物
DBA/1小鼠45只,雄性,8周龄,体重(20±1) g,购自北京华阜康生物科技股份有限公司,许可证号为SCXK(京)2014-0004,SPF级饲养。
2主要试剂与仪器
多肽片段hGPI325-339(IWYINCFGCETHAML)和hGPI469-483(EGNRPTNSIVFTKLT)由北京赛百盛基因技术有限公司合成;百日咳毒素(P7208)和完全弗氏佐剂(complete Freund′s adjuvant,CFA)购自Sigma;兔抗鼠CD4抗体购自Santa Cruz;生物素-链霉卵白素免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司;PerCP标记的CD3抗体、FITC标记的CD4抗体、微量样本多指标流式蛋白定量技术(CBA)Th1/Th2/Th17细胞因子检测试剂盒和红细胞裂解液购自BD;PE标记的T-selected CD1d Tetramer购自MBL;α-半乳糖神经鞘胺醇(α-galactosylceramide,α-GalCer)购自ENZO;荧光倒置显微镜(Olympus);流式细胞仪Calibur和Accuri C6购自BD。
3主要方法
3.1小鼠分组DBA/1小鼠适应性饲养1周后,随机取出15只作为健康对照组;15只小鼠进行混合肽段人工造模,为混合肽段模型组:hGPI325-339和hGPI469-483多肽片段混合溶于预冷三蒸水中(每75 μL水中溶解50 μg混合多肽),溶解后的多肽与CFA等体积混合,充分乳化为乳化剂,每只150 μL于小鼠尾根部多点皮下注射,当天及48 h腹腔注射百日咳毒素(每只200 ng)加强免疫;剩下15只用hGPI325-339单一肽段同样方法造模,为单一肽段模型组。
3.2小鼠体重及关节情况评估造模后,每隔4 d称量小鼠体重,监测小鼠体重动态变化。每天观察小鼠的一般状况及足踝红肿程度,并进行系统评分。对小鼠每个关节和足踝发红肿胀程度进行量化,其评分标准为:0分,正常,表示无红肿现象;1分,足趾有轻度红肿;2分,有明显可见的足背和足掌红肿;3分,足踝红肿,爪子各个部位均有肿胀。依此分别观察小鼠四肢情况,所得分数累加即为此小鼠关节情况评分。
3.3流式细胞术检测CD3+CD4+T细胞比例于造模后第8 天小鼠眼球取血,收集每只小鼠全血120 μL,各BSA 500 μL阻断,然后加入PerCP标记的CD3抗体(1∶100)和FITC标记的CD4抗体(1∶100)各2 μL,4 ℃避光孵育20 min。之后加红细胞裂解液1 mL,避光8 min,离心弃上清,用PBS 1 mL洗涤,最后重悬,加PBS定容至500 μL,用流式细胞仪Calibur上机检测,FlowJo软件(树星公司)进行数据分析。
3.4小鼠组织取材造模后第8、14和37 天取小鼠眼球血,断颈椎处死后置于75% 乙醇中消毒3 min,解剖剪剪下鼠爪。然后将小鼠仰卧位置于解剖盘上,打开腹腔,取出脾组织。关节组织和脾组织用75%乙醇冲洗后置于4%甲醛溶液中固定备用。
3.5小鼠关节组织HE染色足踝关节组织冲洗干净,进行脱水、透明、石蜡包埋切片(5 μm)。然后用二甲苯(Ⅰ、Ⅱ)脱蜡,梯度乙醇水化,蒸馏水洗。然后苏木素染色15 min,水洗,1%盐酸乙醇分化数秒,自来水返蓝15 min,水洗,1%乙醇伊红染色3 min。最后梯度乙醇脱水,二甲苯透明,中性树胶封固,于显微镜下观察。
3.6小鼠脾组织免疫组化染色脾组织常规石蜡包埋切片(4 μm),脱蜡、水化后,蒸馏水洗,0.3%甲醇双氧水封闭内源性过氧化物酶,微波加热抗原修复,滴加血清封闭液孵育30 min,滴加anti-CD4抗体(1∶200),4 ℃过夜。次日,先后滴加生物素Ⅱ抗和辣根酶标记链酶卵白素工作液,37 ℃孵育20 min,PBS洗,DAB显色剂显色,自来水终止。苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,于显微镜下观察。细胞膜呈棕黄色颗粒状为阳性。
3.7流式细胞术检测iNKT细胞比例收集各组小鼠各期全血(每只120 μL)置于流式管,BSA阻断后加入PE标记的负载 α-GalCer的CD1d四聚体(α-GalCer用0.5%Tween-20和0.9% NaCl稀释至200 mg/L,5 μL的α-GalCer加入100 μL CD1d Tetramer中,室温孵育12 h),FITC标记的anti-CD4各2 μL,4 ℃避光孵育20 min。然后加红细胞裂解液1 mL,避光8 min,观察澄清透亮后离心弃上清,PBS重复洗涤2次,重悬,加PBS定容500 μL,用流式细胞仪Calibur上机检测,FlowJo软件进行数据分析。
3.8CBA检测细胞因子收集第8、14和37天各组小鼠全血中的血清,应用CBA 细胞因子试剂盒检测TNF-α和IL-6水平。梯度稀释标准品,稀释倍数分别为1∶256、1∶128、1∶64、1∶32、1∶16、1∶8、1∶4、1∶2、1∶1。依不同浓度标准品所形成的标准曲线作为质控指标。混合捕获微球,每个实验管中加入50 μL捕获微球,每个标准品管中加入50 μL梯度稀释好的标准品,每个样本管中加入50 μL样本,然后所有管中加入50 μL PE检测试剂,室温避光孵育2 h,然后每管加入1 mL洗液,200×g离心5 min,弃上清后,每管加300 μL洗液,重悬,流式细胞仪Accuri C6上机检测前进行质控,保证机器的可靠性。FCAP软件(BD)进行数据分析。
4统计学处理
利用SPSS 17.0软件进行数据分析,采用均数±标准差(mean±SD)表示,组间差异比较采用单因素方差分析,进一步两两比较采用SNK-q检验,以P<0.05表示差异有统计学意义。
结果
1各组小鼠体重的动态变化
与健康对照组相比,RA小鼠体重增长缓慢,特别是在炎症高峰阶段呈现零增长或负增长,在炎症转入缓解期后,体重开始缓慢增长。健康对照组小鼠平均体重为(22.64±0.18) g,单一肽段组RA小鼠的平均体重为(22.19±0.15) g,混合肽段组小鼠的平均体重为(22.03±0.24) g。模型小鼠与健康对照组小鼠比较,差异有统计学显著性(P<0.05),第37天混合肽段组与单一肽段组模型小鼠的体重相比,差异有统计学显著性(P<0.05),见图1。

Figure 1.The change of body weight of the RA mice. The area under the curve was used to indicate the relative diffe-rence. DBA1 mice were immunized with GPI peptides. Mean±SD.n=15.*P<0.05vshGPI325-339;#P<0.05vscontrol.
图1各组小鼠体重动态变化
2RA小鼠足踝关节红肿的观察
模型小鼠在造模的第8 天即开始出现关节红肿,后爪最先受累,开始仅表现为一个或几个足趾出现红肿,而后红肿逐渐加重;在造模的第14 天,小鼠多关节红肿,且有足掌甚至足踝的肿胀,后爪重于前爪,此时关节发红肿胀程度最为严重,此后关节肿胀程度逐渐缓解。统计学分析关节肿胀评分,模型小鼠与健康对照组相比差异有统计学显著性(P<0.05),在炎症高峰期混合肽段组比单一肽段组小鼠关节红肿更严重(P<0.05),见图2。

Figure 2.Swelling of the joints and clinical scores at different time points in RA mice.Mean±SD.n=15.*P<0.05vshGPI325-339;#P<0.05vscontrol.
图2各组小鼠不同时点关节红肿情况和评分
3小鼠外周血中CD3+CD4+T细胞比例
造模第8天,健康对照组外周血的CD3+CD4+T细胞频率均值为(5.24±0.36)%,单一肽段模型小鼠外周血的CD3+CD4+T细胞频率均值为(15.98±1.06)%,而混合肽段模型小鼠的CD3+CD4+T细胞频率为(17.76±0.22)%。混合肽段模型小鼠的CD3+CD4+T细胞频率与健康对照组、单一肽段模型小鼠相比,差异有统计学显著性(P<0.05),见图3。
4RA小鼠足踝关节炎细胞的浸润情况
模型小鼠足踝关节的骨与骨之间、骨与上皮之间的滑膜下疏松结缔组织可见炎性细胞包括淋巴细胞、单核细胞和浆细胞的浸润,关节腔变窄,并且有与人RA相似的血管翳形成,混合肽段与单一肽段模型相比炎性细胞数量相对较多,见图4。混合肽段模型小鼠不同时期浸润的炎性细胞不同:造模第8天可见淋巴细胞、单核细胞存在;在造模第14天以淋巴细胞为主,也可见少量浆细胞;造模第37天各类炎性细胞数量明显减少,伴大量纤维结缔组织增生,见图5。
5RA小鼠脾组织的病理变化
健康对照组脾组织中CD4+T细胞数量较少,而模型组小鼠脾组织中CD4+T细胞数量明显升高(P<0.05),各组之间比较差异有统计学显著性(P<0.05),见图6。
6小鼠外周血的iNKT细胞比例
健康对照组的iNKT细胞比例为(0.39±0.03)%;单一肽段模型小鼠的比例为(0.17±0.07)%,混合肽段模型小鼠的比例为(0.11±0.02)%,造模第8天的iNKT细胞比例为(0.20±0.04)%,第14 天为(0.04±0.13)%,第37天为(0.22±0.34)%。第14天混合肽段模型小鼠的iNKT细胞比例显著下降,与其它组相比差异有统计学显著性(P<0.05),见图7。

Figure 3.The proportion of CD3+CD4+T cells in peripheral blood of RA mice on the 8th day.Mean±SD.n=5.*P<0.05vscontrol.
图3第8天各组小鼠外周血CD3+CD4+T细胞比例
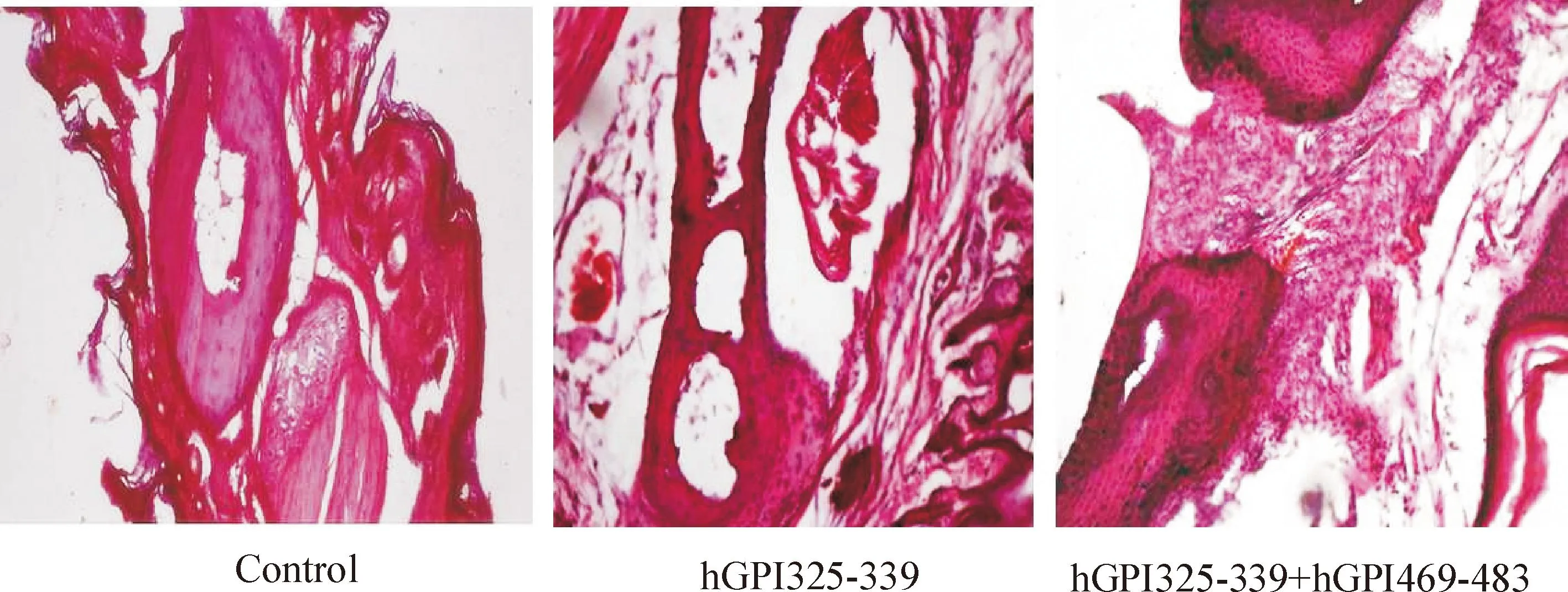
Figure 4.Histopathological changes of the ankle joint in different groups on day 14 (×100).
图4第14天各组小鼠关节组织HE染色对比图

Figure 5.Histopathological changes of the ankle joint in hGPI325-339+hGPI469-483 RA mice (×400).→: monocytes; ↓:lymphocytes; oblique ↓: plasma cells.
图5混合肽段模型组不同时点足踝关节HE染色对比图
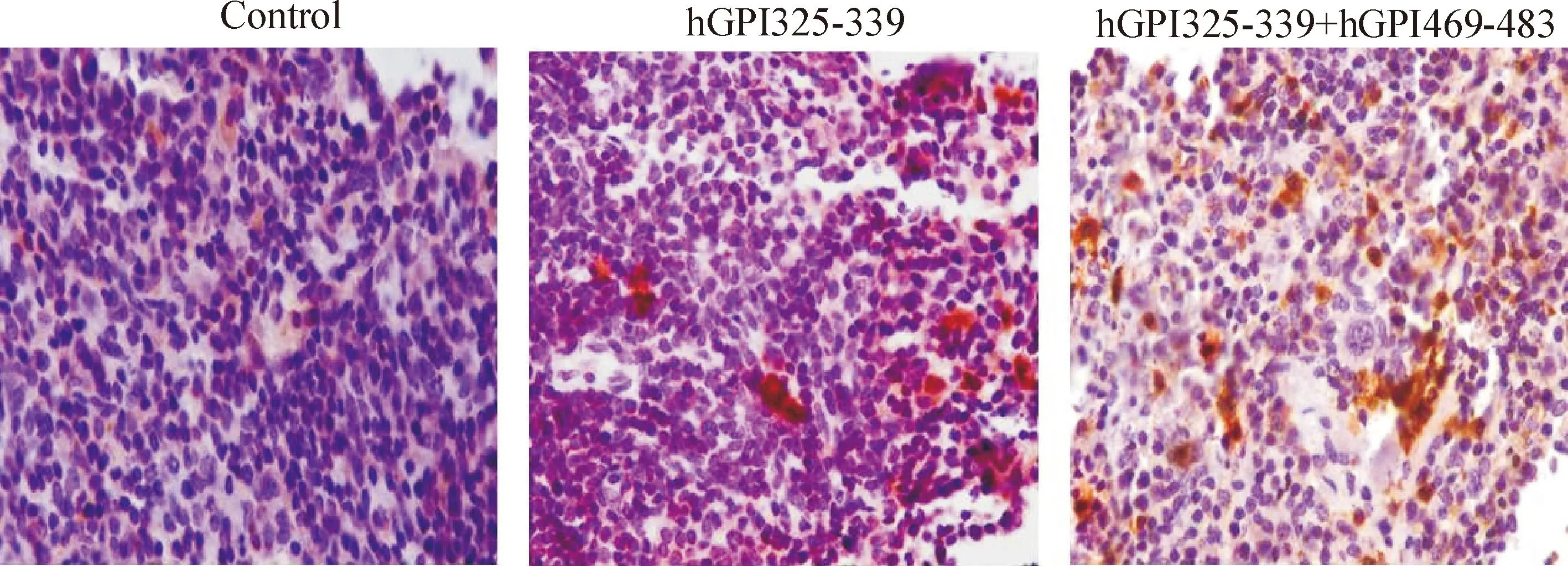
Figure 6.The expression of CD4+T cells in splenic tissue in different groups (×400).
图6各组小鼠脾组织淋巴细胞膜CD4+T细胞表达情况

Figure 7.The proportion of iNKT cells in peripheral blood of RA mice.Mean±SD.n=15.*P<0.05vscontrol.
图7各组小鼠外周血iNKT细胞频率
7RA小鼠血清中细胞因子的变化
检测第8、14和37天小鼠血清中细胞因子TNF-α 和IL-6的水平,发现模型组的TNF-α和IL-6第8天含量上升,在第14天到达最高峰,第37 天含量下降,且第14天时混合肽段模型小鼠的TNF-α水平较单一肽段模型组比较差异有统计学显著性(P<0.05),见图8。
讨论
RA是累及全身大小关节和多器官的自身免疫病,机体的免疫失衡和过度炎症反应是其发病基础:机体自身反应性CD4+T细胞的过度增殖打破了原有细胞间平衡,出现了Th1和Th17亚群过度增殖,Th2和Treg被抑制[8]。iNKT细胞是一群兼具NK细胞功能和T细胞特点的特殊细胞群,通过分泌多种细胞因子和趋化因子,调控CD4+T细胞的分化方向,影响免疫应答的格局,是免疫系统的“瑞士军刀”[9]。研究发现,RA患者体内存在iNKT细胞比例和功能的缺陷[10],外周血中iNKT细胞比例与IFN-γ/IL-4比值呈负相关[11]。
GPI存在于大多数RA患者血清和关节液中,是当前临床RA诊断及判断活动性的一个常用检测指标[12]。Schubert 等[5]用重组人GPI免疫小鼠,小鼠关节肿胀变形,炎细胞浸润,血管翳形成。Bruns等[7]报道GPI325-339和GPI469-483作为GPI的活性片段,均可诱导RA的发生,其致炎率前者高于后者。本研究发现,混合肽段的诱导效果优于单一肽段hGPI325-339,这可能与混合肽段通过多个作用靶点激活免疫应答有关。因此,在本实验中我们以单一肽段hGPI325-339为对照,使用混合多肽片段免疫DBA/1小鼠,结果无论从体重变化、足踝关节症状评分、关节病理改变、外周血及脾组织CD4+T细胞的表达、外周血iNKT细胞比例和血清细胞因子TNF-α、IL-6水平等方面,混合肽段的诱导效果均优于单肽段。混合肽段模型小鼠足踝关节在造模的第8 天出现肿胀,组织病理以单核细胞浸润为主,第14 天炎症到达高峰,伴食欲减退、活动受限、行动不利,组织病理以淋巴细胞为主,偶见浆细胞,进入缓解期后,炎症减轻,炎细胞数量显著减少,大量纤维组织增生,这些均符合RA慢性、以滑膜炎性改变为主的特点。混合肽段模型组外周血和脾组织的CD4+T细胞过度增殖,而iNKT细胞在炎症高峰期明显降低,与RA患者iNKT细胞的改变趋势一致[10],故我们推测,CD4+T细胞在外周血和脾组织的大量增殖,提示体内出现细胞免疫异常,可能是由于多肽抗原刺激了胸腺中CD4+T细胞的成熟,并向外周器官不断迁移,而外周血中iNKT细胞比例和功能的缺陷,一方面可能由于炎症初始阶段iNKT细胞的过度活化导致细胞衰竭;另一方面可能由于体内慢性炎症的刺激使得可以递呈抗原给iNKT细胞的CD1d减少,致使iNKT细胞活化降低,功能缺陷[13]。此外,血清中TNF-α和IL-6含量升高,提示模型小鼠体内存在与RA患者相似的Th1和Th17亚群的极化[8, 14],在抗原和炎症因子的作用下,iNKT细胞不仅自身能迅速释放大量的炎性细胞因子和趋化因子,而且能调控多种免疫细胞(Treg细胞、DC细胞、B细胞和NK细胞等)的分化方向[15],促进以TNF-α为代表的炎性因子的释放,进而影响RA免疫应答格局,但具体iNKT细胞参与RA的发病机制还需进一步探讨。
综上所述,应用hGPI325-339和hGPI469-483混合多肽片段诱导的RA模型,可以模拟人RA体内CD4+T细胞过度增殖和iNKT细胞缺陷等特点,可作为RA细胞免疫研究的理想动物模型。

Figure 8.The serum levels of TNF-α and IL-6 in RA mice. Mean±SD.n=15.*P<0.05vshGPI325-339+hGPI469-483.
图8RA小鼠血清细胞因子TNF-α和IL-6水平
[参考文献]
[1]Lee DM, Weinblatt ME. Rheumatoid arthritis[J]. Lancet, 2001, 358(9285):903-911.
[2]Schurgers E, Billiau A, Matthys P. Collagen-induced arthritis as an animal model for rheumatoid arthritis: focus on interferon-γ[J]. Interferon Cytokine Res, 2011, 31(12):917-926.
[3]Griffiths MM, Remmers EF.Genetic analysis of collagen-induced arthritis in rats: a polygenic model for rheumatoid arthritis predicts a common framework of cross-species inflammatory/autoimmune disease loci[J]. Immunol Rev, 2001, 184(1):172-183.
[4]van Haalen HG, Severens JL, Tran-Duy A, et al. How to select the right cost-effectiveness model?A systematic review and stepwise approach for selecting a transferable health economic evaluation model for rheumatoid arthritis[J]. Pharmacoeconomics, 2014, 32(5):429-442.
[5]Schubert D, Maier B, Morawietz L, et al. Immunization with glucose-6-phosphate isomerase induces T cell-depen-dent peripheral polyarthritis in generally unaltered mice[J]. J Immunol, 2004, 172(7):4503-4509.
[6]Horikoshi M, Goto D, Segawa S, et al. Activation of invariant NKT cells with glycolipid ligand a-galactosylceramide ameliorates glucose-6-phosphate isomerase peptide-induced arthritis[J]. PLoS One, 2012, 7(12):e51215.
[7]Bruns L,Frey O, Morawietz L, et al. Immunization with an immunodominant self-peptide derived from glucose-6-phosphate isomerase induces arthritis in DBA/1 mice[J]. Arthritis Res Ther, 2009, 11(4):R117.
[8]Boissier MC, Assier E, Falgarone G, et al. Shifting the imbalance from Th1/Th2 to Th17/treg: the changing rheumatoid arthritis paradigm[J]. Joint Bone Spine, 2008, 75(4):373-375.
[9]Matsuda JL, Mallevaey T, Scott-Browne J, et al. CD1d-restricted iNKT cells, ′the swiss-army knife′ of the immune system[J]. Curr Opin Immunol, 2008, 20(3): 358-368.
[10]Parietti V, Chifflot H, Sibilia J,et al. Rituximab treatment overcomes reduction of regulatory iNKT cells in patients with rheumatoid arthritis[J]. Clin Immunol,2010,134(3):331-339.
[11]孟明,陈丹,许鸣华,等. RA患者iNKT细胞频率与IFN-γ/IL-4的相关性研究[J]. 中华微生物和免疫学杂志, 2015, 35(3):213-218.
[12]Zong M, Lu T, Fan S, et al. Glucose-6-phosphate isome-rase promotes the proliferation and inhibits the apoptosis in fibroblast-like synoviocytes in rheumatoid arthritis[J]. Arthritis Res Ther, 2015,17:100.
[13]Kojo S, Adachi Y, Keino H, et al. Dysfunction of T cell receptor AV24AJ18+, BV11+ double-negative regulatory natural killer T cells in autoimmune diseases[J]. Arthritis Rheum, 2001, 44(5):1127-1138.
[14]Yoshida Y, Mikami N, Matsushima Y, et al. Functional mechanism(s) of the inhibition of disease progression by combination treatment with fingolimod plus pathogenic antigen in a glucose-6-phosphate isomerase peptide-induced arthritis mouse model[J]. Biol Pharm Bull, 2015, 38(8):1120-1125.
[15]Patel O, Cameron G, Pellicci DG, et al. NKT TCR recognition of CD1d-α-C-galactosylceramide[J]. J Immunol, 2011, 187(9):4705-4713.
(责任编辑: 陈妙玲, 罗森)
Immunization with mixed peptides derived from glucose-6-phosphate isomerase induces rheumatoid arthritis in DBA/1 mice
ZHANG Xue-jiao1, LIU Jia-lin1, 2, YANG Fei1, LOU Yong-fu1, WANG Qiang1, CHEN Dong-zhi1, MENG Ming1
(1HebeiUniversityHealthScienceCenter,Baoding071000,China;2InstituteofLaboratoryAnimalSciences,ChineseAcademyofMedicalSciences,TheComparativeMedicineCenter,PekingUnionMedicalCollege,Beijing100021,China.E-mail:mengming127@163.com)
[ABSTRACT]AIM: To establish an animal model of rheumatoid arthritis (RA) in DBA/1 mice induced by immunodominant mixed peptides derived from glucose-6-phosphate isomerase (GPI). METHODS: The DBA/1 mice were immunized with emulsified mixed peptide fragments of hGPI325-339+hGPI469-483 or single peptide hGPI325-339 in complete Freund′s adjuvant by subcutaneous injection to induce the model of RA. Body weight, ankle joint symptom scores, the pathological change of the ankle joint, the levels of CD4+ T cells in the spleen and peripheral blood, the proportion of iNKT cells in the peripheral blood, and the levels of TNF-α and IL-6 in serum were detected to evaluate and analyze the model. RESULTS: The hind paw of the model mice appeared red swelling on the 8th day, and then aggravated gradually to the limbs. The red swelling reached peak on the 14th day, and then relieved gradually. Inflammation response dominated by lymphocytes and monocytes was observed in the ankle joint. The inflammatory effect of mixed peptides was more obvious than that of the single one (P<0.05). Compared with control group and the mice treated with single peptide, the weight gain was slow, the amount of CD4+ T cells in the peripheral blood and spleen were increased, the proportion of peripheral iNKT cells in the inflammatory peak was decreased (P<0.05), and the serum level of TNF-α was increased significantly (P<0.05) in the mice treated with mixed peptide fragments. CONCLUSION: The immunological characteristics of RA model induced by mixed GPI peptides in DBA/1 mice is closer to that in RA patients, especially in the immunopathology of iNKT cells. Therefore, this model can be used as a new tool for studying the mechanism and immunological intervention of RA.
[KEY WORDS]DBA/1 mice; Glucose-6-phosphate isomerase; Rheumatoid arthritis; iNKT cells
doi:10.3969/j.issn.1000- 4718.2016.03.031
[中图分类号]R363.2; R593.22
[文献标志码]A
通讯作者△Tel: 0312-5079024; E-mail: mengming127@163.com
*[基金项目]国家自然科学基金资助项目(No.81373197);河北省自然科学基金资助项目(No.H2014201133; No.H2015201131);河北大学医学学科建设基金资助项目(No.2014A1001; No.2014A1002);国家级大学生创新项目基金资助项目(No.201510075030);保定市科学技术研究与发展指导计划(No.14ZF003)
[收稿日期]2015- 08- 03[修回日期] 2015- 12- 07
[文章编号]1000- 4718(2016)03- 0569- 08
杂志网址: http://www.cjpp.net
·实验技术·

