慢加急性肝衰竭患者IL-6、IL-10、TNF-α水平变化与肝性脑病的关系
炉 军,何金秋
(南昌市第九医院重症监护室,南昌 330002)
慢加急性肝衰竭患者IL-6、IL-10、TNF-α水平变化与肝性脑病的关系
炉 军,何金秋
(南昌市第九医院重症监护室,南昌 330002)
目的 探讨慢加急性肝衰竭(ACLF)患者血清IL-6、IL-10、TNF-α水平与肝性脑病(HE)的相关性。方法 选择2014年2月以后收治的ACLF患者35例(ACLF组),选择同期收治的ACLF并HE患者40例(ACLF+HE组),均填写临床病例观察表,留取外周血标本。采用酶联免疫吸附法检测2组患者血清IL-6、IL-10、TNF-α及临床生化指标。结果 ACLF+HE组IL-6、TNF-α、血氨水平均高于ACLF组(P<0.05),而2组IL-10水平差异无统计学意义(P>0.05)。ACLF+HE组IL-6、TNF-α均与血氨呈正相关(r=0.635,P<0.01;r=0.462,P<0.05),IL-10水平与血氨无相关性(r=-0.357,P>0.05);ACLF组IL-6、IL-10、TNF-α水平与血氨均无相关性(r=0.281,P=0.102;r=-0.154,P=0.342;r=-0.16,P=0.35)。2组终末期肝病模型(MELD)评分差异无统计学意义(P>0.05),2组IL-6、IL-10、TNF-α水平与MELD评分均呈正相关(ACLF组:r=0.322,P<0.01;r=0.300,P<0.01;r=0.45,P<0.01;ACLF+HE组:r=0.373,P<0.05;r=0.412,P<0.01;r=0.437,P<0.01)。结论IL-6、TNF-α水平可作为慢加急性肝衰竭患者肝性脑病发生的预警因子,IL-6、IL-10、TNF-α水平对慢加急性肝衰竭预后评估有重要意义。
肝功能衰竭; 肝性脑病; 白介素-6; 白介素-10; 肿瘤坏死因子-α; 相关性
慢加急性肝衰竭(ACLF)的发生由多种因素引起,主要表现为严重肝脏损害,包括肝脏病理解剖结构破坏、肝功能衰竭,以致肝脏的合成、解毒、排泄及生物转化等功能发生严重障碍,临床上表现为凝血机制障碍和黄疸、肝性脑病(HE)、腹水等一组临床征侯群[1-2]。我国是ACLF的高发区,主要由乙型肝炎病毒感染引起,其病情重、并发症多、预后差、病死率高[3-4]。其发病机制较复杂,有多种因素共同参与,免疫应答失调、细胞因子表达紊在肝脏损害中起着重要作用。HE是ACLF的常见死亡原因之一,是由严重肝脏功能障碍或失调为基础,以代谢紊乱、精神、神经症状为主要特征的临床综合征[5]。HE的发病机制主要有氨中毒假说、氨基酸比例失衡假说、假神经递质假说等,其中以氨中毒假说研究最为广泛。IL-6、IL-10、TNF-α在肝衰竭发病机制中发挥重要作用,然而这些细胞因子在HE的发生、发展中所起作用尚未明确[6-7]。本文通过研究ACLF患者IL-6、IL-10、TNF-α水平的变化以及其与血氨的关系,探讨这些指标与ACLF患者HE的相关性。
1 对象与方法
1.1 对象
选择南昌市第九医院2014年2月至2016年6月收治的ACLF患者35例(ACLF组,男24例,女11例,年龄25~48岁),另择同期收治的ACLF并HE患者40例(ACLF+HE组,男26例,女14例,年龄23~47岁),均于入院时填写临床病例观察表,留取外周血标本。临床资料表包括一般体检项目检查、血型、尿、便常规检查,心、肾功能检查,生化指标及影像学检查等。2组患者在性别、年龄及基础疾病等比较差异均无统计学意义(P>0.05)。
1.2 诊断依据
慢加急性肝衰竭诊断参照2012年版肝衰竭诊治指南;肝性脑病诊断根据中华肝脏病杂志2004年《肝性脑病的定义、命名和诊断》标准,符合症状性HE。终末期肝病模型(MELD)公式(分):R=3.8 ln(血清总胆红素,TBIL)(mg·dL-1)+11.2 ln(国际标准化比值,INR)+9.6 ln(血清肌酐,CRE)(mg·dL-1)+6.4(病因:胆汁性或酒精性肝硬化0分,其他1分)。
1.3 入组及剔除标准
入组标准:符合上述诊断标准,年龄18~65岁,性别不限。
剔除标准:既往有酗酒史,酒精性、自身免疫性、先天性因素引起肝损害,继发细菌、真菌感染者,合并精神疾病、智力障碍,肝脏以外其他各器官系统严重的器质性和功能性病变的患者;妊娠妇女。
1.4 检测方法、仪器、试剂盒
研究对象均于清晨空腹采肘静脉血5 mL,使用不含热原和内毒素的试管,予EDTA、柠檬酸盐或肝素抗凝,操作过程中避免任何细胞刺激,收集血液后及时分离上清,放置于-80 ℃低温冰箱内冷冻保存。采用酶联免疫吸附法集中检测IL-6、IL-10、TNF-α。仪器:全自动多功能酶标仪、半自动洗板机、37 ℃恒温箱等。 试剂盒由公司提供深圳晶美生物工程有限公司。
1.5 临床指标检测
谷丙转氨酶(ALT)、谷草转氨酶(AST)、TBIL、白蛋白(ALB)、胆碱酯酶(CHE)、CRE、INR、凝血酶原活动度(PTA)、降钙素原(PCT),C-反应蛋白、血常规、腹水常规检测在本院检验科进行。
1.6 统计学方法
采用SPSS 20.0软件进行分析,计量资料以均数±标准差表示,相关性检验采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者血清IL-6、IL-10、TNF-α与血氨水平的关系
ACLF+HE组IL-6、TNF-α、血氨水平均高于ACLF组(P<0.05) ,2组IL-10水平差异无统计学意义(P>0.05),见表1。ACLF+HE组IL-6、TNF-α均与血氨呈正相关(r=0.635,P<0.01;r=0.462,P<0.05),IL-10水平与血氨无相关性(r=-0.357,P>0.05);ACLF组IL-6、IL-10、TNF-α水平与血氨均无相关性(r=0.281,P=0.102;r=-0.154,P=0.342;r=-0.16,P=0.35)。
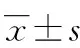

组别nIL-6ρ/(pg·mL-1)IL-10ρ/(pg·mL-1)TNF-αρ/(ng·L-1)血氨c/(mmol·L-1)ACLF组3515.57±2.618.76±2.2310.31±3.4133.30±13.23ACLF+HE组4024.37±6.308.14±2.1112.56±3.4076.82±33.27t6.110.980.269.27P<0.05>0.05<0.05<0.05
2.2 2组血清IL-6、IL-10、TNF-α水平与MELD评分的关系
2组MELD评分差异无统计学意义(P>0.05),见表2。相关性分析:2组IL-6、IL-10、TNF-α水平与MELD评分均呈正相关(ACLF组:r=0.322,P<0.01;r=0.300,P<0.01;r=0.45,P<0.01;ACLF+HE组:r=0.373,P<0.05;r=0.412,P<0.01;r=0.437,P<0.01)。
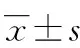

组别nIL-6ρ/(pg·mL-1)IL-10ρ/(pg·mL-1)TNF-αρ/(ng·L-1)MELD评分/分ACLF组3515.57±2.618.76±2.2310.31±3.4123.63±3.23ACLF+HE组4024.37±6.308.14±2.1112.56±3.4024.08±2.40t6.110.980.26-0.696P<0.05>0.05<0.05>0.05
3 讨论
ACLF发病机制复杂,有多种因素共同参与,目前对其认识非常有限,解释也不够完善[8]。IL-6、IL-10、TNF-α等促炎及抗炎细胞因子向上、向下调节细胞免疫在肝衰竭的免疫损伤中起着重要作用[9-10]。很多学者对HE的发病机制进行了研究,但仍未完全阐明其的发病机制,有许多问题有待进一步研究[11],且未建立阻止HE出现及恶化的有效方法。有研究[9]发现某些促炎细胞因子(如IL-6、TNF-α)及抗炎因子(如IL-10)在肝硬化患者HE的发生和发展中发挥重要作用。
本研究结果显示ACLF+HE组患者血清IL-6、血氨水平明显高于ACLF组,ACLF组患者IL-6水平与血氨无明显相关性,而ACLF+HE组IL-6与血氨呈明显正相关,证实IL-6与肝性脑病存在密切关系。IL-6主要由活化的单核、巨噬细胞产生,也可以由Th2细胞产生。IL-6具有防御、调节免疫应答、急性期反应等多种活性,其表达失调可引起许多疾病,主要表现为发病时IL-6水平增高。肝损害发生时,IL-6多有升高[12],导致自身免疫反应,增强自然杀伤细胞的吞噬功能,从而介导肝细胞损伤。有研究显示IL-6与肝细胞的坏死程度密切相关[8]。IL-6水平高加重肝脏损害,使肝脏功能进一步恶化,氨的代谢减少,血氨堆积,导致HK的发生;邰炜彦等[13]研究发现,脑脊液中IL-6的水平升高,会使基质金属蛋白酶-1表达增高,破坏血脑屏障,使其通透性增加,这也可能是IL-6引起HE的另一重要方式。
IL-10主要由TH2细胞产生,活化的B细胞、单核-巨噬细胞、kuffer细胞也可产生,曾被称为细胞因子合成抑制因子,在体内最重要的来源主要是单核巨噬细胞和T辅助细胞。它的产生主要取决于特定的刺激及受损组织类型。IL-10的生物活性主要是参与抑制细胞合成,起负反馈调节作用,能抑制IL-6、TNF-α等的合成表达,对肝细胞损伤的免疫反应起抑制作用。然而,本研究2组患者血清IL-10水平无显著差异,相关性分析与血氨无明显相关性,说明HE与IL-10水平变化无直接关系。
TNF-α来源十分广泛,主要由活化的单核-吞噬细胞产生,活化的T细胞、自然杀伤细胞也可产生。它的生物学特性是介导炎症反应,促进肝细胞合成急性期蛋白,介导肝脏炎症反应,增强免疫损伤,加重肝细胞损伤。本研究结果显示,ACLF+HE组患者血清TNF-α水平明显高于ACLF组,且ACLF组患者TNF-α水平与血氨无相关性,而ACLF+HE组TNF-α水平与血氨呈正相关,表明TNF-α与ACLF患者HE的发生有着某种必然的联系。有研究[14]显示慢性肝衰竭患者血清TNF-α与HE的发生密切相关。TNF-α不仅存在于肝脏,同样存在于中枢神经系统,可能干扰中枢神经细胞血氨代谢,大脑尤其是脑干血氨水平发生变化,引起脑病;此外,TNF-α可能直接损伤血脑屏障,使神经毒素通过血脑屏障产生神经毒性,导致脑功能异常[15]。
本研究中2组MELD评分比较差异无统计学意义,说明HE与ACLF病情程度及预后无明显关系,这似乎与临床不一致。究其原因,MELD评分是基于TBIL、PTA、CRE指标及病因得出的,没有涵盖HE的因素。另外,IL-6、IL-10、TNF-α水平与MELD评分呈正相关,提示IL-6、IL-10、TNF-α水平与ACLF病情程度有密切关系。
综上所述,IL-6、TNF-α水平与ACLF患者HE密切相关。IL-6、TNF-α通过对肝细胞免疫损伤,加重肝功能恶化,导致HE的发生,同样也直接损伤血脑屏障或改变血脑屏障通透性,使神经毒素或假神经递质浓度增加引起脑病;IL-6、TNF-α水平可作为ACLF患者发生HE的预警因子,而IL-10则与ACLF患者HE无明显关系。此外,IL-6、IL-10、TNF-α水平对ACLF的预后评估有重要意义。
[1] 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南:2012年版[J].中华临床感染病杂志,2012,6(5):321-327.
[2] Olson J C,Kamath P S.Acute-on-chronic liver failure:what are the implications?[J].Curr Gastroenterol Rep,2012,14(1):63-66.
[3] Goldbecker A,Buchert R,Berding G,et al.Blood-brain barrier permeability for ammonia in patients with different grades of liver fibrosis is not different from healthy controls[J].J Cereb Blood Flow Metab,2010,30(7):1384-1393.
[4] 聂青和.肝衰竭综合治疗进展[J].实用肝脏病杂志,2013,16(1):17-19.
[5] Han Qiuju,Zhang Cai,Zhang Jian,et al.The role of innate immunity in HBV infection[J].Semin Immunopathol,2013,35(1):23-38.
[6] Hung T H,Lay C J,Chang C M,et al.The effect of infections on the mortality of cirrhotic patients with hepatic encephalopathy[J].Epidemiol Infect,2013,141(12):2671-2678.
[7] 吴波.门冬氨酸鸟氨酸、醒脑静联合乳果糖治疗肝性脑病的疗效[J].实用临床医学,2016,17 (5):21-22.
[8] Keating G M.Entecavir:a review of its use in the treatment of chronic hepatitis B in patients with decompensated liver disea-se[J].Drugs,2011,71(18):2511-2529.
[9] Luo Ming,Li Lei,Yang Er-na,et al.Correlation between interleukin-6 and ammonia in patients with overt hepatic encephalopathy due to cirrhosis[J].Clin Res Hepatol Gastroenterol,2013,37(4):384-390.
[10] 谢能文,何金秋.乙型肝炎病毒相关肝衰竭不同时期免疫的状态[J].实用临床医学,2015,16 (4): 95-97,100.
[11] Li Nan.Research progress in hepatic encephalopathy in recent 10 years:a Web of Science-based literature analysis[J].Neural Regen Res,2012,7(34):2727-2733.
[12] Leber B,Spindelboeck W,Stadlbauer V.Infectious complication of acute and chronic liver disease[J].Semin Respir Crit Care Med,2012,33(1):80-95.
[13] 邰炜彦,王蓓蕾.血清中IL-6,IL-8,TNF-a水平与高血压至急性脑梗死损伤的相关性[J].中华医学神经杂志,2012,3(11):269-272.
[14] Bode M,Wu Yaxu,Pi Xinchun,et al.Regulation of ankyrin repeat and suppressor of cytokine signalling box protein 4 expression in the immortalized murine endothelial cell lines MS1 and SVR:a role for tumour necrosis factor alpha and oxyg-en[J].Cell Biochem Funct,2011,29(4):334-341.
[15] Bémeur C,Butterworth R F.Liver-brain proinflammatory signalling in acute liver failure:role in the pathogenesis of hepatic encephalopathy and brain edema[J].Metab Brain Dis,2013,28(2):145-150.
(责任编辑:罗芳)
2016-05-17
R575.3
A
1009-8194(2016)10-0016-03
10.13764/j.cnki.lcsy.2016.10.006

