准静态扫集胶束电动毛细管色谱法测定扇贝样品中的贝类毒素
邵景玲
(青岛理工大学 教务处,山东 青岛 266033)
准静态扫集胶束电动毛细管色谱法测定扇贝样品中的贝类毒素
邵景玲*
(青岛理工大学 教务处,山东 青岛 266033)
采用准静态扫集胶束电动毛细管色谱(MEKC)法测定了扇贝样品中的2种贝类毒素。毛细管内首先充满含十二烷基硫酸钠(SDS)的缓冲溶液,调节缓冲溶液的pH值,使电渗流等于SDS胶束的电泳流速,电动进样时,带正电荷的贝类毒素离子被SDS扫集吸附,由于SDS在毛细管内处于准静止状态,可使进样时间延长至320 s。与常规电动进样MEKC相比,石房蛤毒素和软骨藻酸的检测灵敏度分别提高950和810 倍。该方法对石房蛤毒素和软骨藻酸的检出限分别为0.05,0.12 ng/mL。方法可实现对扇贝样品中2种贝类毒素的快速、灵敏检测。
准静态扫集;胶束电动毛细管色谱;贝类毒素;扇贝样品
近年来,不断加剧的海洋环境污染导致有害赤潮频繁爆发,由赤潮藻类产生的贝类毒素经鱼、贝类等海洋生物富集,通过食物链传递,威胁人类健康。其中,石房蛤毒素和软骨藻酸是已知毒性最强的海洋生物毒素,其分子结构如图1所示。
目前,检测贝类毒素的方法主要有液相色谱[1-4]、电化学免疫传感器[5]、细胞生物分析[6]、酶联免疫吸附分析[7]、表面拉曼共振传感器[8-10]、毛细管电泳[11]、毛细管电色谱[12]以及毛细管电泳电化学免疫分析[13-15]等。由于大多数贝类毒素的标准样品提取或制备困难,价格昂贵,限制了贝类毒素检测方法的研究。胶束电动毛细管色谱(MEKC)由于样品消耗少、仪器设备简单、灵敏度高等特点,在生化分析领域备受关注。然而,MEKC在贝类毒素分析检测领域的研究未见文献报道。本文研究了一种准静态扫集MEKC在线富集分离法,通过控制缓冲溶液的pH值使SDS胶束的电泳流速等于反向电渗流,当样品离子在毛细管进样端遇到SDS时被扫集吸附,由于SDS胶束处于准静止状态,可大大延长进样时间,使石房蛤毒素和软骨藻酸的检测灵敏度分别提高950和810倍。该方法已成功用于扇贝样品中石房蛤毒素和软骨藻酸的测定,显示了非常重要的应用价值。
1 实验部分
1.1 仪器与试剂
TriSepTM-2000GV型毛细管电泳仪配紫外检测器(美国Unimicro公司),检测波长216 nm;未涂层石英毛细管(河北永年锐沣色谱器件公司),75 μm i.d.,总长60 cm,有效长度48 cm;Eppendorf 5810 离心机(德国Eppendorf公司);pHSJ-4A型酸度计(上海精密科学仪器有限公司);SK3200H型超声波清洗器(上海科导超声仪器有限公司)。
石房蛤毒素(STX)和软骨藻酸(DA)标准品购自美国Abraxis公司,于-4 ℃冰箱保存,备用。十二烷基硫酸钠(SDS),NaH2PO4,Na2HPO4,NaOH,甲醇均购于中国医药(集团)上海化学试剂公司。所用试剂均为分析纯,实验用水为二次蒸馏水。堆积缓冲液为40 mmol/L NaH2PO4+60 mmol/L SDS (pH 5.0);MEKC分离缓冲液为40 mmol/L Na2HPO4+60 mmol/L SDS(pH 8.0)。
1.2 扇贝样品处理
随机取5只扇贝样品,除去贝壳,以无菌操作取10 g剪碎混匀后的贝肉用蒸馏水浸洗3次,以5 000 r/min匀浆10 min,冰水浴超声10 min,用盐酸调至pH 3.0~4.0,2 000 r/min离心5 min后,倾去上层清液,加入10 mL甲醇搅匀,超声萃取5 min,2 000 r/min离心5 min,收集上层萃取液,在35~50 ℃水浴下减压蒸发萃取液至甲醇挥发完毕,用40 mmol/L NaH2PO4+10%甲醇 (pH 5.0)溶解析出物,过0.22 μm 微孔滤膜,于-4 ℃冰箱保存,备用。
1.3 准静态扫集MEKC分离检测石房蛤毒素和软骨藻酸
基于准静态扫集MEKC分离检测石房蛤毒素和软骨藻酸的步骤如图2所示。毛细管内首先充满含SDS的堆积缓冲液(pH 5.0),然后将毛细管进样端插入样品池中,15 kV电动进样(图2A);带正电荷的阳离子随电渗流快速向毛细管迁移,在毛细管入口端与带负电的SDS胶束相遇,贝类毒素被SDS胶束扫集并吸附在胶束表面,样品离子被富集(图2B);由于在pH 5.0时,SDS胶束的电泳速率与电渗流速率相等[16],方向相反,因此,SDS胶束处于准静止状态,可使进样时间大大延长;进样富集320 s后,毛细管两端换上MEKC分离缓冲液(pH 8.0),在15 kV的分离电压下,检测池中的OH-向阳极迁移,使毛细管中的电渗流增大(图2C),SDS胶束携带着待测样品向阴极迁移并进行MEKC分离,紫外检测(图2D),检测信号的大小与贝类毒素的浓度成正比,从而可对样品中的贝类毒素进行定量分析。
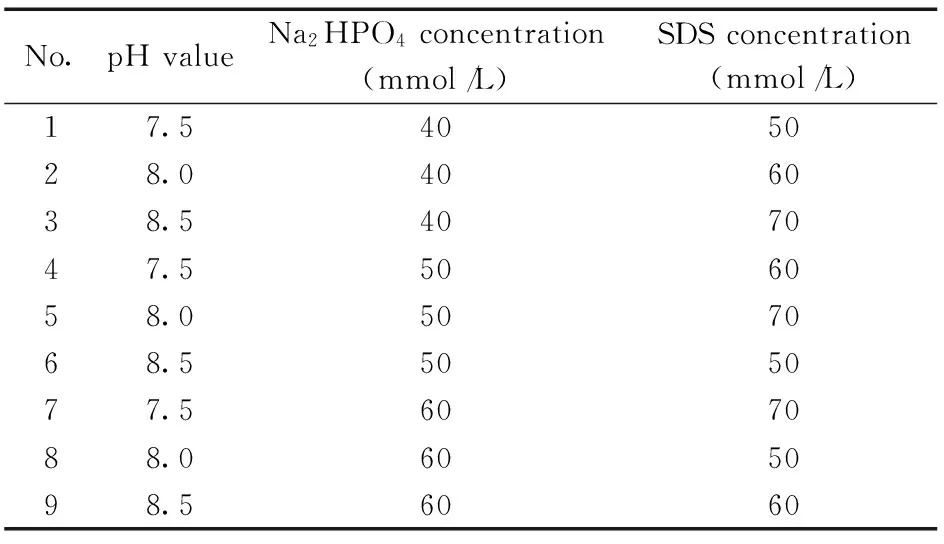
表1 正交试验设计方案Table 1 Orthogonal experimental design
2 结果与讨论
2.1 MEKC分离条件的优化
研究了不同浓度和pH值的醋酸盐、磷酸盐、硼酸盐等缓冲溶液对石房蛤毒素和软骨藻酸分离的影响,结果表明,用磷酸盐缓冲溶液分离的效果最佳。参考文献[13],采用正交试验设计对影响样品分离的主要因素磷酸盐浓度、pH值和SDS浓度对分离条件进行优化,如表1所示。根据石房蛤毒素和软骨藻酸检测的峰形、峰高、分离度和分离效率,选择最佳分离缓冲溶液为40 mmol/L Na2HPO4+60 mmol/L SDS(pH 8.0)。
2.2 准静态扫集富集条件的优化
毛细管电泳紫外检测灵敏度较低,增大进样量可有效提高检测灵敏度,但在进样过程中,如果堆积界面向检测端快速移动,为了留出足够长的毛细管进行样品分离,进样时间就受到限制。SDS胶束带负电荷,在毛细管中受电场的作用向正极移动,而电渗流由正极流向负极,当缓冲溶液pH值为5.0时,SDS胶束的电泳速率与电渗流速率大小相等,方向相反,胶束处于准静止状态,可以增大进样时间,提高灵敏度,因此控制堆积缓冲溶液的pH值为5.0。
堆积缓冲溶液中SDS的浓度对样品富集有较大影响。将不同浓度(10~80 mmol/L)的SDS加至堆积缓冲溶液中,发现在10~50 mmol/L范围内,随着SDS浓度的增大,检测灵敏度迅速增大,但当SDS浓度大于50 mmol/L时,继续增大SDS的浓度,灵敏度的增速趋缓,同时高浓度的SDS会产生大量的焦耳热,导致后续MEKC分离的效率和分离度降低。综合考虑富集和分离效果,选择堆积缓冲溶液中SDS的浓度为50 mmol/L。
进样开始后,带正电荷的石房蛤毒素和软骨藻酸离子向毛细管负极端迁移,在毛细管入口处被SDS胶束扫集,胶束表面吸附上一层带正电荷的样品离子,胶束结合物的电泳速率减小甚至反向,因此进样时间不能无限延长。不同进样时间对石房蛤毒素和软骨藻酸峰高和分离效率的影响见图3,随着进样时间的延长,峰高增大,当进样时间超过320 s时,峰高增大的趋势变缓,分离效率明显下降,因此选择进样时间为320 s。
2.3 基于准静态扫集MEKC分离检测石房蛤毒素和软骨藻酸
采用上述优化条件对石房蛤毒素和软骨藻酸进行分析,并与常规电动进样(10 kV电动进样10 s)MEKC的分析结果进行对比,结果如表2所示。由表2可知,由于采用准静态扫集富集技术可使进样时间延长至320 s,根据检出限(LOD)和峰高比×样品稀释因子计算得知,石房蛤毒素和软骨藻酸的灵敏度分别提高了950和810倍,检测浓度降低至0.05 mg/L。这是由于在准静态扫集进样富集过程中,SDS胶束处于准静止状态时,样品离子与SDS胶束有充足的时间相互作用,使得SDS胶束能充分吸附富集样品离子,从而使检测灵敏度得到极大提高。
2.4 线性范围、检出限与精密度
在最佳实验条件下,将石房蛤毒素和软骨藻酸的混合标准液逐级稀释,配成系列浓度的标准溶液,采用准静态扫集MEKC法依次测定,以溶液的浓度(x,ng/mL)为横坐标,相应电泳峰的峰高(y,mAU)为纵坐标绘制工作曲线,考察2种毒素的回归方程、线性范围、检出限(LOD)及相对标准偏差(RSD)。结果显示,石房蛤毒素和软骨藻酸分别在0.5~180.0 ng/mL和1.0~260.0 ng/mL范围内线性关系良好,相关系数均大于0.99,峰高的相对标准偏差(RSD)分别为3.8%和3.4%,迁移时间的RSD分别为5.2%和4.9%。
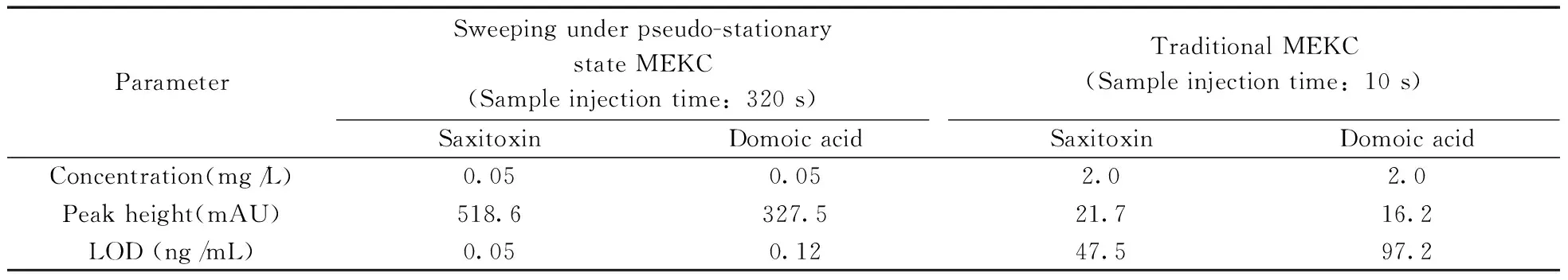
表2 准静态扫集MEKC与常规电动进样MEKC分析结果的比较Table 2 Comparison of analytical results with sweeping under pseudo-stationary state MEKC and traditional MEKC
2.5 扇贝样品中石房蛤毒素与软骨藻酸的检测及回收率
采用该方法按优化条件对扇贝样品的提取液进行测定(如图4)。由于准静态扫集MEKC检测的灵敏度较高,所选扇贝样品中的石房蛤毒素和软骨藻酸均能检出,结果如表3所示。
为评价方法的准确度和可靠性,从3个不同区域精选扇贝样品,并在样品中按低、中、高3个浓度水平添加混合标准溶液进行加标回收和精密度实验,在最佳条件下测定,结果如表3所示。结果表明,石房蛤毒素和软骨藻酸的回收率为90.0%~105.5%,RSD为0.7%~3.8%,表明本方法具有良好的精密度,结果准确可靠,可用于扇贝样品中石房蛤毒素和软骨藻酸的分离测定。
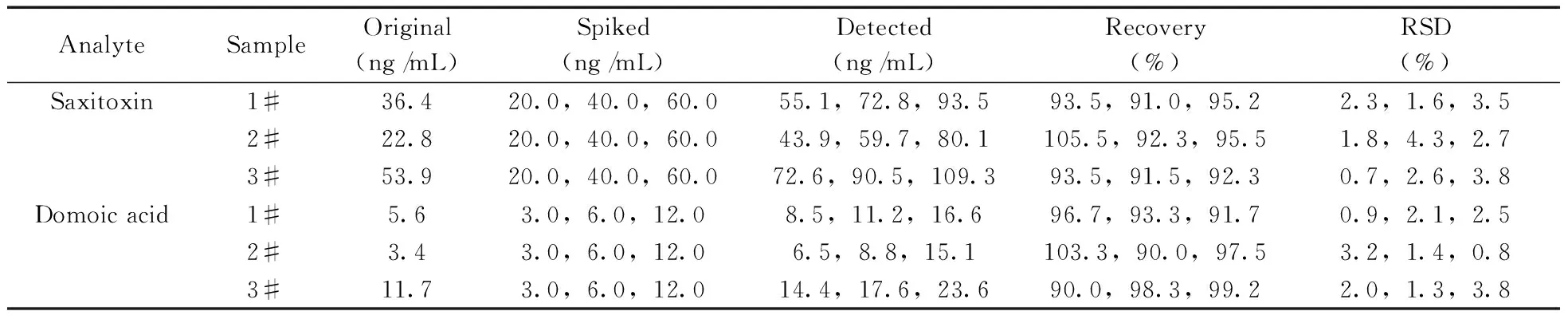
表3 扇贝样品的分析结果、加标回收率及相对标准偏差(n=5)Table 3 Analytical results,spiked recoveries and RSDs of shellfish samples
3 结 论
本文通过控制堆积缓冲溶液的pH值,结合大体积进样,发展了一种准静态扫集MEKC富集分析技术。通过调整SDS胶束的电泳流速等于反向电渗流速,可使进样时间延长至320 s,增大了进样量,同时使样品离子与SDS胶束有充分的作用时间。该方法使石房蛤毒素和软骨藻酸的检测灵敏度分别提高了950和810 倍,并成功用于扇贝样品中2种贝类毒素的快速、灵敏检测,对实际样品中贝类毒素的检测显示了良好的应用前景。
[1] Gong X M,Wan J,Ma R H,Wang H T,Hua M M,Sun J.J.Instrum.Anal.(宫小明,万进,马荣桧,王洪涛,华萌萌,孙军.分析测试学报),2014,33(8):881-886.
[2] Chan I O M,Tsang V W H,Chu K K,Leung S K,Lam M H W,Lau T C,Lam P K S,Wu R S S.Anal.Chim.Acta,2007,583:111-117.
[3] Hess P,Morris S,Stobo L A,Brown N A,McEvoy J D G,Kennedy G,Young P B,Slattery D,McGovern E,McMahon T,Gallacher S.TrendAnal.Chem.,2005,24(4):358-367.
[4] Vale C,Alfonso A,Vieytes M R,Romarís X M,Arévalo F,Botana A M,Botana L M.Anal.Chem.,2008,80:1770-1776.
[5] Guo M M,Wu H Y,Li Z X,Xue R Y,Tan Z J,Zhai Y X,Shen G L.J.Instrum.Anal.(郭萌萌,吴海燕,李兆新,薛瑞宇,谭志军,翟毓秀,沈国励.分析测试学报),2014,33 (2):161-166.
[6] Hayashi R,Saito H,Okumura M,Kodo F.J.Agric.FoodChem.,2006,54:269-273.
[7] Yu F Y,Liu B H,Wu T S,Chi T F,Su M C.J.Agric.FoodChem.,2004,52:5334-5339.
[8] Fonfría E S,Vilario N,Campbell K,Elliott C,Haughey S A,Ben-Gigirey B,Vieites J M,Kawatsu K,Botana L M.Anal.Chem.,2007,79:6303-6311.
[9] Campbell K,Haughey S A,Top H P,Egmond H P,Vilario N,Botana L M,Elliott C T.Anal.Chem.,2010,82:2977-2988.
[10] Top H J,Elliott C T,Haughey S A,Vilario N,Egmond H P,Botana L M,Campbell K.Anal.Chem.,2011,83:4206-4213.
[12] Wu W,Wu X P,Lin X C,Xie Z H,Giesy J P.J.Sep.Sci.,2009,32:2117-2122.
[13] Zhang X W,Zhang Z X.Toxicon,2012,59:626-632.
[14] Zhang X W,Zhang Z X.J.FoodCompos.Anal.,2012,28:61-68.
[15] Zhang Z X,Li X L,Ge A Q,Zhang F,Sun X M,Li X M.Biosens.Bioelectron.,2013,41:452-458.
Determination of Shellfish Toxins in Shellfish Samples by Sweeping Under Pseudo-stationary State and Micellar Electrokinetic Chromatography
SHAO Jing-ling*
(Academic Affairs Office,Qingdao Technological University,Qingdao 266033,China)
A novel method based on sweeping under pseudo-stationary state and micellar electrokinetic chromatography(MEKC) was developed for the determination of shellfish toxins in shellfish samples.The capillary was firstly pre-filled with the running buffer containing sodium dodecyl sulfate(SDS).By adjusting pH value,the electrophoretic flow of SDS micelle was equal to the counter electroosmotic flow(EOF).The positive charged shellfish toxins were injected electrokinetically into capillary,swept and adsorbed with SDS micelle.The injection time was prolonged to 320 s under 10 kV since the SDS micelles were at a pseudo-stationary state.With the sweeping under pseudo-stationary state method,the preconcentration factors of 950 and 810 were obtained for saxitoxin and domoic acid,respectively,compared with the traditionally electrokinetic injection MEKC.The method was used to the quantitative determination of saxitoxin and domoic acid with their detection limits of 0.05 ng/mL and 0.12 ng/mL,respectively.The proposed sweeping under pseudo-stationary state and MEKC method was successfully applied in the determination of two shellfish toxins in shellfish samples.Key words:sweeping under pseudo-stationary state;micellar electrokinetic chromatography(MEKC);shellfish toxins;shellfish samples
2016-05-16;
2016-06-22
国家自然科学基金(21105051)
10.3969/j.issn.1004-4957.2016.11.022
O657.8;S852.44
A
1004-4957(2016)11-1491-05
*通讯作者:邵景玲,硕士,讲师,研究方向:环境工程,Tel:0532-85071120,E-mail:qdlgshao@126.com
实验技术

