细菌群体感应抑制剂的研究进展
孙 琦,梁经纬,王 琳,张廷剑,孟繁浩
(中国医科大学药学院 药物化学教研室,辽宁 沈阳 110122)
细菌群体感应抑制剂的研究进展
孙琦,梁经纬,王琳,张廷剑,孟繁浩
(中国医科大学药学院 药物化学教研室,辽宁 沈阳 110122)
摘要:在菌群生长过程中,细菌能不断产生化学信号分子并分泌到周围环境中,当信号分子的数量达到一定阈值时,可调控菌体相关基因的表达如生物膜的形成、生物发光等,以适应环境的变化,这种现象称为细菌群体感应(quorum sensing,QS)。细菌群体感应抑制剂(quorum sensing inhibitor,QSI)以细菌的群体感应为靶点,只针对病原菌的群体感应系统起抑制作用,并不杀死体内的正常细菌或干扰其正常生命活动,为人类提供了一种新型抗菌途径。综述了细菌群体感应信号分子的调控系统和细菌群体感应抑制剂的研究进展。
关键词:细菌群体感应;信号分子;调控;细菌群体感应抑制剂;构效关系
长期以来,人们普遍认为细菌是以单细胞形式存在的生物个体,相互间并无信息交流和协作分工。20世纪70年代,Nealson等[1]研究海洋微生物费氏弧菌(Vibrio fischeri)的发光机制时发现,细菌细胞间存在信息交流,且其生物发光现象与细菌群体密度呈正相关,由此科研人员开始推测各类细菌中是否广泛存在着细胞间的信息交流现象。20世纪90年代后,科研人员通过对革兰氏阴性菌和革兰氏阳性菌等多种细菌进行相关研究证实了上述推测,同时发现细胞间信息传递的载体是一种可溶的小分子信号物质[2]。1994年,Fuqua等[3]发现随着细菌群体密度的增大,微生物的某些生理生化特征会发生变化,出现单一或少量菌体所不具备的特征。
在菌群生长过程中,细菌不断产生化学信号分子并且分泌到周围环境中,当信号分子的数量达到一定阈值时,它就会在细菌体内与相应受体结合,通过信号传导调控相关基因的表达,如生物发光、抗生素合成、固氮基因调控、色素产生、毒性基因表达、生物膜形成等,从而表现出单个细菌无法展现的某些生理功能以适应环境的变化,这种细菌“语言”被称为群体感应(quorumsensing,QS)[4]。目前研究人员已经在包括大肠杆菌、铜绿假单胞菌等致病菌在内的50多种细菌中发现了QS现象[5-6]。研究表明信号分子在信号传导过程中起关键作用,通过对信号分子进行抑制和干扰可阻断细菌QS信号系统的传导,抑制不良基因的表达,从而达到治疗细菌感染的目的[7]。
1细菌QS信号分子的调控
大多数细菌通过分泌化学信号分子进行细胞间交流并协调群体行为,这些信号分子也叫自诱导分子(autoinducers,AI)[8-9]。细菌QS系统由自诱导分子、感应分子及下游调控蛋白组成。自诱导分子的种类很多,不同体系间的自诱导分子在传导机制和调控体系方面区别很大[10]。Reading等[11]根据自诱导分子的性质以及感应模式的不同,将细菌QS系统分为以下类型:(1)革兰氏阴性菌的LuxI/R型信号系统;(2)革兰氏阳性菌的小分子多肽介导型信号系统;(3)LuxS/AI-2 型信号系统;(4)AI-3/肾上腺素/去甲肾上腺素型信号系统。
1.1革兰氏阴性菌的LuxI/R 型信号系统
除黄色黏球菌和哈氏弧菌(Vibrioharveyi)外,大部分革兰氏阴性菌的QS都是由LuxI/R 型信号系统调控,并以N-酰基高丝氨酸内酯(N-acyl-homoserine lactones,AHL)作为自诱导分子[12]。AHL由LuxI酶合成,在细胞内不断累积后利用特定的传输系统向外运输,其数量达到一定阈值后就会与相应的DNA结合蛋白LuxR结合进而启动下游基因的表达,这种调控机制称为LuxI/R型信号系统(图1)[13]。 除LuxR是最常见的受体蛋白外,LasR、CarR、ExpR、RhlR、TraR也属于AHL受体蛋白[10]。

图1 革兰氏阴性菌的LuxI/R型信号系统
AHL类自诱导分子以高丝氨酸内酯环为母体,不同的AHL分子连接不同的N-酰基侧链,从而产生不同的生理功能。N-酰基侧链的碳原子数为4~18[14],常含不饱和键,酰基侧链的3位通常为酮羰基或羟基[15]。高丝氨酸内酯环具有亲水性,而N-酰基侧链具有疏水性,故AHL类自诱导分子兼具水溶性和膜透过性,可自由出入细胞且细胞内外浓度一致[16]。革兰氏阴性菌的AHL类信号分子结构如表1所示。
表1革兰氏阴性菌的AHL类信号分子结构

Tab.1 Structures of signal molecules AHL in Gram-negative bacteria
1.2革兰氏阳性菌的小分子多肽介导型信号系统
革兰氏阳性菌主要利用修饰后的小分子多肽(autoinducing peptides,AIP)作为自诱导分子,AIP不能自由穿透细胞壁,需通过ABC转运系统(ATP-binding cassette)才能到达细胞外发挥作用。AIP浓度达到一定阈值时会与细胞膜上的双组分磷酸蛋白激酶信号识别系统结合,引发激酶的组氨酸磷酸化并最终使细胞内受体蛋白的天冬氨酸磷酸化,再经与特定靶位结合后启动目的基因的表达[17]。AIP介导的细菌QS系统负责对细菌的多种行为进行调控,如金黄色葡萄球菌的外毒素表达、肺炎链球菌致病基因的表达等。AIP是一类短肽分子,不具有典型结构,其氨基酸残基数通常为5~17,其中C端第5位通常是一个保守的半胱氨酸,可与C末端的氨基酸残基通过硫酯键相连,形成类脂[18]。部分AIP类信号分子的结构如图2所示。

图2 部分AIP类信号分子的结构
1.3LuxS/AI-2 型信号系统
研究表明,哈氏弧菌的信号系统比较特殊,它可产生2种自诱导分子——AI-1和AI-2,均能感应菌群密度,其中AI-1 负责种内沟通,AI-2 进行种间交流。因此认为AI-2在细菌种间交流中起通用信号分子作用,可在不同种类的微生物中发挥作用[19]。目前已知有40多种细菌可产生、识别和利用AI-2进行信息传递。AI-2分子的本质是呋喃酮酰硼酸二酯 (furanosyl borate diester),为4,5-二羟基-2,3-戊二酮(DPD)的代谢产物[20]。研究发现,当AI-2在菌体外累积到一定阈值时会被受体蛋白LuxP识别并结合,再通过与激酶蛋白LuxQ反应来启动相关基因的表达,激发AI-2在菌种间的信息传递功能[21]。
1.4AI-3/肾上腺素/去甲肾上腺素型信号系统
表达肠出血性大肠杆菌(entero-hemorrhagicE.coli)毒力因子的信号分子是一类人们知之甚少的AI-3分子。AI-3碎片的ESI-MS数据显示,AI-3是一类完全不同于AI-2的新型化合物[22],其分子结构尚未明确,但相关研究发现去甲肾上腺素和肾上腺素可代替其发挥作用。
除上述4类信号分子外,细菌QS系统还有很多其它信号分子,如二酮呱嗪类化合物(DKP)对种间和种内的细菌QS均起重要的调控作用;一些脂肪酸类化合物, 如野油菜黄单胞菌(Xanthomonascampestris)的某种低分子量物质DSF(methyl dodecenoic acid)以及劳尔氏菌(Ralstoniasolanacearum)的某种脂肪酰甲酯PAME(hydroxy-palmitic acid methyl ester)均可调控毒性因子的表达[7]。

图3 其它信号分子的结构
2细菌群体感应抑制剂
目前临床广泛使用的抗生素大多将细菌的核酸合成、蛋白质合成和细胞壁合成等生命代谢过程作为靶点,直接杀死或抑制细菌生长,这种生存压力使细菌逐渐变为耐药的突变菌株[23]。因此,拓宽思路寻找新靶点以开发新型抗菌药物势在必行。通过阻断病原菌表达有害基因发挥作用的细菌群体感应抑制剂(quorum sensing inhibitor,QSI)并不干扰细菌的正常生理活动,与抗生素联用可提高致病菌对抗生素的敏感性,提高药物疗效,特别适用于治疗耐药性革兰氏阴性菌所致疾病[24]。
目前发现的细菌QSI主要分为非肽类小分子化合物(分为天然来源和人工合成两类)、肽类化合物(主要是AIP类似物)和蛋白质(分为QS淬灭酶和QS淬灭抗体两类)等。下面对几类代表性细菌QSI进行详细介绍。
2.1天然非肽类细菌QSI
植物可产生QSI活性物质以降低侵染菌的致病能力。Hentzer等[25]从海洋红藻(Deliseapulchra)中分离得到了溴化呋喃酮类化合物。其化学结构类似于L-高丝氨酸内酯盐酸盐(HSL),可干扰AHL类信号分子与受体蛋白LuxR结合从而抑制细菌QS系统。除海洋红藻外,从高等植物和动物组织中也分离得到了QSI活性物质。Vandeputte等[26]从风车子属植物中分离得到的类黄酮物质可抑制细菌生成铜绿假单胞菌生物膜和绿脓毒素。从牛等家禽的肉制品以及大蒜、胡萝卜等食用植物中也能提取得到QSI活性物质[27-28]。自然界中的微生物所产生的一些次级代谢产物同样能够发挥QSI作用。例如,曲霉素(patulin)和青霉酸(penicillic acid)作为青霉菌属(Penicillium)的次级代谢产物对铜绿假单胞菌表现出了QSI活性(图4)[29]。从嗜盐芽孢杆菌(Halobacillussalinus)的发酵液中得到的2种醋酸苯乙酯类化合物能够抑制哈氏弧菌发光基因的表达[30]。
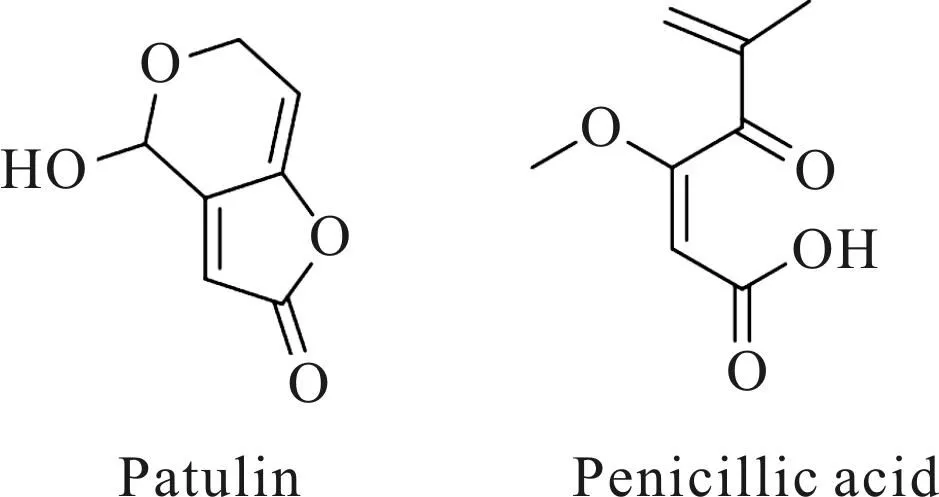
图4 曲霉素和青霉酸的结构
2.2人工合成非肽类细菌QSI
人工合成非肽类细菌QSI是以天然信号分子结构为模板,经人工合成得到的细菌QS信号分子竞争性抑制剂。主要分为以下几类:
2.2.1AHL类似物
合成AHL类似物的方法主要有3种:(1)保持AHL结构母核高丝氨酸内酯环不变,在酰基侧链引入取代基;(2)保持酰基侧链不变,在高丝氨酸内酯环中引入替代物或取代基;(3)对高丝氨酸内酯环和酰基侧链同时进行结构修饰[31]。
Reverchon等[32]通过在AHL的酰基侧链上增加不饱和基团,3位以羰基取代所得到的化合物表现出了较好的QSI活性。化合物HSL1能与费氏弧菌的LuxR蛋白结合,其IC50值达到2 μmol·L-1,化合物HSL2~4也具有良好的QSI活性(图5)。

图5 AHL类似物的结构
Castang等[33]合成了N-磺酰基高丝氨酸内酯类化合物(图6),发现其具有QSI活性。

图6 N-磺酰基高丝氨酸内酯类化合物的结构
Geske等[34]利用固相合成法合成了一系列AHL类似物,其中化合物B7和C10对绿脓杆菌和费氏弧菌的QS系统均有抑制作用。Muh等[35]通过高通量筛选从200 000个化合物中发现了2个针对铜绿假单胞菌的QSI PD12和V-06-018,其结构均保留了酰基侧链,将母核替换成苯环和四氮唑,IC50值分别为30 μmol·L-1和10 μmol·L-1,其中V-06-018在100 μmol·L-1时对绿脓毒素的抑制率可达到90%。另外,通过将内酯环构型翻转、在内酯环上引入杂原子和改变酰基侧链结构等方法对AHL进行结构改造,也得到了一系列具有QSI活性的AHL类似物(图7)[36-38]。

图7 其它AHL类似物的结构
2.2.2溴化呋喃酮类似物
据报道,从海洋红藻中分离得到的溴化呋喃酮具有QSI活性。根据天然溴化呋喃酮的化学结构,科研人员设计了一系列在呋喃环和侧链上连有不同取代基且侧链长度不同的化合物,其中一些化合物的QSI活性见表2。
表2溴化呋喃酮类似物的QSI活性
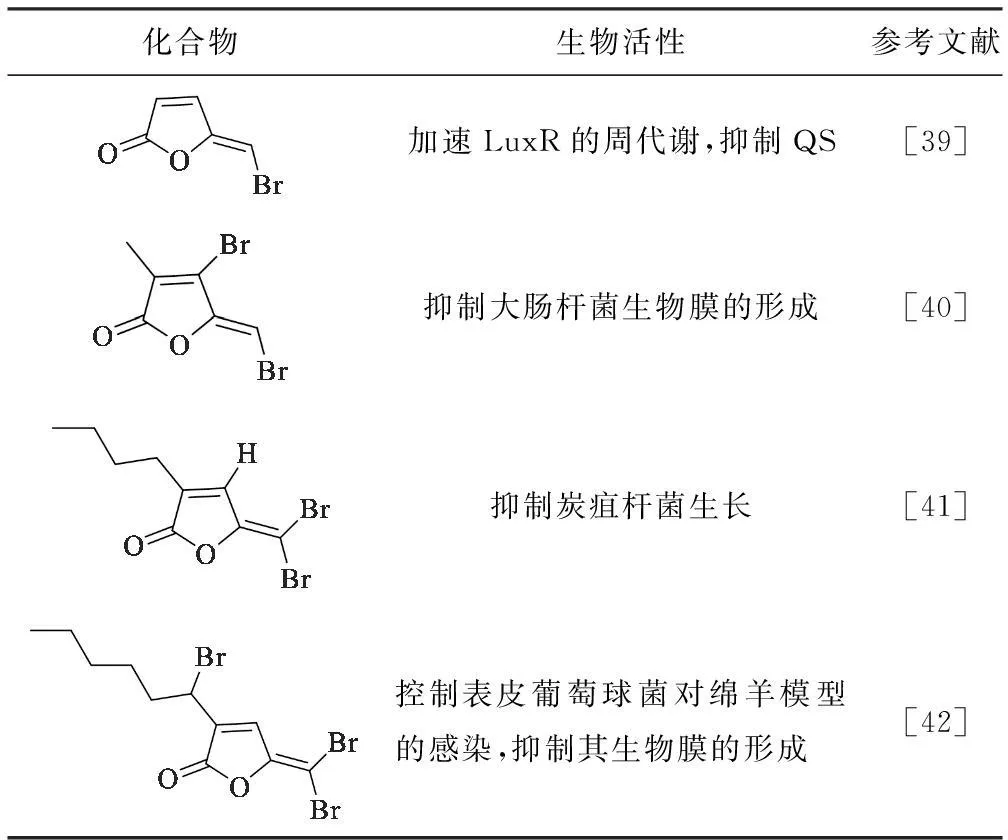
Tab.2 QSI Activities of brominated furanones analogues
2.2.3AI-2同系物
AI-2同系物在生物膜形成和控制细菌感染方面具有潜在应用价值。科研人员通过相关实验证实了几种AI-2同系物可抑制AI-2合成过程的关键酶(MTA核苷酶)的活性,干扰AI-2的合成从而阻断QS[43]。
2.2.4其它人工合成非肽类细菌QSI
除上述几种非肽类信号分子结构类似物外,Rasko等[44]在完成约15万个有机小分子化合物的筛选工作后发现,化合物4-[(苯胺基)硫代甲基]氨基-N-苯基苯磺酰胺可以抑制大肠杆菌等细菌的QS系统,降低贺志毒素基因的表达。Li等[45]研究发现,连有硼酸基团的芳香族化合物能与LuxP蛋白结合进而抑制AI-2对V.harveyiQS系统的调控作用。Holden等[46]证实二酮呱嗪类化合物能和特定的LuxR蛋白结合,从而调节一些LuxR-based细菌的QS系统。研究发现,2种砜类化合物S-1和S-2能够抑制V.harveyiMM32菌株的QS系统,目前对于此类化合物的构效关系正在进一步研究中[47]。Kaufmann等[48]利用吡咯二酮类化合物作为生物膜抑制剂,可破坏细菌P.aeruginosa的信号交流系统,产生较好的QSI活性。最近相关研究还发现,吡咯酮的偶联二聚体也具有很好的QSI活性。 Shen等[49]报道了一类SRH类似物,此类化合物可作为LuxS的抑制剂对枯草芽孢杆菌产生抑制作用。其中化合物SRH-1和SRH-2的IC50值分别为0.72 μmol·L-1和0.37 μmol·L-1。其它人工合成非肽类细菌QSI的结构见图8。
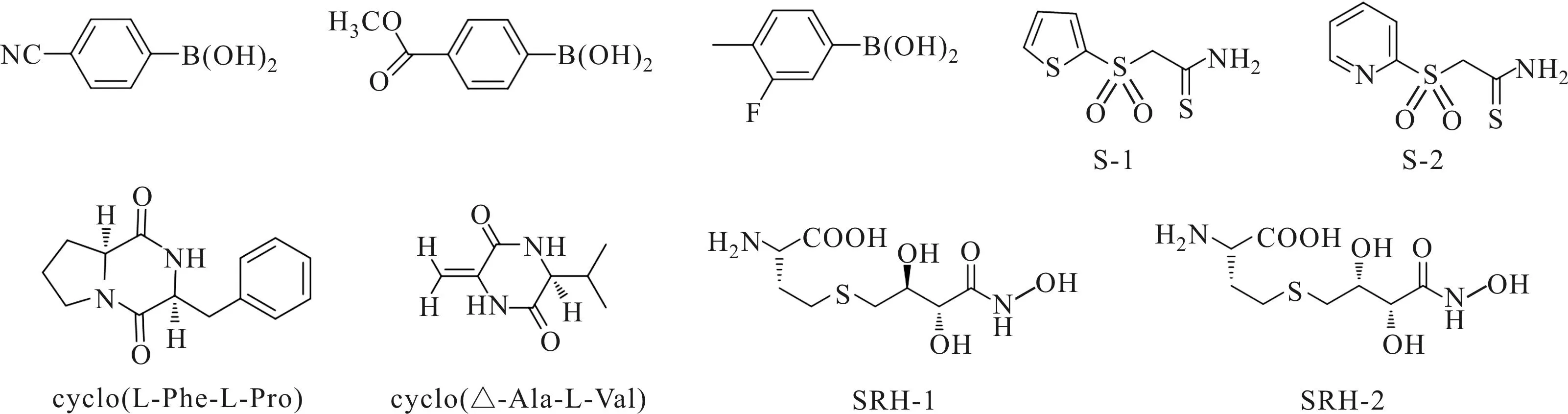
图8 其它人工合成非肽类细菌QSI的结构
2.3AIP结构类似物
革兰氏阳性菌通常利用小分子多肽(AIP)作为自诱导分子,AIP分子一般由体内产生的前体肽经一系列加工修饰后转变为具有QSI活性的信号分子。Lyon等[50]研究AIP分子的三维构效关系时发现了一种光谱型抑制剂TrAIP-Ⅱ(图9),这种只含有硫内酯环的截断肽是通过转移硫酸酯化的方法合成的。TrAIP-Ⅱ可破坏抗原受体的信号传导,抑制细菌QS,从而降低细菌毒力。一种线状的、序列为YSPWTNF-NH2的RNAⅢ抑制肽(RIP)能降低金黄色葡萄球菌的毒力[51],抑制其生物膜的形成。

图9 TrAIP-Ⅱ的结构
3结语
细菌QS已经受到越来越多的关注,以细菌QS为靶点的QSI通过干扰细菌的信号传递系统来抑制有害基因的表达,从而使细菌失去致病能力。细菌QSI与传统的抗生素相比,具有以下优点[52]:
(1)QSI并不妨碍细菌的正常生长和蛋白质的合成,仅在适当浓度时对靶细菌的QS系统产生抑制作用,降低细菌的毒力,抑制细菌毒素的产生。这样可防止其在抑制病原菌的同时杀灭有益菌。
(2)QSI不能立即杀死细菌,因此能够避免因细菌死后产生大量有毒脂多糖而引起败血症。
(3)QSI与其它抗生素联用,可以减少抗生素的用量并增强抗菌疗效,从而更有利于相关疾病的治疗。
总之,细菌QSI的研究具有较大的潜在价值,为人类提供了一种新型抗菌途径,即不杀死细菌,只需抑制其有害的生物活性就能达到治疗疾病的目的,从而更加有益于人们的健康。
参考文献:
[1]NEALSON K H,HASTINGS J W.Bacterial bioluminescence:Its control and ecological significance[J].Microbiological Reviews,1979,43(4):496-518.
[2]陈静,刘显军,边连全,等.细菌生物膜及细菌群体感应系统的研究进展[J].江苏农业科学,2010,(5):32-33.
[3]FUQUA W C,WINANS S C,GREENBERG E P.Quorum sensing in bacteria:The LuxR-LuxI family of cell density-responsive transcriptional regulators[J].Journal of Bacteriology,1994,176(2):269-275.
[4]SWIFT S,DOWNIE J A,WHITEHEAD N A,et al.Quorum sensing as a population-density-dependent determinant of bacterial physiology[J].Advances in Microbial Physiology,2001,45:199-270.
[5]BASSLER B L.Small talk.Cell-to-cell communication in bacteria[J].Cell,2002,109(4):421-424.
[6]CHOUDHARY S,SCHMIDT-DANNERT C.Applications of quorum sensing in biotechnology[J].Applied Microbiology and Biotechnology,2010,86(5):1267-1279.
[7]郭嘉亮,陈卫民.细菌群体感应信号分子与抑制剂研究进展[J].生命科学,2007,19(2):224-232.
[8]HASTINGS J W,GREENBERG E P.Quorum sensing:The explanation of a curious phenomenon reveals a common characteristic of bacteria[J].Journal of Bacteriology,1999,181(9):2667-2668.
[9]SALMOND G P,BYCROFT B W,STEWART G S,et al.The bacterial ′enigma′:Cracking the code of cell-cell communication[J].Molecular Microbiology,1995,16(4):615-624.
[10]CHURCHILL M E,CHEN L L.Structural basis of acyl-homoserine lactone-dependent signaling[J].Chemical Reviews,2011,111(1):68-85.
[11]READING N C,SPERANDIO V.Quorum sensing:The many languages of bacteria[J].FEMS Microbiology Letters,2006,254(1):1-11.
[12]BOYER M,WISNIEWSKI-DYÉF.Cell-cell signalling in bacteria:Not simply a matter of quorum[J].FEMS Microbiology Ecology,2009,70(1):1-19.
[13]WHITEHEAD N A,BARNARD A M,SLATER H,et al.Quorum-sensing in Gram-negative bacteria[J].FEMS Microbiology Reviews,2001,25(4):365-404.
[14]POMINI A M,CRUZ P L,GAI C,et al.Long-chain acyl-homoserine lactones from methylobacterium mesophilicum:Synthesis and absolute configuration[J].Journal of Natural Products,2009,72(12):2125-2129.
[15]STEVENS A M,QUENEAU Y,SOULRE L,et al.Mechanisms and synthetic modulators of AHL-dependent gene regulation[J].Chemical Reviews,2011,111(1):4-27.
[16]FUQUA C,PARSEK M R,GREENBERG E P.Regulation of gene expression by cell-to-cell communication:Acyl-homoserine lactone quorum sensing[J].Annual Review of Genetics,2001,35(1):439-468.
[17]SUGA H,SMITH K M.Molecular mechanisms of bacterial quorum sensing as a new drug target[J].Current Opinion in Chemical Biology,2003,7(5):586-591.
[18]罗利龙,娄瑞娟,邱健,等.细菌群体感应及其干扰策略的研究进展[J].生物学杂志,2010,27(6):79-82.
[19]MOK K C,WINGREEN N S,BASSLER B L.Vibrioharveyiquorum sensing:A coincidence detector for two autoinducers controls gene expression[J].The EMBO Journal,2003,22(4):870-881.
[20]BASSLER B L,GREENBERG E P,STEVENS A M.Cross-species induction of luminescence in the quorum-sensing bacteriumVibrioharveyi[J].Journal of Bacteriology,1997,179(12):4043-4045.
[21]PEREIRA C S,THOMPSON J A,XAVIER K B.AI-2-Mediated signalling in bacteria[J].FEMS Microbiology Reviews,2013,37(2):156-181.
[22]WALTERS M,SIRCILI M P,SPERANDIO V.AI-3 Syntheses is not dependent on LuxS inEscherichiacoli[J].Journal of Bacteriology,2006,188(16):5668-5681.
[23]STEWART P S,COSTERTON J W.Antibiotic resistance of bacteria in biofilms[J].The Lancet,2001,358(9276):135-138.
[24]NG W L,BASSLER B L.Bacterial quorum-sensing network architectures[J].Annual Review of Genetics,2009,43(40):197-222.
[25]HENTZER M,WU H,ANDERSEN J B,et al.Attenuation ofPseudomonasaeruginosavirulence by quorum sensing inhibitors[J].The EMBO Journal,2003,22(15):3803-3815.
[26]VANDEPUTTE O M,KIENDREBEOGO M,RAJAONSON S,et al.Identification of catechin as one of the flavonoids fromCombretumalbiflorumbark extract that reduces the production of quorum-sensing-controlled virulence factors inPseudomonasaeruginosaPAO1[J].Applied and Environmental Microbiology,2010,76(1):243-253.
[27]ROY V,FERNANDES R,TSAO C Y,et al.Cross species quorum quenching using a native AI-2 processing enzyme[J].ACS Chemical Biology,2010,5(2):223-232.
[28]VON B B,WILLEY J M,DIGGLE S P.Cell-cell communication in bacteria:United we stand[J].Bacteriol,2008,190(13):4377-4391.
[29]RASMUSSEN T B,SKINDERSOE M E,BJARNSHOLT T,et al.Identity and effects of quorum-sensing inhibitors produced byPenicilliumspecies[J].Microbiology,2005,151(Pt 5):1325-1340.
[30]TEASDALE M E,LIU J,WALLACE J,et al.Secondary metabolites produced by the marine bacteriumHalobacillussalinusthat inhibit quorum sensing-controlled phenotypes in Gram-negative bacteria[J].Applied and Environmental Microbiology,2009,75(3):567-572.
[31]程古月,郝海红,戴梦红,等.病原菌的群体感应及其抑制剂的研究进展[J].科学通报,2012,57(21):1964-1977.
[32]REVERCHON S,CHANTEGREL B,DESHAYES C,et al.New synthetic analogues ofN-acyl homoserine lactones as agonists or antagonists of transcriptional regulators involved in bacterial quorum sensing[J].Bioorganic & Medicinal Chemistry Letters,2002,12(8):1153-1157.
[33]CASTANG S,CHANTEGREL B,DESHAYES C,et al.N-Sulfonyl homoserine lactones as antagonists of bacterial quorum sensing[J].Bioorganic & Medicinal Chemistry Letters,2004,14(20):5145-5149.
[34]GESKE G D,O′NEILL J C,MILLER D M,et al.Modulation of bacterial quorum sensing with synthetic ligands:Systematic evaluation ofN-acylated homoserine lactones in multiple species and new insights into their mechanisms of action[J].Journal of the American Chemical Society,2007,129(44):13613-13625.
[35]MUH U,SCHUSTER M,HEIM R,et al.NovelPseudomonasaeruginosaquorum-sensing inhibitors identified in an ultra-high-throughput screen[J].Antimicrobial Agents and Chemotherapy,2006,50(11):3674-3679.
[36]CHHABRA S R,HARTY C,HOOI D S,et al.Synthetic analogues of the bacterial signal (quorum sensing) moleculeN-(3-oxododecanoyl)-L-homoserine lactone as immune modulators[J].Journal of Medicinal Chemistry,2003,46(1):97-104.
[37]SMITH K M,BU Y,SUGA H.Library screening for synthetic agonists and antagonists of aPseudomonasaeruginosaautoinducer[J].Chemistry & Biology,2003,10(6):563-571.
[38]FAGERLIND M G,NILSSON P,HARLÉN M,et al.Modeling the effect of acylated homoserine lactone antagonists inPseudomonasaeruginosa[J].Biosystems,2005,80(2):201-213.
[39]MANEFIELD M,RASMUSSEN T B,HENZTER M,et al.Halogenated furanones inhibit quorum sensing through accelerated LuxR turnover[J].Microbiology,2002,148(Pt 4):1119-1127.
[40]HAN Y,HOU S,SIMON K A,et al.Identifying the important structural elements of brominated furanones for inhibiting biofilm formation byEscherichiacoli[J].Bioorganic & Medicinal Chemistry Letters,2008,18(3):1006-1010.
[41]JONES M B,JANI R,REN D,et al.Inhibition ofBacillusanthracisgrowth and virulence-gene expression by inhibitors of quorum-sensing[J].The Journal of Infectious Diseases,2005,191(11):1881-1888.
[42]HUME E B,BAVEJA J,MUIR B,et al.The control ofStaphylococcusepidermidisbiofilm formation andinvivoinfection rates by covalently bound furanones[J].Biomaterials,2004,25(20):5023-5030.
[43]TEDDER M E,NIE Z,MARGOSIAK S,et al.Structure-based design,synthesis,and antimicrobial activity of purine derived SAH/MTA nucleosidase inhibitors[J].Bioorganic & Medicinal Chemistry Letters,2004,14(12):3165-3168.
[44]RASKO D A,MOREIRA C G,LI D R,et al.Targeting QseC signaling and virulence for antibiotic development[J].Science,2008,321(5892):1078-1080.
[45]LI L,HOOI D,CHHABRA S R,et al.BacterialN-acylhomoserine lactone-induced apoptosis in breast carcinoma cells correlated with down-modulation of STAT3[J].Oncogene,2004,23(28):4894-4902.
[46]HOLDEN M G,CHHABRA S R,DE N R,et al.Quorum-sensing cross talk:Isolation and chemical characterization of cyclic dipeptides fromPseudomonasaeruginosaand other Gram-negative bacteria[J].Molecular Microbiology,1999,33(6):1254-1266.
[47]LI M,NI N,CHOU H T,et al.Structure-based discovery and experimental verification of novel AI-2 quorum sensing inhibitors againstVibrioharveyi[J].ChemMedChem,2008,3(8):1242-1249.
[48]KAUFMANN G F,SARTORIO R,LEE S H,et al.Revisiting quorum sensing:Discovery of additional chemical and biological functions for 3-oxo-N-acylhomoserine lactones[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(2):309-314.
[49]SHEN G,RAJAN R,ZHU J,et al.Design and synthesis of substrate and intermediate analogue inhibitors ofS-ribosylhomocysteinase[J].Journal of Medicinal Chemistry,2006,49(10):3003-3011.
[50]LYON G J,MAYVILLE P,MUIR T W,et al.Rational design of a global inhibitor of the virulence response inStaphylococcusaureus,based in part on localization of the site of inhibition to the receptor-histidine kinase,AgrC[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(24):13330-13335.
[51]KOREM M,GOV Y,KIRAN M D,et al.Transcriptional profiling of target of RNAⅢ-activating protein,a master regulator of staphylococcal virulence[J].Infection and Immunity,2005,73(10):6220-6228.
[52]HENTZER M,RIEDEL K,RASMUSSEN T B,et al.Inhibition of quorum sensing inPseudomonasaeruginosabiofilm bacteria by a halogenated furanone compound[J].Microbiology,2002,148(Pt 1):87-102.
Research Progress on Bacterial Quorum Sensing Inhibitors
SUN Qi,LIANG Jing-wei,WANG Lin,ZHANG Ting-jian,MENG Fan-hao
(DepartmentofMedicalChemistry,CollegeofPharmacy,ChineseMedicalUniversity,Shenyang110122,China)
Abstract:Bacteria can produce chemical signal molecules and secret them into the surrounding environment during their growth processes.When the number of signal molecules reaches to a certain threshold,the related genes expression,such as biofilm formation or bioluminescent,will be regulated,in order to adapt to such environmental changes.This phenomenon is called bacterial quorum sensing(QS).Using bacterial quorum sensing as a target,bacterial quorum sensing inhibitors(QSI) make pathogens lose pathogenicity by blocking the expression of harmful genes,whilst do not kill the normal bacteria or interfere with the normal physiological activity of bacteria,which providing a new antibacterial way for mankind.Research progress on signal molecules regulation system of bacterial quorum sensing system and bacterial quorum sensing inhibitors are reviewed in this paper.
Keywords:bacterial quorum sensing;signal molecule;regulation;bacterial quorum sensing inhibitor;structure-activity relationship
中图分类号:Q 935
文献标识码:A
文章编号:1672-5425(2016)02-0015-07
doi:10.3969/j.issn.1672-5425.2016.02.003
作者简介:孙琦(1989-),女,内蒙古通辽人,助教,研究方向:药物设计、合成及构效关系,E-mail:zgydsunqi@163.com;通讯作者:孟繁浩,教授,E-mail:fhmeng@cmu.edu.cn。
收稿日期:2015-10-21

