邻香兰素缩乙二胺希夫碱稀土配合物的合成与表征
胡应喜,马小童,丁士豪,郭小龙
(北京石油化工学院化学工程学院,北京 102617)
邻香兰素缩乙二胺希夫碱稀土配合物的合成与表征
胡应喜,马小童,丁士豪,郭小龙
(北京石油化工学院化学工程学院,北京 102617)
摘要:以邻香兰素缩乙二胺希夫碱与稀土硝酸盐为原料、无水乙醇为溶剂,在加热搅拌回流下合成了7种邻香兰素缩乙二胺希夫碱稀土配合物,并通过元素分析、XRD、IR、UV、摩尔电导率、TG-DTA等分析方法对其结构进行了表征。结果表明,配合物的化学式为[REL(NO3)2]NO3,金属离子与配体的化学计量比为1∶1;金属离子配位数为8,其中配体中的2个羟基氧原子和2个氮原子与金属离子配位,2个与金属离子以双齿配位;外界有1个;得到的配合物仍然具有吸收紫外线的能力,其热稳定性也较高。
关键词:邻香兰素;邻香兰素缩乙二胺希夫碱;稀土配合物;合成与表征
水杨醛衍生物类与胺类形成的希夫碱中含有具有孤对电子的O、N配位原子,能与许多金属离子形成稳定的配合物, 而某些配合物在化工、催化、药物、分析等方面有着特殊的性质和应用。近年来,有关希夫碱稀土配合物的研究较多[1-5],但有关邻香兰素缩乙二胺希夫碱与稀土金属形成的配合物的研究很少。作者以邻香兰素缩乙二胺希夫碱和稀土硝酸盐为原料、无水乙醇为溶剂合成了7种邻香兰素缩乙二胺希夫碱稀土配合物,并通过元素分析、XRD、IR、UV、摩尔电导率、TG-DTA等分析方法对其结构及性质进行了表征。
1实验
1.1试剂与仪器
乙二胺、N,N-二甲基甲酰胺、无水乙醇、氢氧化钠、乙二胺四乙酸二钠、六次甲基四胺、硝酸、盐酸、氨水、二甲酚橙,北京化工厂;邻香兰素,东京株式化学工业社;RE(NO3)3·6H2O(RE=La、Pr、Nd、Sm、Eu、Gd、Dy),天津津科精细化工研究所。以上试剂均为分析纯。
XD-2型X-射线粉末衍射仪,北京普析通用仪器有限责任公司;FlasHEA1112型元素分析仪,美国热电公司;VERCTOR22型红外光谱仪,德国BRUKER公司;HCT-1型DTA-TG-DTG同时分析仪,北京恒久科学仪器厂;UV-2800型紫外光谱仪,日立公司;HJ-580型电导率仪,上海精密仪器有限公司。
1.2方法
1.2.1配体邻香兰素缩乙二胺希夫碱(H2L)的合成
参照文献[6]合成H2L。元素分析(%):C65.78(65.85),H6.21(6.10),N8.34(8.54)。化学式为C18H20O4N2,熔点为166~167 ℃,与文献一致。
1.2.2邻香兰素缩乙二胺希夫碱稀土配合物的制备
将0.01mol的稀土硝酸盐用20mL无水乙醇搅拌溶解。将3.28g(0.01mol)配体H2L加入140mL无水乙醇中,加热搅拌,使其溶解。然后将稀土硝酸盐溶液慢慢滴加到配体H2L溶液中,即有黄色沉淀生成。继续加热搅拌回流(回流速度为2滴·s-1)2h。反应结束后,趁热抽滤,用无水乙醇洗涤2~3次,在90 ℃下干燥,即得邻香兰素缩乙二胺希夫碱稀土配合物(以下简称稀土配合物)。
1.2.3分析测试
采用元素分析仪、X-射线粉末衍射仪、红外光谱仪、紫外光谱仪、电导率仪及DTA-TG-DTG同时分析仪对样品进行组成分析和结构表征。
采用EDTA容量分析法测定稀土金属含量:称量一定质量的稀土配合物于250mL锥形瓶中,加入5mL6mol·L-1硝酸和15mL6mol·L-1的盐酸,于160~170 ℃加热溶解,冷却后用5mol·L-1氢氧化钠溶液调节pH值为4~5,加入10~15mL六次甲基四胺缓冲溶液、1~2滴0.5%二甲酚橙指示剂,用EDTA标准液进行滴定,溶液由紫红色变黄色即为终点。
2结果与讨论
2.1元素分析
稀土配合物的元素分析数据如表1所示。
表1稀土配合物的元素分析数据/%

Tab.1 Elemental analysis data of rare earth complexes/%
注:括号内为计算值。
由表1可知,元素分析实测值与计算值基本吻合,表明所合成配合物的组成为[REL(NO3)2]NO3。
2.2XRD分析
图1为配体H2L、Sm(NO3)3·6H2O及稀土配合物[SmL(NO3)2]NO3的XRD图谱。其它配合物的 XRD图谱与[SmL(NO3)2]NO3的图谱相似。
由图1可知,稀土配合物[SmL(NO3)2]NO3的衍射线位置(2θ)及衍射相对强度(I/I0)与配体H2L和Sm(NO3)3·6H2O的不同,也不是后两者衍射线的加合,表明配合物是新形成的配合物。
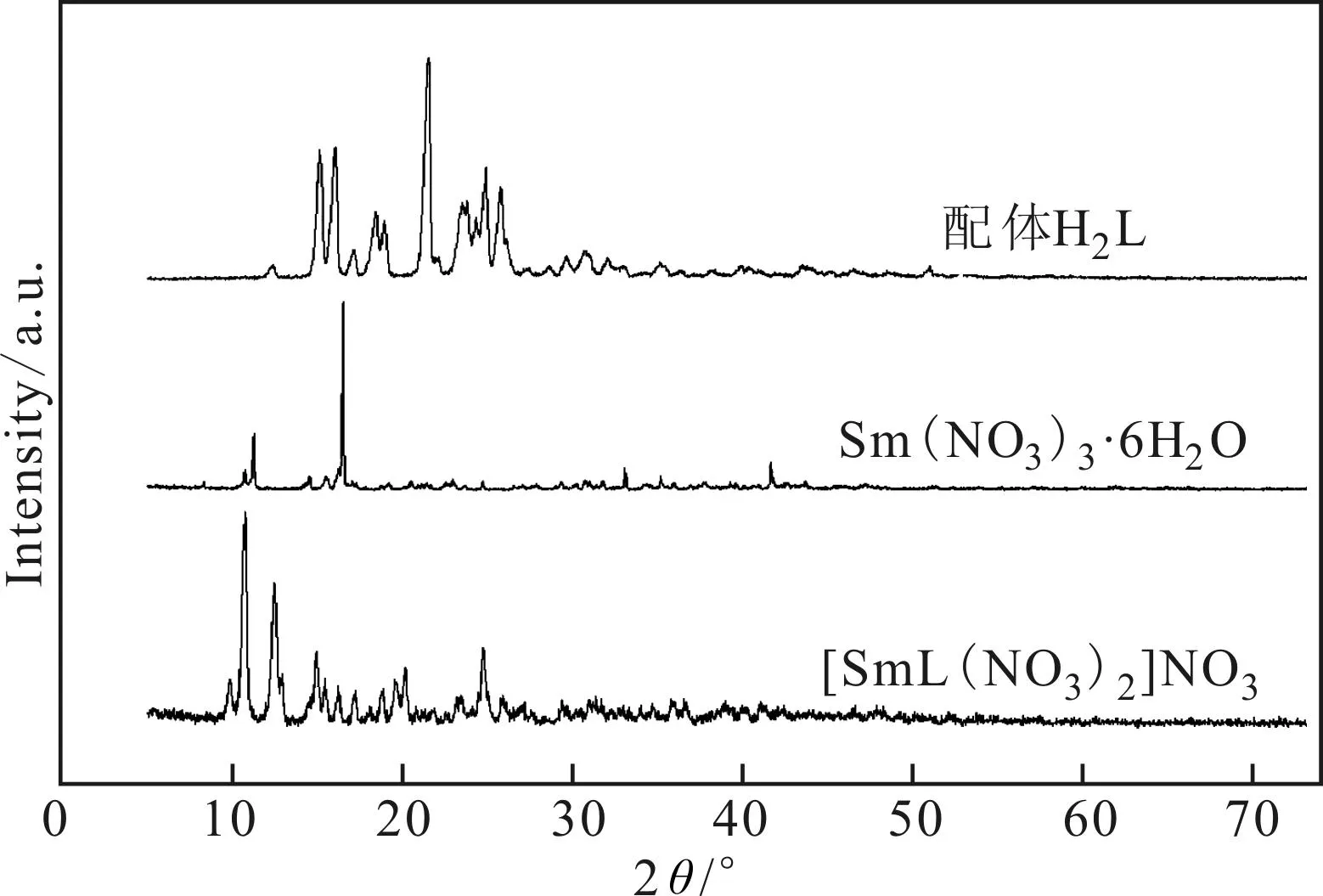
图1 化合物的XRD图谱
2.3IR分析
配体H2L及稀土配合物的红外光谱的特征吸收峰及其归属见表2。
表2 配体H2L及稀土配合物的红外光谱数据/cm-1
Tab.2IR Spectra data of H2L and rare earth complexes/cm-1

化合物νC=NνO-HνC-Oνsνas配体H2L163334431252--[LaL(NO3)2]NO316143422122314911316[PrL(NO3)2]NO316143422122814911317[NdL(NO3)2]NO316133420122814911317[SmL(NO3)2]NO316143423122614931321[EuL(NO3)2]NO316143422122814941324[GdL(NO3)2]NO316143418122614941325[DyL(NO3)2]NO316153422122814981325

2.4UV分析及摩尔电导率
浓度为1×10-3mol·L-1的配体H2L及稀土配合物在DMF溶液中的紫外光谱数据及在25 ℃时的摩尔电导率见表3。
由表3可知,配体H2L在276 nm和338 nm处产生强烈的吸收,其最大吸收峰在338 nm处;所有稀土配合物的紫外吸收峰与配体H2L的基本相似,在278~296 nm和351~370 nm处也产生强烈的吸收,其最大吸收峰在351~370 nm处;稀土配合物的2个吸收峰均较配体H2L发生不同程度的红移,说明稀土金属离子与配体H2L之间确有键合作用发生。
在25 ℃、1×10-3mol·L-1DMF溶液中,稀土配合物的摩尔电导率在 97.17~100.76 S·cm2·mol-1之间,均属1∶1电解质。
2.5TG-DTA分析(表4)
由表4可知,7种稀土配合物的TG-DTA数据相似。在330 ℃以前无任何失重,说明稀土配合物中不存在水分子或乙醇分子;稀土配合物在330~600 ℃有2个放热峰并伴有失重,这是由于,稀土配合物的分步氧化分解所致,但不同的配合物分解温度不同;完全分解产物为稀土氧化物,即残渣为RE2O3,残重率实测值与计算值基本相符,这与元素分析结果一致。
表3 配体H2L及稀土配合物的紫外光谱数据和摩尔电导率
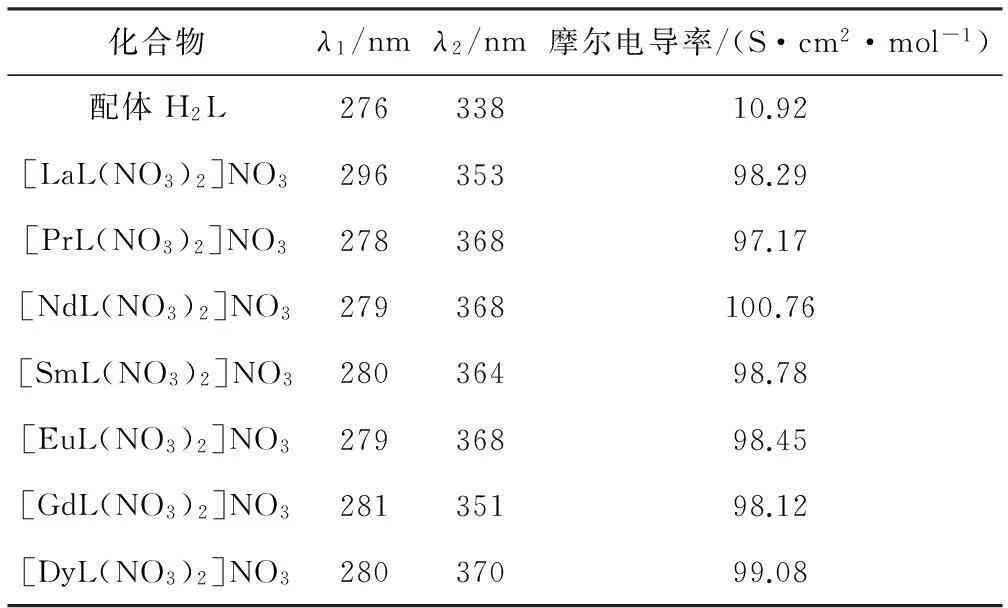
Tab.3 UV Spectra data and molar conductivity
表4 配体H2L及稀土配合物的TG-DTA数据
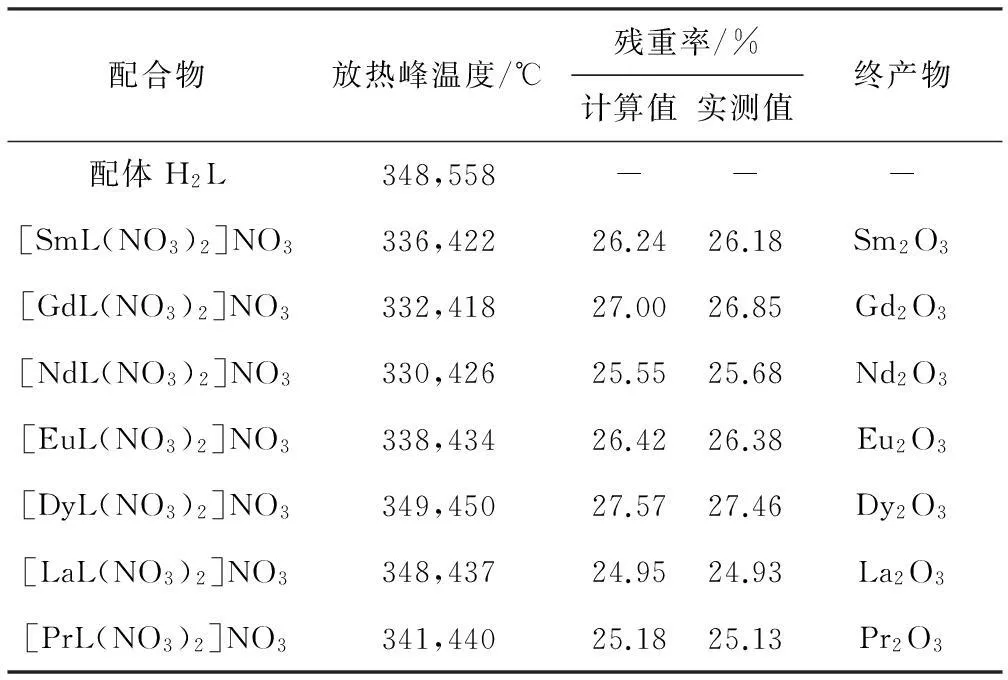
Tab.4 TG-DTA Data of H2L and rare earth complexes
通过以上表征和分析,可以确定配合物的化学式为[REL(NO3)2]NO3,稀土金属离子RE(Ⅲ)与配体H2L以1∶1结合。其结构可能是:

配体中的2个羟基氧原子和2个氮原子与稀土金属离子分别配位,另外还有2个分别与稀土金属离子以双齿配位,形成配合物的内界,稀土金属离子RE(Ⅲ)配位数为8,外界为1个。
3结论

参考文献:
[1]赵国良,李彬,那崇武,等.稀土与邻香兰素二胺类双Schiff碱配合物合成及其性质的研究[J].化学学报,1991,49(4):365-370.
[2]程桂英.稀土希夫碱配合物的合成与表征[D].南京:南京工业大学,2002.
[3]余玉叶.双水杨醛1,10-癸二胺Schiff碱稀土配合物的合成和表征[J].化学研究,2006,17(1):16-19.
[4]李晓东,杨玲娟,朱元成,等.稀土水杨醛Salphen希夫碱配合物的合成与表征[J].资源开发与市场,2012,28(1):3-5.
[5]章文军,张静,苑志忠.稀土氨基酸希夫碱配合物的合成及其荧光性能[J].化工进展,2011,30(7):1598-1601.
[6]那崇武,赵国良,刘国发,等.由邻香兰素和二胺类制备几种新的双希夫碱[J].吉林大学学报(理学版),1988,(2):103-107.
[7]梁映秋,赵永年,张树功,等.稀土冠醚配合物的激光拉曼和红外光谱[J].化学学报,1983,41(3):198-207.
Synthesis and Characterization of Rare Earth Complexes with Ethylenediamineo-Vanillin Schiff Base
HU Ying-xi,MA Xiao-tong,DING Shi-hao,GUO Xiao-long
(SchoolofChemicalEngineering,BeijingInstituteofPetrochemicalTechnology,Beijing102617,China)
Abstract:Using ethylenediamine o-vanillin Schiff base and rare earth nitrates as raw materials,anhydrous ethanol as a solvent,seven kinds of rare earth complexes with ethylenediamine o-vanillin Schiff base were synthesized by heating,stirring and refluxing.The structures of these complexes were characterized by elemental analysis,XRD,IR,UV,molar conductivity,TG-DTA analyses and so on.Results showed that these complexes had general chemical formula [REL(NO3)2]NO3,the stoichiometry of the complexes was found to be 1∶1 (metal∶ligand).The coordination number for metal ion was 8:two oxygen donor atoms from hydroxyl groups and two nitrogen donor atoms coordinated with central metal ion.In addition,two ions coordinated with the same metal ion in bidentate ligands,and the peripheral of the complex had single .The obtained complexes still had the ability to absorb ultraviolet rays with good thermal stability.
Keywords:o-vanillin;ethylenediamine o-vanillin Schiff base;rare earth complexes;synthesis and characterization
中图分类号:O 614.33
文献标识码:A
文章编号:1672-5425(2016)02-0035-03
doi:10.3969/j.issn.1672-5425.2016.02.007
作者简介:胡应喜(1963-),男,陕西咸阳人,教授,主要从事基础化学教学和精细化学品开发研究,E-mail:huyingxi040@sina.com。
收稿日期:2015-10-25
基金项目:2015年国家级大学生创新创业计划项目(2015J00090)

