绿色荧光蛋白标记杀鲑气单胞菌的构建及其初步应用
杜以帅, 张丽娜, 马晓娜, 肖 鹏, 孙 斌, 蔡碧莹, 王顺奎,于凯松, 刘 鹰
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 山东东方海洋科技股份有限公司, 山东 烟台 264003; 3. 青岛科技大学, 山东 青岛 266042; 4. 天津师范大学, 天津 300387)
绿色荧光蛋白标记杀鲑气单胞菌的构建及其初步应用
杜以帅1, 张丽娜1, 马晓娜1, 肖 鹏1, 孙 斌4, 蔡碧莹3, 王顺奎2,于凯松2, 刘 鹰1
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 山东东方海洋科技股份有限公司, 山东 烟台 264003; 3. 青岛科技大学, 山东 青岛 266042; 4. 天津师范大学, 天津 300387)
杀鲑气单胞菌(Aeromonas salmonicida)是引起疖疮病的典型致病细菌, 几乎可以侵染所有的鲑科(Aeromonas)鱼类, 为水产养殖业带来巨大的经济损失。本研究通过电击转化法将原核表达载体pGFPuv成功导入杀鲑气单胞菌C4菌株(AS-C4)中, 获得了绿色荧光蛋白标记的杀鲑气单胞菌菌株AS-C4GFP。AS-C4GFP菌株在氨苄青霉素抗性平板上生长良好, 并在紫外光下激发出较强的绿色荧光。通过荧光显微镜观察菌体和PCR检测gfp和杀鲑气单胞菌vapA基因, 表明gfp基因已经成功导入AS-C4中。用AS-C4GFP人工感染大西洋鲑(Salmo salar), 从死亡鱼的脾脏、肝脏、肾脏中均能分离出AS-C4GFP, AS-C4GFP在脾脏中最多。AS-C4GFP具有特异性和可视性, 为研究杀鲑气单胞菌对大西洋鲑的侵染途径提供了一种良好的生物材料。
杀鲑气单胞菌(Aeromonas salmonicida); 绿色荧光蛋白; 电转化; 大西洋鲑(Salmo salar)
杀鲑气单胞菌(Aeromonas salmonicida)属于气单胞菌属(Aeromonas), 可以侵染多种淡水和海水鱼类, 是造成水产养殖动物疾病爆发的一种典型细菌性病原[1]。杀鲑气单胞菌是引起鲑科鱼类发生疖疮病的一种致病细菌, 几乎所有的鲑科鱼类, 都可被杀鲑气单胞菌感染, 因此杀鲑气单胞菌对经济价值较高的鲑科鱼类产生严重危害, 也为养殖业带来巨大的经济损失[2-3]。
绿色荧光蛋白(green fluorescent protein, GFP)来源于水母, 具有在紫外光照射下即可激发出绿色荧光的特性[4]。GFP荧光具有检测灵敏性高、稳定性和特异性强、细胞毒性小等优点[5]。近年来将GFP标记细菌进行侵染动力学等方面的研究越发突显其优越性[6]。在水产养殖领域, 已经有将gfp基因转化迟缓爱德华氏菌(Edwardsiella tarda)、鳗弧菌(Vibrio anguillarum)和嗜水气单胞菌(Aeromonas hydrophila)等致病菌并研究其对宿主的侵染途径等相关致病机理的研究[6-9], 但是目前国内外仍未见将gfp基因转化杀鲑气单胞菌并将其应用于鲑科鱼类致病机理研究相关的报道。
本课题组从烟台东方海洋养殖车间具有典型疖疮病症状的发病大西洋鲑(Salmo salar)脾脏中分离出一株杀鲑气单胞菌, 通过电击转化法成功将带有gfp基因的pGFPuv载体转入杀鲑气单胞菌中, 并对菌体进行了荧光观察和gfp基因检测。进一步将gfp基因标记的杀鲑气单胞菌通过人工浸染的方式感染大西洋鲑, 在紫外灯下检测死亡大西洋鲑脾脏、肝脏和肾脏的平板划线结果, 并对不同组织中的细菌数目进行计数。本研究为GFP标签进行生物标记使菌落观察更具可视性和特异性提供数据支持, 也为进一步研究杀鲑气单胞菌对大西洋鲑的侵染途径这一重要领域提供更加便捷、可行的方法。
1 材料与方法
1.1 材料
杀鲑气单胞菌从山东东方海洋科技股份有限公司养殖的大西洋鲑患病个体脾脏中分离得到, 经过生理生化鉴定和16S rDNA测序分析, 命名为杀鲑气单胞菌C4菌株(AS-C4), 在中国普通微生物菌种保藏管理中心保藏编号为CGMCC No.7335。原核表达载体pGFPuv为商业化质粒, 具有氨苄青霉素抗性[10]。实验用大西洋鲑120尾为山东东方海洋科技股份有限公司烟台分公司提供, 平均体质量为113 g±20 g, 实验前在中国科学院海洋研究所养殖系统内暂养。养殖海水温度12℃, 每天换水1次, 早上投喂1次配合饲料, 大西洋鲑暂养3周后用于试验。
1.2 方法
1.2.1 用于电转化的AS-C4感受态的制备
挑取AS-C4菌株接种于LB液体培养基震荡至OD600值达到0.5~0.8时, 将菌液在冰上预冷30 min,随后于4℃, 2 500 r/min离心10 min, 用灭菌ddH2O洗涤两次(离心同上), 再使用10%甘油(灭菌, 预冷)重悬菌体两次(离心同上), 将10%甘油重悬的菌液以100 μL/管分装于1.5 mL的离心管中, –80℃冰箱中保存。
1.2.2 pGFPuv电转化AS-C4菌株
电转化的方法参照文献[11]。电击后取100 µL转化产物涂布含有氨苄青霉素(200 μg/mL)的LB平板, 28℃过夜培养, 次日查看转化结果。在紫外光下激发出绿色荧光的AS-C4菌株即GFP标记的杀鲑气单胞菌菌株, 命名为AS-C4GFP。
1.2.3 GFP标记的杀鲑气单胞菌菌株(AS-C4GFP)的检测
1.2.3.1 荧光检测
用接种环挑取少许单菌落菌体, 在荧光显微镜紫外通道下观察未转化gfp基因的杀鲑气单胞菌(AS-C4)和GFP标记的杀鲑气单胞菌AS-C4GFP, 并拍摄图片。
1.2.3.2 PCR检测
根据pGFPuv序列(NCBI accession no.U62636),利用Primer5.0软件设计用于检测gfp基因的引物pGFPuvF364和pGFPuvR971, 使用引物SV1与SV2[12]检测杀鲑气单胞菌的毒力基因vapA(EMBL accession no. M64655), 引物序列请见表1。挑取AS-C4GFP单菌落于10 μL灭菌水, 取1 μL为模板进行菌落PCR。PCR程序为: 94℃预变性10 min, 然后进行30个循环: 94℃变性30 s; 53℃退火30 s; 72℃延伸30 s, 最后72℃延伸5 min。PCR产物于1%琼脂糖凝胶电泳通过凝胶成像仪查看条带。
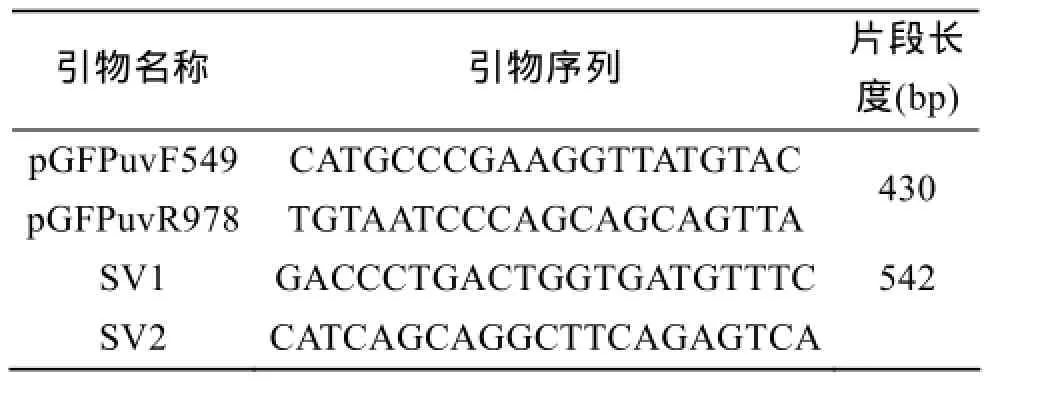
表1 引物序列Tab. 1 Primer sequences
1.2.3.3 质粒稳定性的检测
将AS-C4GFP无菌操作接种于LB液体培养基(氨苄青霉素200 μg/mL)培养过夜(28℃), 再将菌液接种于不含氨苄青霉素的LB液体培养基中培养, 每次接种量为1/1 000(v/v), 每24 h转接1次, 转接同时稀释菌液涂平板, 放置于28℃生化培养箱中培养48 h,在紫外灯下计数发绿色荧光的单菌落。质粒稳定率= (发绿色荧光菌落数/总菌落数)×100%。
1.2.4 AS-C4GFP在人工感染大西洋鲑实验中的初步应用
1.2.4.1 人工感染与组织取样
将120尾暂养后的大西洋鲑分为试验组和对照组, 每组各60尾。将AS-C4GFP于28℃含有氨苄青霉素的LB液体培养基中振荡培养18~24 h, 离心后将菌体用灭菌的海水稀释菌浓度为2.65×107cfu/mL海水。试验组大西洋鲑于100 L 2.65×107cfu/mL海水中浸泡1h后于正常海水养殖; 对照组于100 L天然海水中浸泡1 h后于正常海水养殖。实验开始后每隔4 h观察一次并捞出死亡大西洋鲑(以触碰其尾部身体5 s完全不动为死亡标准), 并记录死亡出现时间和观察疾病症状。对死亡的大西洋鲑取样, 无菌操作采集大西洋鲑的鳃、脾脏、肝脏、肾脏、肠道、皮肤和肌肉组织样品。
1.2.4.2 AS-C4GFP在死亡大西洋鲑脾脏、肝脏和肾脏中平板划线检测
无菌操作下, 用接种环对每条死亡的大西洋鲑脾脏、肝脏和肾脏进行平板划线, 分区划线于含有氨苄青霉素的LB营养琼脂平板(氨苄青霉素200 μg/mL),置于28℃生化培养箱中培养48 h。在紫外灯下观察发绿色荧光的菌落。
1.2.4.3 AS-C4GFP在死亡大西洋鲑各组织中的数目
将采集的死亡大西洋鲑(N=4)的鳃、脾脏、肝脏、肾脏、肠道、鱼皮和肌肉组织样品称质量后用灭菌的生理盐水洗涤, 并按照1︰10(m/v)比例加入灭菌生理盐水进行匀浆。将匀浆液用灭菌生理盐水分别稀释10倍、100倍, 取2个梯度的稀释液各100 μL均匀涂布于含有氨苄青霉素的LB营养琼脂平板(含有氨苄青霉素200 μg/mL), 置于28℃生化培养箱中培养48 h。在紫外灯下观察发绿色荧光菌落的数目, 并计数。
2 结果
2.1 电转化后AS-C4GFP的筛选和纯化
通过电击转化的方式将pGFPuv转化进入杀鲑气单胞菌, 成功转化的杀鲑气单胞菌菌株即(ASC4GFP)会在紫外光下激发出绿色荧光。挑取发绿色荧光的AS-C4GFP单菌落继续在含有氨苄青霉素的LB营养琼脂平板上分离纯化, 最终纯化后的AS-C4GFP单菌落在紫外激发下均发出绿色荧光(图1)。
2.2 AS-C4GFP的荧光检测
用接种环挑取少许AS-C4GFP单菌落菌体, 在荧光显微镜紫外通道下观察, 所有的菌体在紫外激发下均发出绿色荧光(图2A), 说明gfp基因已经成功转入杀鲑气单胞菌; 而未转化gfp基因的在杀鲑气单胞菌(AS-C4)在紫外激发下无绿色荧光(图2B)。
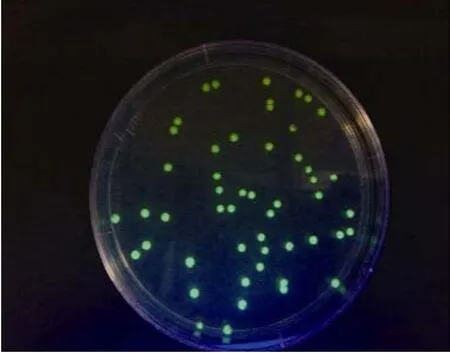
图1 电转化后AS-C4GFP菌株的纯化Fig. 1 Purification (B) of AS-C4GFPafter electroporation

图2 GFP标记的AS-C4GFP发光菌体Fig. 2 Cells of GFP-tagged A. salmonicida strain AS-C4GFPA. AS-C4GFP; B. AS-C4
2.3 AS-C4GFP的PCR检测
PCR检测结果(图3): 从AS-C4GFP既可以扩增出杀鲑气单胞菌的毒力基因vapA的片段(542 bp), 也可以扩增出gfp基因的片段(430 bp), 并且与预期的片段大小一致, 说明gfp基因已经成功转入杀鲑气单胞菌。
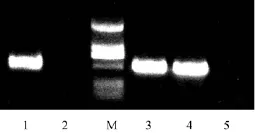
图3 PCR检测GFP标记的AS-C4GFPFig. 3 PCR amplification of vapA and gfp gene fragmentsfrom GFP-tagged AS-C4GFP
2.4 质粒稳定性检测
AS-C4GFP在LB液体培养基中连续传代6次, 质粒的表达仍为100%, 第7代略有下降, 但是质粒的表达率仍为95%, 说明AS-C4GFP质粒的稳定性较好。
2.5 AS-C4GFP人工感染大西洋鲑实验结果
2.5.1 死亡大西洋鲑脾脏、肝脏和肾脏中平板划线检测AS-C4GFP
整个人工感染实验期间对照组均没有出现死亡现象, 试验组大西洋鲑在攻毒后第7天开始出现死亡现象, 并持续到12 d。死亡大西洋鲑均表现出典型的疖疮病症状, , 对死亡的大西洋鲑在脾脏、肝脏和肾脏组织平板划线均检测出AS-C4GFP菌落, 在紫外灯下均发出较强的绿色荧光(图4)。

表2 AS-C4GFP稳定性检测结果Tab. 2 Results of AS-C4GFPstability experiment
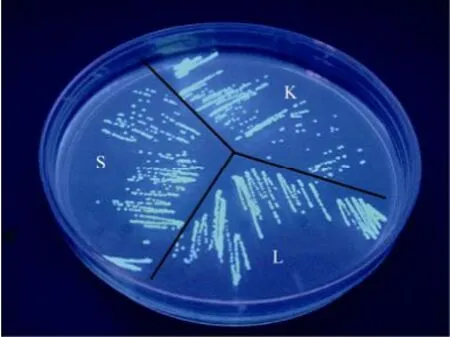
图4 死亡大西洋鲑脾脏、肝脏和肾脏中AS-C4GFP的检测结果Fig. 4 Detection of AS-C4GFPin the spleen, liver, and kidney of dead Atlantic salmon
2.5.2 AS-C4GFP在死亡大西洋鲑不同组织中的数目
死亡大西洋鲑(N=4)各个组织中均检测到ASC4GFP, 其中脾脏中数目最多, 达到2.6×107CFU/g组织,其次是肾脏、肝脏、鳃、皮肤、肠道和肌肉(图5)。
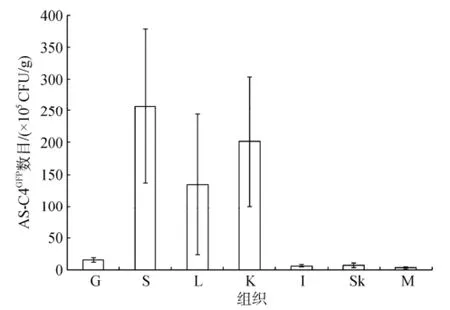
图5 AS-C4GFP在死亡大西洋鲑不同组织中的数目Fig. 5 Numbers of AS-C4GFPin different tissue samples of dead Atlantic salmon
3 讨论
原核表达载体pGFPuv可以使被转化的细菌具有氨苄青霉素抗性, 并且能够表达GFP蛋白, 这两种标记可以使转化成功的细菌很容易在氨苄青霉素抗性平板中筛选出来。在进行电转化实验后, 作者成功筛选到转化了gfp基因的杀鲑气单胞菌(AS-C4GFP),纯化后的AS-C4GFP菌落在紫外灯下发出较强的绿色荧光(图1)。通过荧光显微镜观察, AS-C4GFP菌体也能激发出较强的荧光(图2)。利用PCR进行杀鲑气单胞菌毒力基因vapA和gfp基因片段的检测, 扩增片段均符合预期(图3)。以上结果均表明pGFPuv已经成功转化到杀鲑气单胞菌中。李静等[13]尝试将质粒pFPV25.1(羧卞青霉素抗性)转化嗜水气单胞菌(A. hydrophila), 但是由于其研究的嗜水气单胞菌菌株具有羧卞青霉素抗性, 导致筛选手段繁琐最终没有筛选到GFP标记的嗜水气单胞菌; 利用改造后的质粒pWSK129(卡那霉素抗性)转化嗜水气单胞菌, 最终成功筛选到GFP标记的嗜水气单胞菌。夏飞等[14]将质粒pEGFPuv进行抗性改造后, 转化至嗜水气单胞菌使其具有GFP标记。GFP对杀鲑气单胞菌和嗜水气单胞菌等水产养殖中常见病原菌的成功标记,使这些病原菌致病机理的相关研究变得更加便捷。
本研究采用的转化方法为电击转化法, 电击转化方法的转化率较高, 是常见的一种转化方法。与经典的化学转化方法和原生质体转化方法相比, 电击转化法具有操作简便快速、高效、可重复等优点, 转化后的细胞可以很好地存活生长, 因此该技术可用于动物、植物和微生物等各类细胞中[15]。近几年已经有将外源荧光标签通过电击转化法转化水产养殖动物病原菌的报道。李静等[13]将含有gfp基因的pWSK129质粒电转化至嗜水气单胞菌无毒株Ah4332和强毒株AhJ-1, 无毒株Ah4332传至70代, 质粒稳定率仍可达100%; 而强毒株AhJ-1在同样条件下培养10代后, 质粒稳定率急剧下降。Wang等[9]将质粒pFPV25.1通过电转化的方式转化迟钝爱德华菌(E. tarda), 转化后的菌株和原来的菌株保持相似的毒性,并且连续传代7d后质粒稳定率仍可达100%。本研究通过电击转化法将pGFPuv成功转化AS-C4GFP, 转化后的质粒在第7d时仍然保持非常高的遗传稳定性。虽然细菌长期传代后质粒的稳定性有所降低, 但是细菌侵染路径研究的周期一般都在一周以内, 因此质粒稳定性的降低对细菌侵染路径研究影响较小。
传统的研究病原菌的侵染动力学方法, 主要是通过平板培养测定不同侵染器官中含有的病原菌数目, 这是一种间接的方法并且可能使计算出的细菌数目存在偏差; 放射性标记的细菌可以被定量, 但是这种方法不能区分活的和死亡的细菌[8]。本研究中通过电击转化法使杀鲑气单胞菌具有GFP标记和氨苄青霉素抗性两种标签, 使杀鲑气单胞菌很容易和其他细菌区分, 使结果更准确和更具有特异性。在死亡的大西洋鲑脾脏、肝脏和肾脏平板划线检测结果中, 平板上都可以分离出病原菌, 并且分离的病原菌在紫外灯下均发出较强的绿色荧光, 可视性极强。在本研究中, 侵染了杀鲑气单胞菌的大西洋鲑不同组织中, 均检测到AS-C4GFP, 并且死亡大西洋鲑表面具有疖疮, 这与杀鲑气单胞菌侵染鲑科鱼类引起全身性感染并引发疖疮病[16]的结论一致; 脾脏中AS-C4GFP数目最多, 这与脾脏是杀鲑气单胞菌最主要的影响器官的结论也相符[17]。Ling等[6]将转化了gfp基因的迟缓爱德华氏菌浸泡攻毒蓝曼龙(T. trichopterus), 通过组织学和侵染动力学研究表明胃肠道、鳃和鱼体表是毒性迟缓爱德华氏菌的侵染入口。Toole等[7]将gfp基因标记的鳗弧菌(V. anguillarum)浸泡感染斑马鱼(Danio rerio), 在共聚焦荧光显微镜下观察发现, 斑马鱼胃肠道和皮肤中均感染了发绿色荧光的鳗弧菌。Wang等[9]用GFP标记的迟缓爱德华菌感染斑马鱼, 发现斑马鱼感染迟缓爱德华菌后,该菌先后在肠道、鳃和皮肤中定植。因此GFP作为一种外源的荧光标签, 提供了一种使细菌可视化并且可以追踪他们在宿主细胞内活性的途径[18]。对于水产养殖业的一些病原菌, 有研究将浸泡攻毒和GFP标记方法相组合, 认为这是一种比较好的研究病原与宿主相互作用的工具[6]。这种组合可以识别病原菌的侵染路径, 识别参与侵染过程的基因, 是一种评价疫苗和明确侵染部位、靶向器官和存留器官的良好实验设计。虽然使用GFP标记病原菌已经成功应用于病原菌对斑马鱼、蓝曼龙、黑鲷(Sparus macrocephalus)和欧鲈(Dicentrarchus labrax)等鱼类侵染路径的研究中, 但是也存在GFP荧光与动物组织自发荧光难以区分的情况。Rekecki等[19]用GFP标记鳗弧菌研究其在欧鲈幼苗肠道中的定位, 虽然欧鲈幼苗组织自发荧光与GFP荧光相似, 但是通过调节荧光显微镜和共聚焦荧光显微镜的参数还是成功将GFP荧光和组织自发荧光相区分。随着科技的进步和荧光显微镜的改进, GFP荧光与动物组织自发荧光的区分将变得越来越容易。
4 结论
本研究利用电击转化法成功将pGFPuv导入杀鲑气单胞菌C4菌株中, 转化后的AS-C4GFP菌株在抗性平板上生长良好, 并在紫外灯下激发出较强的绿色荧光。利用荧光显微镜观察菌体和PCR验证, 均表明gfp基因已经成功标记杀鲑气单胞菌。在AS-C4GFP人工感染大西洋鲑的实验中, 死亡大西洋鲑脾脏、肝脏、肾脏中均能划线培养出AS-C4GFP, 并且利用平板计数方法可以更方便快捷的检测出AS-C4GFP在大西洋鲑不同组织中的分布, 结果也更具有特异性。以上结果证明AS-C4GFP具有特异性和可视性, 为研究杀鲑气单胞菌对大西洋鲑的侵染途径提供了一种良好的生物材料。
[1] Wiklund T, Dalsgaard I. Occurrence and significance of atypical Aeromonas salmonicida in non-salmonid and salmonid fish species: a review[J]. Diseases of Aquatic Organisms, 1998, 32(1): 49-69.
[2] Blazer V. Bacterial fish pathogens[J]. Environmental Biology of Fishes, 1988, 21(1): 77-79.
[3] Møyner K, Røed K H, Sevatdal S, et al. Changes in non-specific immune parameters in Atlantic salmon, Salmo salar L., induced by Aeromonas salmonicida infection[J]. Fish & Shellfish Immunology, 1993, 3(4): 253-265.
[4] Chalfie M, Tu Y, Euskirchen G, et al. Green fluorescent protein as a marker for gene expression[J]. Science, 1994, 263(5148): 802-805.
[5] 吴沛桥, 巴晓革, 胡海, 等. 绿色荧光蛋白GFP的研究进展及应用[J]. 生物医学工程研究, 2009, 28(1): 83-86. Wu Peiqiao, Ba Xiaoge, Huhai, et al. Research progress and application of green fluorescent protein[J]. Journal of Biomedical Engineering Research, 2009, 28(1): 83-86.
[6] Ling S H M, Wang X H, Lim T M, et al. Green fluorescent protein-tagged Edwardsiella tarda reveals portal of entry in fish[J]. FEMS Microbiology Letters, 2001, 194(2): 239-243.
[7] O'Toole R, von Hofsten J, Rosqvist R, et al. Visualisation of zebrafish infection by GFP-labelled Vibrio anguillarum[J]. Microbial Pathogenesis, 2004, 37(1): 41-46.
[8] Chu W H, Lu C P. In vivo fish models for visualizing Aeromonas hydrophila invasion pathway using GFP asa biomarker[J]. Aquaculture, 2008, 277(3-4): 152-155. [9] Wang X P, Yan M C, Hu W L, et al. Visualization of Sparus macrocephalus infection by GFP-labeled Edwardsiella tardal[J]. Israeli Journal of Aquaculture-Bamidgeh, 2012, 64 7.
[10] Crameri A. Improved green fluorescent protein by molecular evolution using DNA shuffling[J]. Nature Biotechnology, 1996, 14(3): 315-319.
[11] Tombolini R, Unge A, Davey M E, et al. Flow cytometric and microscopic analysis of GFP-tagged Pseudomonas fluorescens bacteria[J]. Fems Microbiology Ecology, 1997, 22(1): 17-28.
[12] Rattanachaikunsopon P, Phumkhachorn P. Detection of Aeromonas salmonicida by reverse transcription-multiplex polymerase chain reaction[J]. Bioscience Biotechnology and Biochemistry, 2012, 76(4): 665-670.
[13] 李静, 张晓露, 刘永杰, 等. 绿色荧光蛋白基因标记嗜水气单胞菌的研究[J]. 畜牧与兽医, 2009, 41(3): 1-4. Li Jing, Zhang Xiaolu, Liu Yongjie, et al. Genetically marking of Aeromonas hydrophila strains with green fluorescent protein gene[J]. Animal Husbandry and Veterinary Medicine, 2009, 41(3): 1-4.
[14] 夏飞. 团头鲂源嗜水气单胞菌分离鉴定、检测及绿色荧光蛋白标记菌株的构建[D]. 南京: 南京农业大学, 2012: 1-78. Xia Fei. Identification, detection and construction of green fluorescent protein marker strains of pathogenic Aeromonas hydrophila isolated from Megalobrama amblycephala[D]. Nanjing: Nanjing Agricultural University, 2012: 1-78.
[15] 唐岩, 唐军民, 战军, 等. 树突状细胞电转染的优化条件及影响因素[J]. 解剖学报, 2007, 38(2): 209-212. Tang Yan, Tang Junmin, Zhan Jun, et al. The influential factors and optimum conditions of electric transfection on dendritic cells[J]. Acta Anatomica Sinica, 2007, 38(2): 209-212.
[16] Mulder I E, Wadsworth S, Secombes C J. Cytokine expression in the intestine of rainbow trout (Oncorhynchus mykiss) during infection with Aeromonas salmonicida[J]. Fish & Shellfish Immunology, 2007, 23(4): 747-759.
[17] Ferguson H W, McCarthy D H. Histo-pathology of furunculosis in Brown trout Salmo trutta L. [J]. Journal of Fish Diseases, 1978, 1(2): 165-174.
[18] Monack D, Ramakrishnan L, Falkow S, et al. Applications for green fluorescent protein (GFP) in the study of hostpathogen interactions[J]. Gene, 1996, 173(1): 47-52.
[19] Rekecki, A, Gunasekara R A Y S A, Dierckens K, et al. Bacterial host interaction of GFP-labelled Vibrio anguillarum HI-610 with gnotobiotic sea bass, Dicentrarchus labrax (L.), larvae[J]. Journal of Fish Diseases, 2012, 35(4): 265-273.
Received:Dec. 24, 2015
Construction and application of green fluorescent protein for Aeromonas salmonicida strain
DU Yi-shuai1, ZHANG Li-na1, MA Xiao-na1, XIAO Peng1, SUN Bin4, CAI Bi-ying3, WANG Shun-kui2, YU Kai-song2, LIU Ying1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Shandong Oriental Ocean Sci-Tech Co., Ltd., Yantai 264003, China; 3. Qingdao University of Science and Technology, Qingdao 266042, China; 4. Tianjin Normal University, Tianjin 300387, China)
Aeromonas salmonicida; green fluorescent protein; electroporation; Salmo salar
Aeromonas salmonicida is a typical causative agent of furunculosis in salmonids and causes considerable economic loss in salmonid farms. In this study, we used electroporation to transform a pGFPuv plasmid into the A. salmonicida C4 strain and successfully obtained a green fluorescent protein (GFP)-tagged strain AS-C4GFP. The AS-C4GFPstrain grew well on plates with ampicillin and could be easily identified as bright green fluorescing colonies under UV light. The results from viewing AS-C4GFPunder a fluorescent microscope as well as our polymerase chain reaction (PCR) detection of gfp and vapA verified that we had successfully transformed pGFPuv into A. salmonicda. In an artificial infection experiment, we used the streak plate method to isolate AS-C4GFPfrom the spleen, liver, and kidney of dead Atlantic salmon (Salmo salar) and the results showed the spleen to have the most AS-C4GFP. GFP-tagged AS-C4GFPmade A. salmonicida more easily and specifically detectable, thus providing good biological material for the study of the infection route of A. salmonicida in Atlantic salmon.
S941.42
A
1000-3096(2016)12-0030-06
10.11759/hykx20151224002
(本文编辑: 谭雪静)
2015-12-24;
2016-05-10
第56批中国博士后科学基金(2014M560580); 山东省博士后创新基金(201402005); 国家自然科学基金(31472312, 41306152, 31402283); 青岛市创新创业人才计划项目(13-CX-16)
[Foundation: the 56th China Postdoctoral Science Foundation, No.2014M560580; Postdoctoral Innovation Project Special Funds of Shandong Province, No. 201402005; National Natural Science Foundation of China, No. 31472312, No. 41306152, No. 31402283; Qingdao Innovation Talents Program No.13-CX-16]
杜以帅(1985-), 男, 山东枣庄人, 助理研究员, 主要从事鱼类病害预防与预警研究, E-mail: duyishuai@qdio.ac.cn; 刘鹰, 通信作者, 电话: 0532-82898919, E-mail: yinliu@qdio.ac.cn

