羊栖菜多糖的提取和抗氧化活性研究
何 丹, 张 旭, 肖保衡, 吴晓辉, 吴明江
(温州大学 生命与环境科学学院, 浙江 温州 325035)
羊栖菜多糖的提取和抗氧化活性研究
何 丹, 张 旭, 肖保衡, 吴晓辉, 吴明江
(温州大学 生命与环境科学学院, 浙江 温州 325035)
羊栖菜(Sargassum fusiforme)是一种有“长寿菜”美誉的经济藻类, 其中的多糖成分具有良好的抗氧化活性。本文依次用冷水和热水处理羊栖菜藻粉, 得到两种多糖: 冷水浸提多糖(SFCP)和热水煮提多糖(SFHP); 随后对这两种多糖的理化性质进行比较, 并通过测定二者对DPPH和羟自由基的清除能力评价其抗氧化活性。结果表明, 两种多糖都是含有硫酸根的岩藻聚糖, 但是SFCP中糖醛酸含量较高,分子质量分布集中, 而SFHP中硫酸根含量较多, 分子质量分布较宽, 且二者硫酸根取代位置不同。两种多糖对DPPH和羟自由基均有一定的清除效果, 且清除率与浓度存在剂量依赖关系。相比较而言, SFCP对自由基的清除效率较好。
羊栖菜; 多糖; 抗氧化
羊栖菜(Sargassum fusiforme)是褐藻门马尾藻属的藻类植物之一, 在辽东半岛、雷州半岛均有分布,以浙江沿海最多, 在日本, 称其为“长寿菜”[1]。《神农本草经》中记载了羊栖菜的食用价值和药用价值; 现今已有大量报道, 这种含有硫酸化多糖的羊栖菜, 有抗凝血、降血脂、抗氧化、调节免疫等生物学功能[2]。
外界和内在的因素会引起体内氧化物质积累,引发氧化损伤, 例如缺血再灌注后, 造成大鼠体内急性氧化损伤, 不同的自由基含量增加, 抗氧化系统酶活力下降[3]; 在高脂血症大鼠中, 体内氧化产物如丙二醛的含量增加[4]。硫酸化多糖能够提升机体抗氧化系统的保护作用, 减缓多种疾病的发生。研究表明硫酸化的羊栖菜多糖可以通过升高体内超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)等抗氧化酶的酶活力, 降低脂质氧化产物、活性氧水平[5]。Ye等[6]研究褐藻麒麟藻中提取的硫酸化多糖, 可以清除肿瘤细胞中产生的H2O2, 抑制肿瘤细胞的侵袭。红藻鹿角菜中的硫酸化多糖可以清除DPPH自由基、羟自由基, 起到抗氧化作用[7]。硫酸化多糖是一种很好的抗氧化剂, 在不同的方面发挥抗氧化作用。
文献报道的羊栖菜硫酸化多糖多采用热水煮提的方法制备, 该法提取的多糖产率较高, 并且具有多种生物活性, 但是产物水溶性有限, 颜色较深, 同时高温对多糖等活性物质有一定的分解风险, 并且重复性稍差。而冷水浸提对多糖的原始结构影响较小, 有利于解读多糖的结构、活性和其修饰物的研究;其次, 对扩大其活性多糖的生产工艺有利。并且采用冷水浸提法制备羊栖菜多糖尚未见报道。因此, 本研究依次采用冷水浸提和热水煮提法制备羊栖菜多糖,并对其理化性质和抗氧化活性进行研究, 以期为羊栖菜活性多糖的提取工艺、结构和生物功能的挖掘奠定基础。
1 材料与方法
1.1 主要材料和试剂
羊栖菜由浙江省洞头县羊栖菜养殖地提供。
1, 1-二苯基-2-三硝基苯肼(DPPH), D-葡萄糖醛酸(GlcA), Sigma; 右旋糖酐标样, D-甘露糖(Man), D-木糖(Xyl), 中国药品生物制品鉴定所; L-鼠李糖(Rha), D-半乳糖醛酸(GalA), 国药集团化学试剂有限公司; D-葡萄糖(Glc), TCI; D-半乳糖(Gal), L-阿拉伯糖(Ara), Dr.Ehrenstorfer GmbH; L-岩藻糖(Fuc), FlukaBioChemika等。
1.2 主要仪器和设备
1525高效液相色谱仪, Waters科技有限公司; T6紫外-可见分光光度计, 北京普析通用仪器有限公司; TENSOR27红外光谱仪, Bruker光谱仪器公司; Milli-Q超纯水仪, MILLIPORE公司; ICS-1000离子色谱仪, 戴安公司等。
2 实验方法
2.1 多糖提取
冷水提取羊栖菜多糖: 首先, 羊栖菜粉碎成末, 95%乙醇, 80, ℃回流脱脂3次(2 h/次), 得到脱脂藻粉; 其次, 按照蒸馏水: 脱脂藻粉=30︰1(V/m)的料液比, 室温搅拌, 过滤得到提取液, 经过适当浓缩后,加入2%氯化钠和95%乙醇搅拌1 h后, –20℃放置48h; 最后, 离心(3000 r/min, 离心10 min)收集沉淀并复溶于蒸馏水中, 透析(截留分子质量14000 Da),透析液经浓缩, 减压冻干, 获得冷水提取羊栖菜多糖(SFCP)。
热水提取羊栖菜多糖[8]: 首先, 将上述浸泡过的料渣, 按照相同的料液比, 80℃煮提3次, 煮提时间分别为4、3、2 h, 过滤后将提取液合并浓缩; 其次, 80%乙醇沉淀过夜, 离心, 收集沉淀, 依次用95%的乙醇, 无水乙醇, 丙酮洗涤沉淀, 再经45℃减压干燥; 最后, 配置成5%水溶液, 加入氯化钙溶液, 离心后得上清, 进行透析, 后续步骤同上, 获得热水提取羊栖菜多糖(SFHP)。
2.2 理化性质的测定
以葡萄糖为标准单糖, 用苯酚硫酸法测定样品的总糖含量[9]。以半乳糖醛酸为标准糖醛酸, 用间羟基联苯法测定样品的糖醛酸含量[10]。牛血清白蛋白为标准品, 用考马斯亮蓝法测定样品中蛋白含量[11]。
将九种单糖(Glc、Gal、Ara、Rha、Xyl、Man、Fuc、GalA、GlcA)经过PMP(1-苯基-3-甲基-5-吡唑啉酮)衍生化处理后作为标准对照品, 选用Waters HPLC系统(1525泵, 2487双波长紫外可见检测器, 717自动进样器), ThermoHypersil ODS-2色谱柱(4.6 mm× 250mm)进行分析, 将多糖完全酸水解为单糖后, 经过同样衍生化处理, HPLC分析其单糖组成[12]。以硫酸钠做标准曲线, 选用ISC-100离子色谱仪测定硫酸根含量[13]。以中国生物制品所右旋糖苷为分子质量标准品, 采用高效凝胶渗透色谱法(HPGPC)对多糖进行分子量测定[14]。选用DEAE-Sepharose CL-6B离子交换层析测定多糖样品的极性分布。选用干燥样品加入KBr压片, FT-IR检测4000 cm–1~400 cm–1范围红外吸收特征[15]。
2.3 抗氧化能力的测定
清除DPPH自由基[16], 每支试管中加入0.1 mmol/L DPPH溶液1 mL, 无水乙醇1 mL, 待测样品溶液1 mL (样品溶液分别为: SFCP浓度为0.18、0.36、0.72、1.08、1.44 g/L; SFHP浓度为0.15、0.3、0.6、0.9、1.2、1.5 g/L), 混匀后避光静置30 min, 在517 nm处测定反应液吸光值。根据公式计算样品的自由基清除率。
清除羟自由基[17], 每支试管中加入9 mmol/L硫酸亚铁溶液1 mL, 9 mmol/L水杨酸溶液1 mL, 待测样品溶液1 mL(SFCP或SFHP浓度为1、2、4、6、8、10 g/L)。最后加入8.8 mmol/L过氧化氢溶液1 mL, 37℃水浴1 h, 去离子水调零, 在510 nm处测定反应液吸光值。
二种测定方法分别平行测定3次。以维生素C(Vc)作为阳性对照组。
二者的自由基清除率的计算公式为:

式中, A0: 不加待测样品溶液的吸光度值; Ax: 加入不同浓度待测样品的吸光度值; Ax0: 样品的本底吸收值。
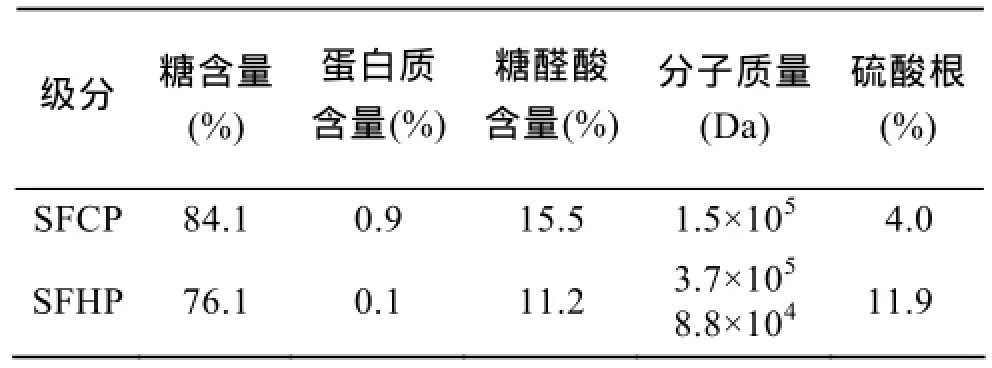
表1 冷热提取羊栖菜多糖特征性质Tab. 1 Characteristics of SFCP and SFHP
3 结果分析
3.1 多糖的提取和理化性质分析
羊栖菜经过冷浸、乙醇沉淀和氯化钙除褐藻胶后, 得冷提羊栖菜多糖(SFCP), 产率是6.6%; 冷提后的藻渣再经过热水煮提、乙醇沉淀和氯化钙除褐藻胶, 获得热提羊栖菜多糖(SFHP), 产率是1.8%。含量分析如表1所示, 两种多糖组分中只含有微量蛋白(<1%)。SFCP的糖和糖醛酸含量较高(分别是82.1%和15.5%), 而硫酸根的含量较少(4%), SFHP的糖和糖醛酸含量稍低(分别是76.1%和11.2%), 而硫酸根含量较多(11.9%)。
高效凝胶渗透色谱如图1所示。SFCP的分子质量分布较集中, 分子质量为1.5×105Da; 而SFHP的分子质量分布比较分散, 显示出两个主要的未完全分离的洗脱峰, 分别为3.7×105Da和8.8×104Da。在煮提过程中, 温度可能破坏多糖的结构, 预示应用凝胶色谱法对SFHP进一步纯化比较困难。
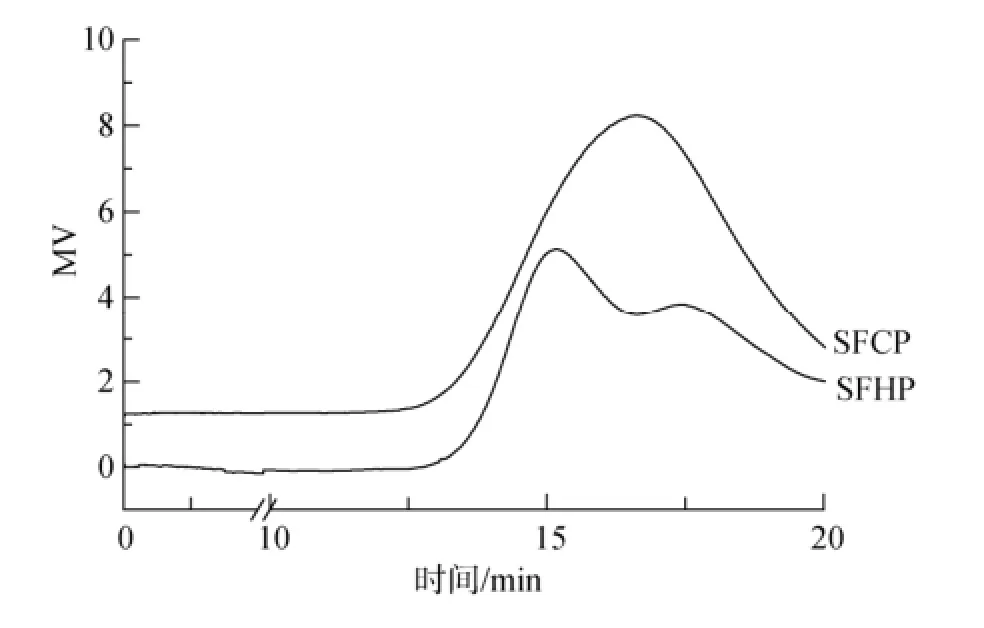
图1 冷热提取羊栖菜多糖分子质量Fig. 1 Molecular weights of SFCP and SFHP
单糖组成分析如表2所示。这两种多糖组分都是以岩藻糖为主, 并含有一定量的半乳糖, 同时含有少量的甘露糖、鼠李糖、葡萄糖、木糖、葡萄糖醛酸和半乳糖醛酸。SFCP中岩藻糖含量较SFHP少,而其他单糖的含量稍高一些。
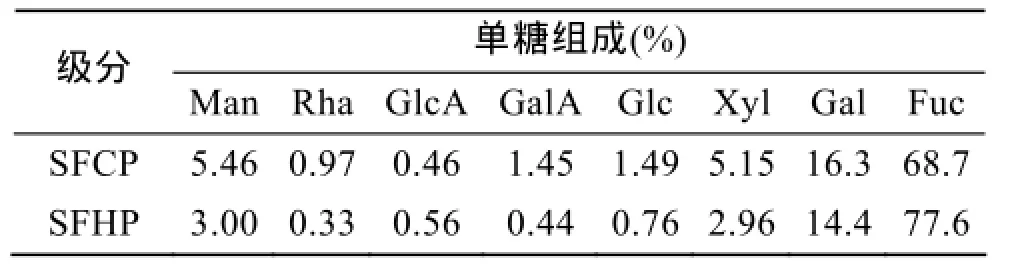
表2 冷热提取羊栖菜多糖单糖组成Tab. 2 Monosaccharide compositions of SFCP and SFHP
DEAE-Sepharose CL-6B分析羊栖菜多糖与阴离子交换剂的吸附能力, 可以反映出多糖的分子质量与极性的均一性。结果如图2所示。冷提多糖的分布比较集中, 除少部分在0.15 mol/L NaCl和1.0 mol/L NaCl洗脱下来, 大部分在0.62 mol/L NaCl浓度洗脱下来, 预示其均一性较好, 后续纯化较容易; 而热提多糖的分布较分散, 除在0.3 mol/L NaCl有一较好对称的洗脱峰, 其他级分在0.6~1.3 mol/L NaCl逐渐洗脱下来, 预示其组分更复杂, 后续的纯化比较困难。
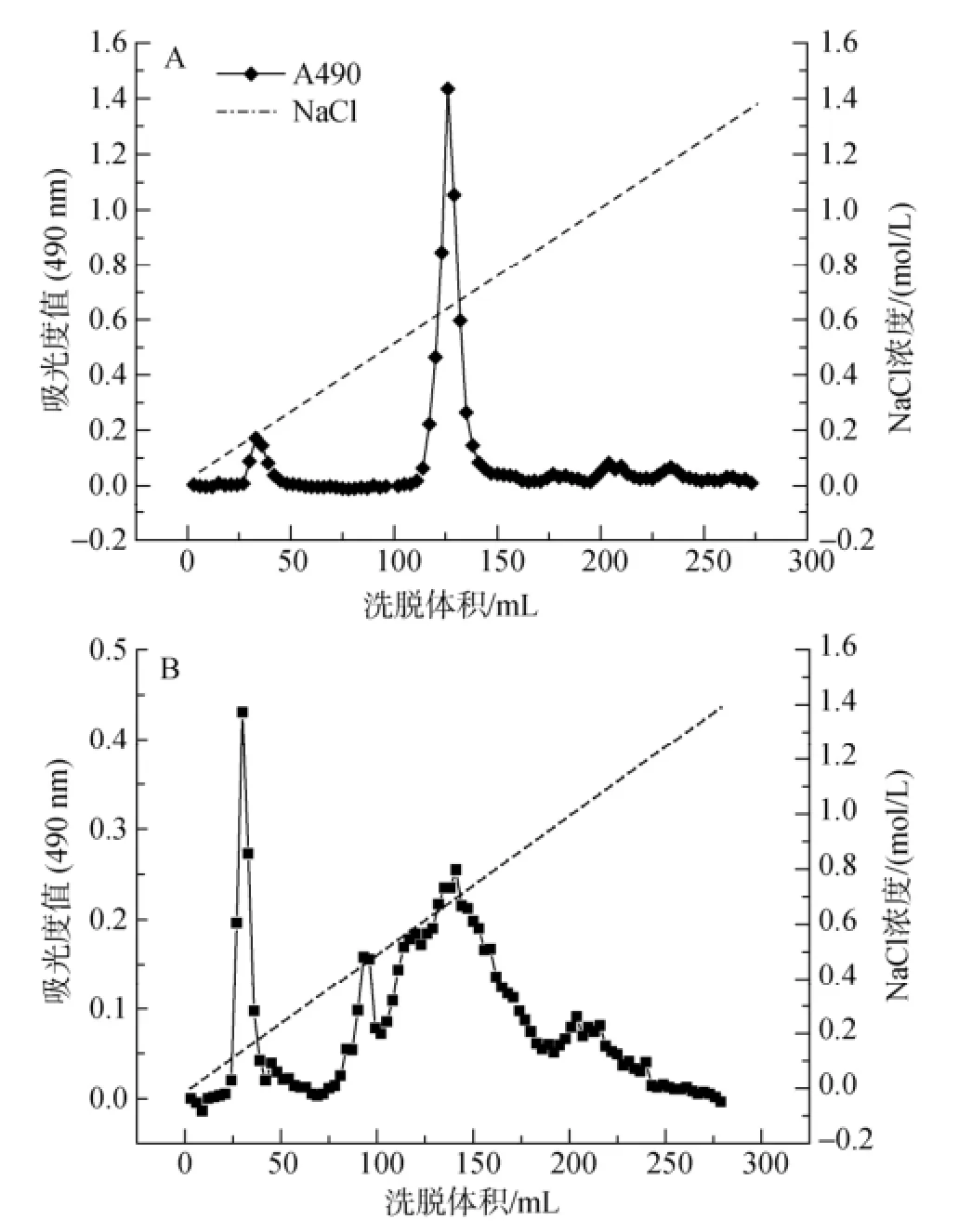
图2 SFCP(A)与SFHP(B)的DEAE-Sepharose CL-6B洗脱曲线Fig. 2 Elution curve of SFCP(A) and SFHP(B) DEAE-Sepharose CL-6B column
3.2 红外图谱分析
冷热水提取的羊栖菜多糖红外图谱如图3所示。两种多糖在3400 cm–1~3500 cm–1处有很宽的O-H伸缩振动吸收峰; 在2800 cm–1~2912 cm–1处有吡喃环的C-H弯曲伸缩振动峰, 及岩藻糖和半乳糖基C-6;在1600 cm–1~1650 cm–1处有羰基非对称伸缩振动, 1430 cm–1~1450 cm–1处为半乳糖、木糖CH2的剪切震动, 岩藻糖和O-乙酰基CH3的非对称弯曲振动; 1384 cm–1为岩藻糖和O-乙酰基CH3的对称弯曲振动; 1230 cm–1~1250 cm–1处两种多糖都对应部分表现出硫酸酯中O=S=O的非对称伸缩振动, SFHP在该处峰较冷提多糖更为明显, 与其硫酸根含量较多相一致; 1089 cm–1~1047 cm–1为吡喃环CC、CO及糖苷键COC伸缩振动。SFCP在877 cm–1处有β糖苷键特征峰, 在821 cm–1处显示其所含硫酸根链接在糖环赤道轴C-2和C-3的位置; SFHP除在82 5cm–1处有硫酸根连接峰, 还在840 cm–1处显示有硫酸根连接于垂直轴C-4的位置, 在580 cm–1处有明显的O-S-O非对称变形吸收, 即SFCP与SFHP在硫酸根含量和取代基位置上有明显差别。
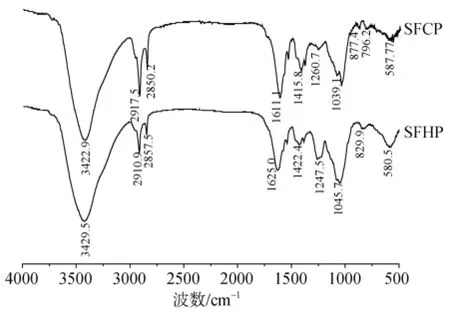
图3 冷热提取羊栖菜多糖红外光谱扫描图Fig. 3 Infrared absorption spectroscopy results of SFCP and SFHP
3.3 羊栖菜多糖对DPPH自由基的清除作用
两种羊栖菜多糖对DPPH自由基的清除率在0.1~1.5 g/L内与浓度呈正相关(图4), 当两种糖浓度为1.4 g/L时, 对DPPH自由基的清除率接近Vc对DPPH自由基的清除率。说明羊栖菜多糖对DPPH自由基有良好的清除作用。但两种不同处理方法得到的羊栖菜多糖相比较, SFCP对DPPH自由基的清除能力相对SFHP清除能力更好。

图4 羊栖菜多糖对DPPH自由基的清除能力Fig. 4 Scavenging ability of S. fusiforme polysaccharide on DPPH radical
3.4 羊栖菜多糖对羟自由基的清除作用
冷热水提取羊栖菜多糖对羟自由基的清除作用如图5所示, 两种多糖对羟自由基的清除率在1~10 g/L内与浓度呈正相关, 当两种糖浓度为6 g/L时, 对羟自由基的清除率接近Vc对羟自由基的清除率, 说明羊栖菜多糖对羟自由基有良好的清除作用。两种不同处理方法得到的羊栖菜多糖相比较, 二者对羟自由基的清除能力差别很小。
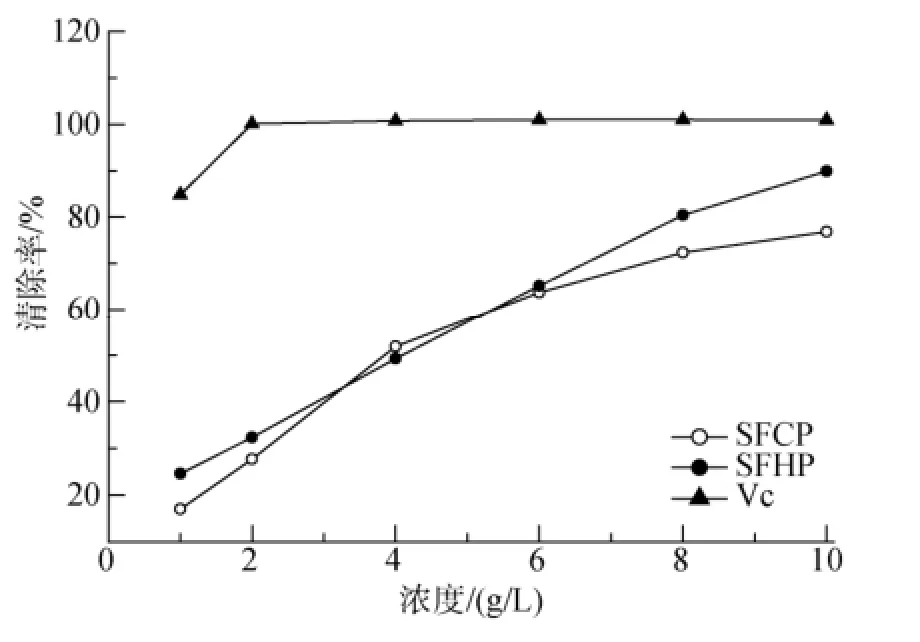
图5 羊栖菜多糖对羟自由基的清除能力Fig. 5 Scavenging ability of S.fusiforme polysaccharide on hydroxyl radical
4 结论与讨论
在本研究中, 冷水浸提和热水煮提条件下, 分别获得水溶性较好的多糖SFCP和SFHP。组成分析和红外光谱分析证明二者都是硫酸化的羊栖菜多糖, SFHP中岩藻糖含量高, 硫酸根含量也相对较高, 但是两种多糖在单糖和取代基种类上没有变化, 只是含量有所不同。SFCP和SFHP相比, 糖含量和糖醛酸含量都较高, 分子质量和极性分布更均一, 水溶性更强, 对DPPH的清除作用更强。而SFHP的硫酸根含量较高, 在较高浓度时对羟自由基的清除能力稍强。由此推测多糖的分子质量和糖醛酸对DPPH的清除影响较大, 而硫酸根含量对羟自由基的作用更明显。考虑到冷提方法多糖产率较高, 产品纯度较好, 生产过程耗能少, 易于生产和进一步的深入研究, 室温冷提法是更理想的羊栖菜多糖制备方法。
[1] 张展, 刘建国, 刘吉东. 羊栖菜的研究述评[J]. 海洋水产研究, 2002, (3): 67-74. Zhang zhan, Liu Jianguo, Liu Jidong. Study review of Hizikia fusiformis[J]. Marine Fisheries Research, 2002, (3): 67-74.
[2] 李杰女, 汲晨锋, 季宇彬. 羊栖菜多糖药用活性的研究进展[J]. 亚太传统医药, 2009, (7): 148-150. Li Jienü, Ji Chenfeng, Ji Yubin.Progress of studies on the drug activities of Sargassum fusiforme polysaceharide[J]. Asia-Pacific Tradition Medicine, 2009, (7):148-150.
[3] 楼敏, 王季华, 钱琼秋, 等. 高压氧对大鼠脑缺血区线粒体氧自由基影响的实验研究[J]. 浙江大学学报(医学版), 2008, (5): 437-443. Lou min, Wang Jihua, Qian Qiongqiu, et al. Effect of hyperbaric oxygen treatment on mitochondrial free radicals after transient focal cerebral ischemia in rats[J]. Journal of Zhejiang University(Medical Sciences), 2008, (5): 437-443.
[4] 陈伟平, 毛童俊, 樊林, 等. 紫心甘薯对高脂血症大鼠脂质代谢及氧化应激的影响[J]. 浙江大学学报(医学版), 2011, (4): 360-364. Chen Weiping, Mao Tongjun, Fan Lin, et al. Effent of purple sweet potato on lipid metabolism and oxidative stree in hyperlipidemic rats [J]. Journal of Zhejiang University(Medical Sciences, 2011, (4): 360-364.
[5] 王尊文, 华玉琴, 李国平, 等. 羊栖菜多糖对高血脂模型大鼠血脂和抗氧化功能的影响[J]. 中国海洋药物, 2008, (6): 13-15. Wang Zunwen, Hua Yuqin, Li Guoping, et al.Effect of polysaccharide from Sargassun fusiformeon bloodlipids and antioxidation study ability in hyperlipemia rats[J]. Journal ofChina March Drugs, 2008, (6): 13-15.
[6] YeJ, LiY, Teruya K, et al. Enzyme-digested Fucoidan Extracts Derived from Seaweed Mozuku of Cladosiphon novae-caledoniae kylin Inhibit Invasion and Angiogenesis of Tumor Cells[J]. Cytotechnology, 2005, 47(1-3): 117-126.
[7] Gómez-OrdóñezE, Jiménez-Escrig A, Rupérez P. Bioactivity of sulfated polysaccharides from the edible red seaweed Mastocarpus stellatus[J]. Bioactive Carbohydrates and Dietary Fibre, 2014, 3(1): 29-40.
[8] 张锐, 曾冬云, 龚兴国, 等. 羊栖菜多糖的提取工艺研究[J]. 中国食品学报, 2006, (3): 14-18. Zhang Rui, Zeng Dongyun, Gong Xingguo, et al.Study on the extraction technology of polysaccharides from Sargassum fusiforme[J]. Journal of Chinese Institute of Food Science and Technology, 2006, (3): 14-18.
[9] 孙鑫, 刘希光, 李海, 等. 新鲜海蜇不同部位总糖含量的测定[J]. 海洋科学, 2014, (8): 34-38. Sun Xin, Liu Xiguang, Li Hai, et al.Determination of total sugar concentration in different parts of fresh jellyfish[J]. Marine Sciences, 2014, (8): 34-38.
[10] 夏永刚, 梁军, 杨炳友, 等. 麻黄多糖中糖醛酸含量的测定[J]. 中医药学报, 2011, (1): 71-73. Xia Yonggang, Liang Jun, Yang Bingyou, et al. Determination of uronic acid contents in polysaccharides from the stems of Ephedra Sinica Stapf[J]. Acta Chinese medicine and pharmacology, 2011, (1): 71-73.
[11] 宿玮, 常耀光, 薛长湖, 等. 海地瓜多糖中蛋白含量测定方法比较[J]. 食品科学, 2011, (2): 201-204. Su Wei, Chang Yaoguang, Xue Changhu, et al. Comparison of four methods for determining protein content in crude Acaudina molpadioides polysaccharides[J]. Food Science, 2011, (2): 201-204.
[12] 马定远, 陈君, 李萍, 等. 柱前衍生化高效液相色谱法分析多糖中的单糖组成[J]. 分析化学, 2002, (6): 702-705. Ma Dingyuan, Chen Jun, Li Ping, et al. Analysis of monosaccharide compositions in polysaccharides by pre-column derivatization high performance liquid chromatography[J]. Chinese Journal of Analytical Chemistry, 2002, (6): 702-705.
[13] 张丽萍, 王月秋, 姜世成, 等. 离子色谱法测定高山红景天多糖硫酸酯中硫酸根含量的研究[J]. 分子科学学报, 2000, (3): 161-164. Zhang Liping, Wang Yueqiu, Jiang Shicheng, et al. Determination of SO42–content of polysaccharides sulfate from rhodiola saohalinensis A.Bor by Ion-chromatography[J]. Journal of molecular science, 2000, (3): 161-164.
[14] 徐晓霞, 李炎, 刘华, 等. 高效凝胶色谱法测定多花黄精多糖分子量与分子量分布[J]. 四川生理科学杂志, 2008, (3): 102-103. Xu Xiaoxia, Li Yan, Liu Hua, et al. Determination of the molecular weight(Mw) and weight distribution(Mw distrubution)in Duohuahuangjing polysaccharide by HPLC[J]. Sichuan Journal of Physiological Sciences, 2008, (3): 102-103.
[15] 郝世鑫, 侯鑫, 孙东方, 等. 紫贻贝贝壳和脉红螺厣中色素的提取与鉴定[J]. 海洋科学, 2015, (11): 49-53. Hao Shixin, Hou Xin, Sun Dongfang, et al. Extraction and identification of the pigment inthe Mytilus edulis shells and Rapana venosa operculum[J]. Marine Sciences, 2015, 39(11): 49-53.
[16] 张志国, 陈锦屏, 邵秀芝, 等. 红枣核类黄酮清除DPPH自由基活性研究[J]. 食品科学, 2007, (2): 67-70. Zhang Zhiguo, Chen Jinping, Shao Xiuzhi, et al. Study on DPPH free radical scavenging efficiency of flavonoids Jujube Pit[J]. Food Science, 2007, (2): 67-70.
[17] 余燕影, 章丽华, 曹树稳. 丰城鸡血藤黄酮提取物清除自由基活性研究[J]. 天然产物研究与开发, 2007, (5): 741-744. Yu Yanying, Zhang Lihua, Cao Shuwen. Investigation on free radical scavenging activity of flavonoid extracts from Millettla nitida Benth var hirsutissima Z.Wei[J]. Natural Product Research and Development, 2007, (5): 741-744.
Received:Feb. 29, 2016
Extraction and antioxidative activity of fucoidan from Sargassum fusiforme
HE Dan, ZHANG Xu, XIAO Bao-heng, WU Xiao-hui, WU Ming-jiang
(College of life and Environmental Science, Wenzhou University, Wenzhou 325035, China)
Sargassum fusiforme; polysaccharide; antioxidant
Sargassum fusiforme is an alga with economic significance and a good reputation for food longevity. Its polysaccharide also demonstrates good biological activities. In this study, we extracted two polysaccharide fractions—S. fusiforme cold-water-extracted polysaccharide (SFCP) and S.fusiforme hot-water-extracted polysaccharide (SFHP)—from S. fusiforme with water at 4℃ and 80℃, successively. We determined the physical and chemical properties of the polysaccharide fractions and evaluated their anti-oxidative activities by the radical scavenging ratios of 2, 2-diphenyl-1-picrylhydrazyl (DPPH) free and hydroxyl radicals. The results show that the two polysaccharide fractions were both fucosan with sulfate. SFHP showed a wider molecular weight distribution than SFCP and contained more sulfate, whereas SFCP contained more uronic acid. Their sulfate radical substitution positions also differed. SFHP and SFCP demonstrated certain dose-dependent activities for scavenging DPPH and ·OH. SFCP demonstrated better efficiency in removing free radicals.
TS254
A
1000-3096(2016)12-0024-06
10.11759/hykx20160229002
(本文编辑: 康亦兼)
2016-02-19;
2016-06-01
国家自然科学基金资助项目(31470430, 31200266); 温州市科技计划项目(N20150034)
[Foundation: National Natural Science Foundation of China, No.31470430, 31200266; Wenzhou Science and Technology Project, No.N20150034]
何丹(1990-), 女, 黑龙江齐齐哈尔人, 硕士研究生, 研究方向: 糖生物学, 电话: 18857734957, E-mail: hepan1990@163.com;吴明江, 男, 教授, 硕士生导师, 研究方向: 糖生物学, 电话: 0577-86689078, E-mail: wmj@wzu.edu.cn

