兔膝骨性关节炎治疗中透明质酸钠与曲安奈德对滑膜和软骨的影响
李伟,姜春岩,王战伟,任士友,肖德明
(1.北京大学第四临床医学院北京积水潭医院运动损伤科,北京100035;2.北京大学深圳医院运动医学与康复科,广东深圳518036)
兔膝骨性关节炎治疗中透明质酸钠与曲安奈德对滑膜和软骨的影响
李伟1,姜春岩1,王战伟2,任士友2,肖德明2
(1.北京大学第四临床医学院北京积水潭医院运动损伤科,北京100035;2.北京大学深圳医院运动医学与康复科,广东深圳518036)
目的评估透明质酸钠与曲安奈德对兔膝骨性关节炎中关节滑膜及软骨的影响。方法24只新西兰兔制造骨关节炎模型后按数表法随机分为对照组、透明质酸钠(SH)组、曲安奈德(TA)组,每组各8只,分别进行关节腔注射生理盐水0.4 mL、SH 0.4 mL、TA 0.4 mL,每周一次,每组6次。6周后观察每组兔膝关节滑膜组织病理切片、血管滑膜SP法染色、软骨AB-PAS染色及MMP-1免疫组化。结果滑膜病理切片显示,SH组滑膜增生最少,TA组滑膜增生较少,对照组滑膜增生明显;滑膜SP法染色显示SH组、TA组VEGF阳性细胞百分数较对照组减少[(42.50±5.29)%、(50.80±5.24)%vs(53.38±4.75)%,P<0.05],SH组、TA组平均光密度值较对照组减少[(0.32±0.02)、(0.43±0.04)vs(0.48±0.05),P<0.05],TA组较SH组和对照组内软骨细胞减少,软骨基质成分减少,SH组、TA组较对照组软骨表层破坏减少。SH组、TA组软骨MMP-1细胞百分数评分优于对照组[(61.25±4.06)%、(76.27±4.68)%vs (87.13±3.64)%,P<0.05];SH组、TA组软骨Mankins评分优于对照组[(6.88±1.25)分、(7.27±0.68)分vs(8.13±0.83)分,P<0.05]。结论透明质酸钠和曲安奈德均能抑制滑膜炎增生,减少兔膝关节腔内的炎性细胞因子,减少了软骨基质的破坏,且透明质酸钠要优于曲安奈德。
骨性关节炎;关节软骨;曲安奈德;透明质酸钠;关节腔内注射
骨关节炎(osteoarthritis,OA)是临床常见病,其发生率随着社会老龄化发展日益增高,给家庭以及社会都造成了沉重的负担[1]。OA治疗方法有很多,其中关节腔内药物注射治疗是一种有效和常用的方式,最常用的两种注射药物为透明质酸钠与糖皮质激素[2]。有研究显示,关节腔内注射药物应用率从1999年的39%上升至2006年的47%,到2013年降至37.5%[3]。然而,每个新诊断骨关节炎的患者糖皮质激素注射的平均数由0.27升至0.45,透明质酸钠(sodium hyaluronate,SH)注射的平均数从0.18升至0.36,在这些患者中,69%将糖皮质激素作为一线药,31%将透明质酸钠作为一线药,它们能明显减轻患者症状,但也存在很多争议,如透明质酸钠不一定有效、激素可能损害软骨等,其对软骨细胞和基质的具体保护作用仍有待研究[4]。
本研究采用新西兰兔制成兔膝OA动物模型,关节腔内注射SH与曲安奈德(triamcinolone acetonide,TA)以观察其对关节软骨及滑膜的影响,为临床更好评价与选择关节腔内注射药物作基础研究。
1 材料与方法
1.1 实验动物、药物试剂及仪器选择6个月龄雄性新西兰兔[许可证SYXK(粤)2010-0106],购自西安市迪乐普生物资源开发有限公司,体质量2.0~2.5 kg。主要药物有:透明质酸钠(山东正大福瑞达制药有限公司);曲安奈德(云南昆明积大制药股份有限公司)。主要试剂:Anti-VEGF抗体(abcam公司,英国)、MMP-1染色剂量盒(北京博奥森生物技术有限公司)。
1.2 造模分组及用药24只新西兰兔被制作成兔OA动物模型,方法为将兔左膝用石膏固定于伸直位,范围为兔踝关节下3 cm至腹股沟下1.5 cm,踝背屈30°~40º,固定时间5周,自由活动与进食。5周去除石膏后按数表法随机分为对照组、SH组、TA组、每组8只,分别关节腔注生理盐水0.4 mL、SH 0.4 mL、TA 0.4 mL(含TA1 mg)每周一次,共6次。
1.3 动物处死与取材关节腔内注射6周后采用过量麻醉的方法处死新西兰兔,打开左膝关节囊取膝关节股骨髁软骨和内侧滑膜并剔除软组织,生理盐水冲洗组织,用10%中性甲醛固定,标记分组。滑膜标本行HE染色、VEGF免疫组化SP法染色检测;软骨行AB-PAS染色、MMP-1免疫组化检测。
1.4 实验方法
1.4.1 滑膜SP法染色检测用清洁液处理载有滑膜组织的载玻片、烘干,涂多聚L一赖氨酸在拟贴片区域,烤箱55℃~60℃烘烤2 h备用。切片、脱蜡、水化、标记一抗Anti-VEGF抗体、二抗,应用免疫组织化学S-P法测定细胞和组织的抗原,进行染色,再用还原液1 min后自来水冲洗还蓝,梯度酒精脱水、透明、封片。各组随机选8张切片,随机选择3个视野(200倍),对VEGF染色阳性细胞进行计数,每个视野细胞计数为100个,取8张细胞计数的平均值。保持染色强度与背景相近,胞膜、细胞浆若为无棕黄色为阴性;胞膜、细胞浆若为棕黄色为阳性。应用图像分析软件测量视野中染色阳性细胞,计算其积分光密度值和平均光密度值。
1.4.2 软骨病理学检查及Mankin's评分软骨标本取材后进行按常规行苏木素-伊红染色及甲苯胺兰染色(AB-PAS染色),置光镜下观察,AB-PAS染色行Mankin病理学评分[5]。
1.4.3 软骨MMP-1免疫组化将软骨蜡块标本制作组织切片后,脱蜡、脱水,水冲洗,修复抗原5 min,3%过氧化氢处理10 min使内源性过氧化物酶活性抑制,用正常牛血清孵育10 min,封闭抗原甩干,加入浓度1:200的MMP-1,1 h后PBS冲洗,加二抗15 min后PBS再次冲洗,加入二抗孵育30 min后再用三氨基联苯二胺(DAB)显色,用水冲洗终止反应,复染后脱水,透明封片,阴性对照采用PBS代替一抗进行实验,形态计量学研究采用Pelletier等[6]的方法。
1.5 统计学方法应用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,其中两两比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 滑膜组织学观察及VEGF的表达对照组滑膜层细胞为4~7层,有的区域形成滑膜绒毛,滑膜下层增厚,胶原纤维成分呈现波浪状,血管增生明显(图1A),VEGF免疫组化染色滑膜下层见血管生成,并见棕褐色染色(图1B);SH组滑膜层细胞较对照组减少,部分区域滑膜细胞层增多,为2~4层,滑膜下层细胞数量减少,见血管增生明显,疏松结缔组织变薄(图1C)。VEGF免疫组化染色发现滑膜下层血管区域内皮细胞呈棕褐色染色(图1D),较对照组减少;TA组滑膜层细胞较对照组减少,滑膜层约为3~5层,滑膜下层细胞数量增多,见血管增生明显,结缔组织和血管大量增生(图1E),VEGF免疫组化染色显示滑膜尤其膜下层有大量棕褐色染色(图1F)。应用图像分析软件测量三组染色阳性细胞,计算平均光密度值(MD),见表1。
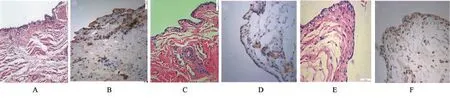
图1 对照组、SH组、TA组滑膜HE切片与VEGF免疫组化染色图(×400)
表1 三组新西兰兔滑膜免疫组化VEGF阳性细胞和平均光密度值比较(±s)

表1 三组新西兰兔滑膜免疫组化VEGF阳性细胞和平均光密度值比较(±s)
注:与对照组比较,aP<0.05;与SH组比较,bP<0.05。
组别只数VEGF阳性细胞(%)平均光密度对照组SH组TA组F值P值888 53.38±4.75b42.50±5.29a50.80±5.24ab68.65<0.01 0.48±0.05b0.32±0.02a0.43±0.04ab42.63<0.01
2.2 软骨Mankin's评分和MMP-1细胞比较软骨AB-PAS染色观察多糖着色,其中黏液酸性呈蓝色,中性呈红色,混合性呈紫色,细胞核呈蓝色,颜色越深,基质成份含量越高。AB-PAS染色片显示对照组表层结构破坏严重,细胞减少(图2A),SH组结构基本完整,但细胞数量少,颜色主要呈蓝色(图2B),TA组结构基本完整,但细胞数量明显减少,基质较SH减少(图2C),进行Mankin's评分。MMP-1免疫组化切片中对照组软骨结构中基本只见到表层大量胞浆染成深棕色的阳性细胞,其他各层细胞大量凋亡,数量减少,软骨层变薄(图2D)。SH组软骨标本结构中,可见染成深棕色的阳性细胞,在移行层更多并伴软骨紊乱(图2E),但软骨表面呈现一定修复能力;TA组软骨标本细胞大量凋亡,细胞数量减少,表面细胞胞浆染呈深棕色,整个基质层明显变薄(图2F)。三组新西兰兔软骨Mankin's评分及MMP-1细胞百分数比较见表2。

图2 对照组、SH组、TA组软骨AB-PAS染色(×400)及MMP-1免疫组化染色(×400)
表2 三组新西兰兔软骨Mankin's评分及MMP-1细胞百分数比较(±s)
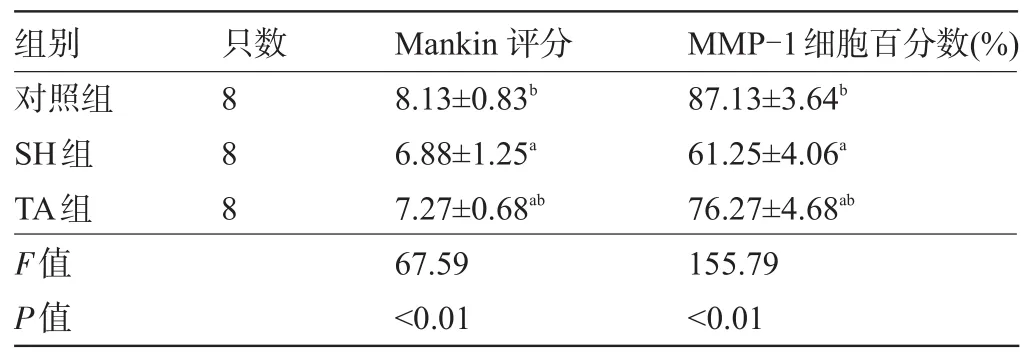
表2 三组新西兰兔软骨Mankin's评分及MMP-1细胞百分数比较(±s)
注:与对照组比较,aP<0.05;与SH组比较,bP<0.05。
组别只数Mankin评分MMP-1细胞百分数(%)对照组SH组TA组F值P值888 8.13±0.83b6.88±1.25a7.27±0.68ab67.59<0.01 87.13±3.64b61.25±4.06a76.27±4.68ab155.79<0.01
3 讨论
膝OA是一种中老年人的常见病,其主要病理表现为关节软骨的退化,软骨结构瓦解,最后失去保护关节的功能。近几年来的研究显示软骨破坏是由多种细胞因子引起金属蛋白酶活性增高,导致基质破坏。而细胞因子主要由滑膜炎中增生的、功能活跃的滑膜细胞产生的,细胞因子又可刺激滑膜细胞增生,形成恶性循环,加速OA病变[7]。在这个病理发展中,血管内皮生长因子(vascular endothelial growth factor,VEGF)起重要作用。Mabey等[8]研究显示VEGF在OA患者与正常对照组有明显差别,局部关节和全身血液中的VEGF含量水平可作为是原发性OA患者的一种生物指标监测[9],不仅如此,膝OA患者的关节滑液VEGF浓度水平与其骨关节炎的超声结果、放射分级及功能状态是相关[10],Meta分析显示患者关节内VEGF水平的升高明显加速OA的病理进程。
因此OA病理过程是一个复杂的过程,它包括着血管增生、滑膜炎反应、大量细胞因子生成、软骨破坏等病理表现。在本实验中,为了更清楚地显示透明质酸钠、曲安奈德与对滑膜和关节的影响,我们选择了观察滑膜、VEGF的表达、MMP-1的表达及软骨的功能与结构。结果显示了透明质酸钠、曲安奈德相对对照组能减少滑膜细胞增生及VEGF和MMP-1的表达,也能减缓软骨降解。
在OA的治疗中,激素关节腔内注射可以显著减少关节滑膜组织分泌白细胞介素-1与肿瘤坏死因子α,抑制毛细血管与纤维母细胞增生。在临床观察中,一组随机对照实验显示接受激素治疗的OA患者WOMAC和VAS评分都有一定提高[11]。在12周的疗效观察中,激素可以减轻OA患者关节疼痛及和肿胀,同时没有明显的副作用[12]。一个Mete分析[13]也显示关节腔内注射激素治疗骨性关节炎在1~6周后是否有益仍还不清楚。多个时间点的分析表明,随着时间的推移,效果降低,并且没有任何证据显示在激素注射6个月后仍有效果,也有证据显示长期使用能导致软骨或关节的破坏[14],这些研究显示了激素关节腔内注射治疗OA的局限性。
本实验采用的TA为中效糖皮质激素,其抗炎、抗过敏作用较强且持久,可迅速消除肿痛、缓解症状,还可以阻断MMP的激活与合成[15]。本实验研究结果显示曲安奈德也能明显地减少滑膜细胞,减少炎性细胞因子。但同时,它对滑膜细胞增殖的抑制也影响了正常软骨细胞的增殖及更新,使关节软骨结构中软骨细胞数量明显减少,甚至比对照组的软骨细胞还要少。虽然TA短期迅速减轻细胞因子达到减轻疼痛,但从长期效果来看,没有改善关节软骨细胞的质量,它同临床的观察结果类似。
在软骨保护剂中,SH补充软骨基质的HA含量,减少滑液中炎性介质IL-1和MMP-1含量[16],也能减少Coll2-1含量,减少软骨降解[17],延缓OA进程。它对软骨弹性的改善明显比止痛药物要好,还能减少止痛药物的副作用,时间长达8周以上[18]。在相关动物实验中,结果还显示创伤后立即关节腔内注射HA能减少撞击导致的细胞凋亡[19],显示其延缓关节软骨破坏的良好效果。在本实验中,我们研究显示SH组的软骨表面已经有一些修复的表现,但修复的软骨基质层与原来的软骨基质层的结构有一定紊乱,显示修复的基质质量有待改善。
对于二者的比较,TA比SH能更快地改善膝关节的症状。在一个前瞻性、随机的、双盲的临床对照试验中,对OA患者进行TA、SH关节腔注射,结果显示在6个月的随访中TA在改善膝痛、膝关节功能与活动度上与SH有同样效果,并且第1周治疗明显改善疼痛,第2周治疗明显改善膝关节功能[20]。SH虽然起效较慢,但作用时间更持久。它减少了阿片类镇痛药和NSAIDs的使用,具有更好的风险/收益比,并可能延缓关节置换手术时间达8.7个月[21]。临床疗效显示比皮质类固醇要慢1~4周,但可维持6~12个月[22]。
综上所述,本研究显示兔膝OA关节腔内注射SH与TA短期对关节软骨都有一定保护作用,尤其能明显抑制关节滑膜增生,减少关节软骨的破坏。但从长期观察,TA无论从延缓病理进程还是改善症状方面不一定有良好治疗作用,SH则在二方面的效果可能更好,这一点在临床上也得到一致认识。OA是一个长期的疾病,因此,从二种药物使用上,本研究显示SH更适合长期使用来减轻滑膜炎症及保护软骨。同时,本实验的不足之处只观察了6周,缺乏更长时间的观察,需要在未来的实验中进一步研究。
[1]Lawrence JS,Bremmer JM,Ber F.Osto-arthrosis:Prevalence in the population relationship between symptoms and X-ray changes[J]. Ann Rheum Dis,1966,25(1):1-24.
[2]Yu SP,Hunter DJ.Managing osteoarthritis[J].Aust Prescr,2015,38 (4):115-119.
[3]Koenig KM,Ong KL,Lau EC,et al.The use of hyaluronic acid and corticosteroid injections among medicare patients with knee osteoarthritis[J].JArthroplasty,2016,31(2):351-355.
[4]Richards MM,Maxwell JS,Weng LI,et al.Intra-articular treatment of knee osteoarthritis:from anti-inflammatories to products of regenerative medicine[J].Phys Sports Med,2016,44(2):101-108.
[5]Mankin HJ,Lippiello L.Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips[J].J Bone Joint SurgAm,1970,52(3):424-434.
[6]Pelletier JP,Lascau-Coman V,Jovanovic D,et al.Selective inhibition of inducible nitric oxide synthase in experimental osteoarthritis is associated with reduction in tissue levels of catabolic factors[J].J Rheumatol,1999,26(9):2002-2014.
[7]Goldring MB.The role of cytekines as inflammatory mediators in osteoarthritis:Lessons from animal models[J].Connect Tissue Res, 1999,40(1):1-11.
[8]Mabey T,Honsawek S,Saetan N,et al.Angiogenic cytokine expression profiles in plasma and synovial fluid of primary knee osteoarthritis[J].Int Orthop,2014,38(9):1885-1892.
[9]Yuan Q,Sun L,Li JJ,et al.Elevated VEGF levels contribute to the pathogenesis of osteoarthritis[J].BMC Musculoskelet Disord,2014, 15:437.
[10]Kim HR,Lee JH,Kim KW,et al.The relationship between synovial fluid VEGF and serum leptin with ultrasonographic findings in knee osteoarthritis[J].Int J Rheum Dis,2016,19(3):233-240.
[11]Dávila-Parrilla A,Santaella-Santé B,Otero-López A.Does injection site matter?A randomized controlled trial to evaluate different entry site efficacy of knee intra-articular injections[J].Bol Asoc Med P R, 2015,107(2):78-81.
[12]Spolidoro Paschoal NO,Natour J,Machado FS,et al.Effectiveness of triamcinolone hexacetonide intraarticular injection in interphalangeal joints:A 12-week randomized controlled trial in patients with hand osteoarthritis[J].J Rheumatol,2015,42(10):1869-1877.
[13]Jüni P1,Hari R,Rutjes AW,et al.Intra-articular corticosteroid for knee osteoarthritis[J].Cochrane Database Syst Rev,2015,22(10): CD005328.
[14]Raynauld JP,Buckland-Wright C,Ward R,et al.Safety and efficacy of long-term intraarticular steroid injections in osteoarthritis of the knee:a randomized,double-blind,placebo-controlled trial[J].Arthritis Rheum,2003,48(2):370-377.
[15]Herve Z,Joseph P,Christel H,et al.Evaluation of intra-articular delivery of hyaluronic acid functionalized biopolymeric nanoparticles in healthy rat knees[J].Biomed Mater Eng,2010,20(3):235-242.
[16]Henrotin Y,Chevalier X,Deberg M,et al.Early decrease of serum biomarkers of type II collagen degradation(Coll2-1)and joint inflammation(Coll2-1 NO(2)by hyaluronic acid intra-articular injections in patients with knee osteoarthritis:A research study part of the Biovisco study[J].J Orthop Res,2013,31(6):901-907.
[17]Plickert HD,Bondzio A,Einspanier R,et al.Hyaluronic acid concentrations in synovial fluid of dogs with different stages of osteoarthritis[J].Res Vet Sci,2013,94(3):340-350.
[18]Bannuru RR,Natov NS,Obadan IE,et al.Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis:a systematic review and meta-analysis[J].Arthritis Rheum 2009,61(12):1704-1711.
[19]Barreto RB,Sadigursky D,de Rezende MU,et al.Effect of hyaluronic acid on chondrocyte apoptosis[J].Acta Ortop Bras,2015,23(2): 90-93.
[20]Tammachote N,Kanitnate S,Yakumpor T,et al.Intra-articular,single-shot hylan G-F 20 hyaluronic acid injection compared with corticosteroid in knee osteoarthritis:A double-blind,randomized controlled trial[J].J Bone Joint SurgAm,2016,98(11):885-892.
[21]Ong KL,Anderson AF,Niazi F,et al.Hyaluronic acid injections in medicare knee osteoarthritis patients are associated with longer time to knee arthroplasty[J].Arthroplasty,2016,31(8):1667-1673.
[22]Legré-Boyer V.Viscosupplementation:techniques,indications,results [J].Orthop Traumatol Surg Res,2015,101(1 Suppl):S101-108.
Effect of intraarticular injection of sodium hyaluronate and triamcinolone acetonide on cartilage and synovium of osteoarthritis rabbits.
LI Wei1,JIANG Chun-Yan1,WANG Zhan-Wei2,RNE Shi-You2,XIAO De-Ming2.1.Department of Sports Medicine,the Fourth Clinical Medical College of Peking University,Beijing Jishuitan Hospital,Beijing 100035,CHINA; 2.Department of Sports Medicine and Rehabilitation,Peking University Shenzhen Hospital,Shenzhen 518036,CHINA
ObjectiveTo evaluate the effects of intraarticular injection of sodium hyaluronate(SH),triamcinolone acetonide(TA)on cartilage and synovium of osteoarthritis(OA)rabbit models.MethodsAfter the models of OA established,a total of 24 male rabbits were divided into the control group,sodium hyaluronate(SH)group and triamcinolone acetonide(TA)group,with 8 rabbits in each group.The control group,SH group and TA group respectively received intraarticular injection of 0.9%saline 0.4 mL,SH 0.4 mL,TA 0.4 mL one time each week for 6 weeks.After 6 weeks,the synovial tissue biopsy,vascular synovial SP staining,cartilage alcian blue and periodic acid-Schiff(AB-PAS)staining and matrix metalloproteinase-1(MMP-1)immunohistochemistry were observed.ResultsCompared with the control group, the histological observation of synovium showed that SH group had least synovial hyperplasia,and TA group had less synovial hyperplasia.The histological observation of cartilage SP staining showed the percentage of positive cells of VEGF and average optical density in the SH group and TA group were(42.50±5.29)%,(0.32±0.02),(50.80±5.24)%, (0.43±0.04),respectively,which were significantly lower than those in the control group(53.38±4.75)%,(0.48±0.05),respectively(P<0.05).The SH group and TAgroup had less apoptosis of chondrocytes and more integrated structure of matrix compared with the control group.The MMP-1 percentage cartilage cells and cartilage Mankins score of the SH group and TA group were(61.25±4.06)%,(6.88±1.25)%,(76.27±4.68)%,(7.27±0.68),respectively,which were significantly better than those in the control group(87.13±3.64)%,(8.13±0.83),respectively(P<0.05).ConclusionIntraarticular injection of SH and TA can relieve inflammation of OA,alleviate the pathologic process of OA,reduce the destruction of cartilage matrix,and SH better than TA.
Osteoarthritis(OA);Articular cartilage;Triamcinolone acetonide(TA);Sodium hyaluronate(SH); Intraarticular injection
R-332
A
1003—6350(2016)21—3444—04
2016-06-08)
10.3969/j.issn.1003-6350.2016.21.002

