C-反应蛋白免疫传感器的研究进展
刘仪1,2, 刘婷知1, 张坤蕾1, 白茹燕1, 李德蕾1, 张茜1, 胡蓉1*,杨云慧1*
(1.云南师范大学化学化工学院,云南昆明 650500)
(2.昭通市疾病预防控制中心,云南昭通 657008)
C-反应蛋白免疫传感器的研究进展
刘仪1,2, 刘婷知1, 张坤蕾1, 白茹燕1, 李德蕾1, 张茜1, 胡蓉1*,杨云慧1*
(1.云南师范大学化学化工学院,云南昆明 650500)
(2.昭通市疾病预防控制中心,云南昭通 657008)
C-反应蛋白(CRP)是一种急性期蛋白质,由肝脏和脂肪细胞合成。C-反应蛋白可作为冠心病、心血管疾病和其它疾病的标志物,因此,CRP的检测对临床诊断具有重要意义。免疫传感器已经广泛应用于临床诊断、环境检测、制药工程、食品分析等领域中。该文分别对电化学免疫传感器、表面等离子共振(SPR)型免疫传感器、石英晶体微天平(QCM)型免疫传感器在CRP检测中的运用的研究进展进行简要综述。
C-反应蛋白;电化学免疫传感器;表面等离子共振(SPR)型免疫传感器;石英晶体微天平(QCM)型免疫传感器;免疫传感器
0 引言
心血管疾病(cardiovascular disease,CVD)是一种严重威胁人类的疾病,具有患病率高、致残疾率高和死亡率高的特点。虽然目前已应用最先进的医疗手段,仍有大多数意外幸存者生活不能完全自理,全球每年心脑血管疾病的死亡人数高达千百万人,居于各种死因的首位。冠心病(coronary atherosclerotic heart disease)是一种最常见的心脏病,它也被列为全球死亡率最高的疾病之一,中国冠心病死亡率位于世界第二位。因此,早期发现心血管疾病、冠心病在临床上具有重大意义。
C-反应蛋白是机体组织损伤等炎症性刺激或者受到微生物入侵时,由肝细胞合成的一种急性蛋白,通常在血清中含量较低,小于0.3 μg/mL[1]。当CRP含量升高时,意味着非特异性的应对各种各样的疾病,包括由革兰氏阳性和革兰氏阴性细菌感染,急性期的类风湿性关节炎、腹腔脓肿、胆管炎症。CRP一直被视为最有价值的炎症标记物,已经被用于预测血液血管中多种潜在的疾病,如中风、心肌梗塞、心脏性猝死等。C-反应蛋白也可能在格林-巴利综合症患者和多发性硬化症,某些病毒感染,肺结核、急性传染性肝炎,许多其它坏死和炎性疾病,烧伤病人手术创伤后的血液中发现高出正常值2000倍。
近几年来,大多数的研究都集中在C-反应蛋白改善全球心血管疾病的预测[2-3]及冠心病早期检测[4-9]。此外通过检测脑脊液中CRP的含量,也可作为重症病例早期诊断的指标,判断其在免疫力低下的情况下是否存在有合并细菌感染[10]。所以C-反应蛋白的检测在临床诊断中具有重大意义。
目前,研究者已经开发了许多方法和技术用于CRP检测,如荧光[11]、放射、酶联免疫等分析方法[12]。然而,这些方法各有各的缺陷,如成本高、耗时、仪器复杂、需相关的专业人员操作等。因此急需开发简单、便宜、精确且易于推广的CRP现场快速检测方法,以实现冠心病的早期诊断。
免疫传感器[13]是以抗原或抗体分子作为生物敏感膜并与相应的信号转换器相结合的一种新的生物传感器,它具有检出限低、特异性强等特点,能够较好地应用于实际情况的检测。随着研究的不断深入,免疫传感器已应用在临床诊断[14],如:病毒、激素、癌细胞[15]、肿瘤标志物[16]等对象的分析测定以及食品检测[17-18],环境检测[19]等方面。
该文对1993年至2015年CRP免疫传感器的研究进展和应用现状作一综述。
1 电化学免疫传感器
1.1 电化学免疫传感器的定义
电化学免疫传感器[20-21]是生物技术和电化学技术相结合的产物,即将抗原与抗体特异性结合的生物反应转换为电信号。它将免疫技术和各种电化学技术耦联,使得灵敏度得到很大的提高。电化学免疫传感器原理图见图1。
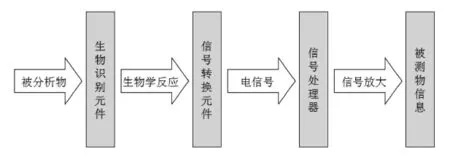
图1 电化学免疫传感器原理图Fig.1Procedure of immunosensor
电化学免疫传感器可根据检测信号不同,主要分为:电流型、电位型以及交流阻抗型免疫传感器。此外电化学免疫传感器还可以按照是否使用标记材料又可分为标记型以及非标记型的免疫传感器[22]。
电化学检测方法采用纳米结构界面,纳米材料标记或者磁珠,为高灵敏的蛋白质检测提供新的机遇。大多数电化学免疫检测的策略都是采用夹心法(类似三明治)来进行的免疫测定,即传感器表面首先功能化捕获抗体(Ab1)、DNA、细胞或其它分析物。然后加入待测样品,再经冲洗步骤,最后通过示踪剂酶或者纳米颗粒标记的抗体(Ab2)追踪结合目标分析物,从而实现对被测样品的定量检测。使用纳米材料标记抗体或其它标记方法(如:酶标记、磁珠、贵金属纳米材料等)可以大大提高检测的灵敏度。其原理示意图见图2。
1.2 电流型CRP免疫传感器
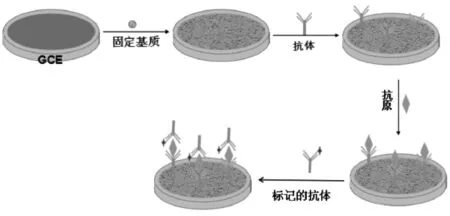
图2 夹心法免疫传感器示意图Fig.2Procedure of sandwich immunoassay
1993年,林朝晖等[23]首次以醋酸纤维素一戊二醛(GA)-己二胺(1,6-Hexanediamine)载体膜研制非标记CRP免疫电极。同时该课题组研究了载体膜的组成对电极的影响,考察了载体膜的活化条件、抗原抗体结合时间等条件对响应信号的影响,在最佳实验条件下该传感器的线性范围为1.8~60 μg/mL。2008年,Buch等[24]开发了一种敏感的、一次性的和容易操作的传感器,用于夹心免疫测定高敏C-反应蛋白。该研究将多壁碳纳米管和蛋白质A修饰在丝网印刷电极上,以确保固定anti-CRP(CRP抗体)的量,该传感器的CRP检测下限为0.5 ng/mL,能降低血清中其它干扰物的干扰。这种传感器适用于医疗检测高敏CRP,有助于传统临床相关的轻度炎症的诊断。2009年,Hennessey[25]使用直流和交流电化学技术来检测固定在金电极表面的CRP抗原与anti-CRP的相互作用。该研究证明了电化学技术可以有效地用于检测一定浓度范围的CRP(1.15×10-5mg/L至1.15 mg/L)。2011年,Zeng等[26]合成Fe3O4(核) /Au(壳)(简称GMP)结构纳米材料,并包裹在多层碳纳米管(MWCNT)表面形成复合物来固定anti-CRP,最后形成MWCNT–GMP/anti-CRP复合磁性探针,采用丝网印刷电极,通过免疫分析测量DPV信号来测定血清中CRP的浓度。研究表明该传感器具有良好的线性关系,检测范围为0.3~100 μg/L,检测下限为0.16 μg/L。该免疫传感器被用于确定心脏病患者血清样本中CRP的含量,与ELISA分析方法的结果一致。该电流型免疫传感器的检测快速、灵敏度高、受磁场控制,且易处理(一次性)。因此,它甚至可以被用来追踪心脏病患者的血清中CRP含量。侯建国等[27]利用Fe3O4(核)/Au(壳)(GMPs)标记CRP酶标抗体(HRP-anti CRP),构建了一类新型的磁性纳米探针(HRP-anti CRP/GMPs),将其修饰在丝网印刷电极(SPCE)表面构建了可再生使用的CRP免疫传感器。在外加磁场下,CRP检测线性浓度范围为0.1 ng/mL~110 ng/mL,检测下限为0.04 ng/mL。2015年,Kokkinos等[28]研究了一种新颖的基于柠檬酸铋修饰的石墨丝网印刷电极(SPEs),使用PbS量子点(PbS QDs)为标记物的夹心型的免疫传感器,用伏安法来测定人血清中的CRP。在最优条件下,对CRP的响应范围为0.2~100 ng/mL,检测下限是0.05 ng/mL。该方法为一次性传感平台提供便利,具有成本低、检测灵敏等特点,可以更广泛大规模生产用于蛋白质的分析检测。
1.3 阻抗型CRP免疫传感器
2003年,Zhu等[29]研究了交流阻抗(EIS)免疫传感器。表面阻抗的变化表明,可以在电极表面组装抗体识别抗原。首先将半胱胺组装在金电极表面用于吸附金纳米粒子,而金纳米粒子可用于固定C-反应蛋白抗体。此免疫传感器响应线性范围为5~25 μg/mL,可以适用于临床检验的需要。Chen等[30]通过电化学阻抗谱(EIS)技术研究了一种新颖的基于三维有序大孔径(3 DOM)金膜修饰的无标记免疫传感器,并用于检测C-反应蛋白。这种无标记EIS免疫传感器是建立在通过反向合成晶体模板技术合成的三维有序大孔(3 DOM)金纳米膜修饰电极上,由于该金膜具有较大的活性表面,此外3 DOM金纳米膜电极具有导电性强、活性强、吸附能力好的特点。结合金纳米粒子的特点,这些金膜也为免疫传感器固定蛋白质提供了良好的微环境,在保留生物活性的同时可以增加电子转换电阻(Ret)值。该免疫传感器的检测范围为0.1~20 ng/mL,这种方法具有稳定性好、应用广泛、灵敏度高的特点,故而可以扩展到其它的免疫测定。Hafaiedh等[31]通过基于EIS免疫传感器技术,研究了蛋白质层在金电极上结合的电化学性能用于检测CRP。该研究中使用两种固定C-反应蛋白抗体的方法;第一种方法是通过在金电极表面直接物理吸附,第二种方法是在金电极上沉积了G蛋白再吸附C-反应蛋白抗体,最后用BSA封闭,形成中间蛋白质夹层,然后在磷酸缓冲盐溶液和人类血清中通过循环伏安法和阻抗谱来检测。该传感器检测速度快、稳定性强、可再生,检出限分别为100 fg/mL(有G蛋白)和10 pg/mL(没有G蛋白),该方法可用于真实样品的检测。2014年,Singal等[32]将功能化Pt纳米粒子-石墨烯电沉积在玻碳电极上,形成多晶石墨烯薄膜纳米复合材料Pt(MPA),制备成阻抗型免疫传感器,用于超灵敏检测CRP。通过循环伏安法和阻抗谱来实现对CRP的定量检测。该电极具有较好的生物相容性、灵敏度高和选择性好等优点,线性响应范围的10 ng/mL~10 μg/mL,在磷酸缓冲盐PBS(pH7.4)灵敏度可达到92.86 Ωcm2。Mishra等[33]用电化学阻抗免疫方法定量检测CRP,该研究中CRP抗体被共价固定在膜沉积的氧化铟锡ITO导电玻璃上,该膜靠电化学沉积3-巯基丙酸-金纳米粒子形成Au(MPA)-聚吡咯(PPy)纳米复合膜,并由此控制膜的厚度。Au (MPA)-(PPy)具有粗糙的表面和多孔结构,能够高效负载结合更多的CRP抗体,使得该生物电极具有更宽的线性范围、灵敏度高、生物相容性好、再现性强等优点。线性响应范围为10 ng/mL~10 μg/mL,在磷酸缓冲盐PBS(pH7.4)低频范围内(<10 Hz)灵敏度可达到46.27 Ωcm2。Liu等[34]研究了一种具有高生物活性的传感器,采用戊二醛做交联剂把anti-CRP和半胱氨酸固定在金电极上。为了提高该无标记免疫传感器选择性和灵敏度,该实验还用镍复合物来修饰金纳米粒子作为探针。该阻抗型传感器的线性范围为0.2 μg/mL~1 μg/mL,检测下限为3.56 ng/mL,线性相关系数r2=0.9979,该传感器具有灵敏度高、选择性好和稳定性好等优点。Babakhanian等[35]在研究中,用巯基十一氢十二硼酸盐Na2B12H11SH(MUA)作为稳定剂合成银纳米颗粒,此外还合成一种新的Ag@MUA核壳结构材料,制备新的传感膜。用电化学的方法合成金纳米粒子(Au NPs)同时固定到电化学聚合聚吡咯(PPy)薄层和还原氧化石墨烯(rGO)在玻碳电极表面,形成GC/PPy-AuNPsrGO。然后在室温下,通过半胱氨酸(L-Cys)连接配体和三氟甲烷磺酸酐(TF2O),同时把Ag@MUA连接到GC/PPy-AuNPs-rGO膜表面。通过EIS电化学阻抗谱、循环和方波伏安法技术来实现对细胞色素、C蛋白(CCP)和CRP的同时检测。该传感器具有准备简便、准确性高、精密度好和抗干扰能力强等优点。已经成功地运用在临床上分析人类血清中CRP和CCP。2013年,Esteban-Fernández de Ávila等[36]研发了一次性测量电化学磁免疫传感器用于灵敏的测量人类血清中的CRP,也可用于预测未来心血管疾病。该磁免疫传感器具有超强的分析性能,检测下限可达到0.021 ng/mL,线性范围远低于心血管疾病最低危险值(1000 ng/mL),在临床有关范围内,该传感器同样可运用于检测稀释血清中的CRP。考虑到该分析方法的灵敏度和CRP在正常人体中的范围值,提出了制作了一次性批量生产的生物传感器的方案,为人类日常生活检测炎症、心脏病、心血管疾病等检测提供便携有效的方法。
近年来,可视化的电化学检测方法已被用于早期临床诊断。光学检测转化方法,其缺点是:灵敏度低、具有放射性,因而对健康危害极大。另一方面,电化学检测方法没有类似的缺陷,电化学分析和免疫传感器能够快速、方便、经济的检测[37]。因为它们是简单、易携带、易于操作、成本低廉,大多数情况下电化学免疫传感器被用作保健设备。电化学免疫传感器的优点,使得它在临床样品检测中应用越来越普遍。
1.4 表面等离子共振型免疫传感器
表面等离子共振型免疫传感器(Surface Plasmon Resonance,SPR)是一种光学免疫传感器,其原理:利用表面等离子共振技术作为检测免疫分子之间的反应。当光线入射到贵金属纳米颗粒上时,若入射频率正好与纳米颗粒传导电子的振动频率相同时,纳米颗粒就会产生很强的吸收,因此就会产生局域表面等离子体共振现象。目前,对表面等离子共振型免疫传感器的研究应用已体现出其独特的优势[38]。
2006年,Meyer等[39]首次基于SPR检测CRP建立了免疫传感器。线性检测范围为2~5 μg/mL,使用两种不同CRP抗体(单克隆IgG)从而实现对CRP的追踪检测。并且,其中一种抗体(anti CRP)的动力学结合常数或离解常数可以同时确定出来。2013年,Yeom等[40]提出了一种基于纳米结构阳极氧化铝氧化物(AAO)为固定基质,金纳米粒子(GNP)标记的抗体,形成一种夹心型的高灵敏度的局域型表面等离子体共振(LSPR)生物传感器。该研究中加入GNP标记CRP抗体的传感器的响应灵敏度增加1.84倍,且检测(LOD)的下限低至100 ag/mL。该免疫传感器显示出灵敏度高、浓度范围宽,有很好的选择性。2014年,Kim等[41]研究了在固体表面通过用双抗体结合的方法,用链霉亲和素融合蛋白A来特异性结合固定一抗,二抗用在金片表面的电化学分析与CRP结合,融合的蛋白和抗体可通过生物素-链霉亲和素之间的强交互作用成功地固定在金表面,作为表面等离子共振来分析检查,研究结果表明,检测限可达到2 pg/mL,线性范围在0.01 pg/mL~1 mg/mL,该传感器具有精度高、稳定性好(在4℃保存35 d后,电信号维持原来的88%)。该研究为现场CRP的便携式检测的发展提供了一种可能性。2015年,Vashist[42]研究了一种快速和高灵敏的表面等离子体共振(SPR)免疫传感器用于检测人C-反应蛋白,采用(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)用于活化蛋白A/G(Pr A/G)然后用1%(V/V)3-氨基丙基三乙氧基硅烷(APTES)稀释,滴加在一个KOH处理过的金(Au)包被的SPR芯片,并培育30 min。当Pr A/G功能化的Au SPR芯片捕获结合anti-CRP抗体后,用牛血清白蛋白封闭后用于CRP的检测。与常规程序相比,高度简化的导向固定抗体策略缩短了5倍甚至更短的时间。这种CRP免疫传感器的检测范围为1.2~80 ng/mL,检出限(LOD)和最低检测下限(LOQ)分别为1.2 ng/mL和4.6 ng/mL。该研究检测的精确度与可作为临床上认可的分析仪为基础的免疫传感器及常规的CRP的夹心ELISA的CRP检测结果一致。该抗体结合的SPR芯片的功能活性可储存在4℃保留10周,从而显著节省了分析时间。
但对于SPR型免疫传感器来说,所需仪器相对成本高,但是测定低分子质量、低含量样品时其灵敏度不高。因此构建新型SPR免疫传感器,仍是科学研究者艰巨而漫长的任务。
1.5 石英晶体微天平型传感器
石英晶体微天平(Quartz Crystal Microbalance,QCM)的研究发源于上世纪60年代初期。QCM型免疫传感器的响应原理是:在外力作用下,石英晶体会产生压电效应,当外界电子和机械振荡电路的频率与晶体基频近似接近时,就会产生频率共振,石英晶体电极表面质量变化转化为电路输出电信号,最后通过计算机以数据的形式输出。相对于SPR传感器而言,石英晶体微天平传感器较早地被用在免疫分析检测的领域中。QCM作为微质量传感器具有操作简单、实时跟踪在线分析、灵敏度高、省时省力、成本低、精确度可达到ng级别等优点。目前已经被广泛应用于化学工程、医学诊断、制药工程、生物科学以及环境监测等[43]多个领域中。
2007年,Park等[44]添加水溶性两亲磷脂聚合物修饰在金电极上用于免疫传感器构建人造细胞膜结构,该聚合物的活性酯基可用于固定生物分子,此外,它部分可被转化成硫醇基团作为固定基质固定在石英晶体微天平(QCM)的金电极表面。通过QCM分析实现对CRP的样品分析。2009年,Kim等[45]研究了一种高灵敏间接竞争型石英晶体微量天平免疫传感器用于检测心血管标志物C-反应蛋白。该传感器系统由缓冲液储、微分配泵、进样器、传感器芯片、振荡器模块、频率响应分析器和PC流通单元构成。该系统的反应缓冲液为0.1 mol/L磷酸钠缓冲液(pH7.0),固定的用于竞争反应的最佳CRP和CRP抗体浓度分别为2 mg/mL和0.250 mg/mL。CRP浓度的对数与传感器响应在CRP浓度范围为0.130~25016 ng/mL之间呈线性关系,检测下限为0.130 ng/mL。该研究发现,一个集成电路的QCM免疫传感器可在固定CRP的选定浓度和CRP抗体竞争反应。它可能被用作高通量快速的检测CRP生物标志物分析工具。2011年,Ogi等[46]研究了一种灵敏度放大的检测方法来替代无电极石英晶体微天平(QCM)生物传感器。该研究中用夹心法检测C-反应蛋白(CRP),其中一抗CRP抗体非特异性地固定在裸石英表面,二抗CRP抗体通过链霉亲和素来提高灵敏度,该研究中的质量扩增的夹心法检测CRP溶液的最低值为0.1 ng/mL。此外他们也提出了一种用于确定注入的蛋白质的分子量的方法,第二种CRP抗体的分子量估计为3200 kDa。2012年,Zhou等[47]结合了磁珠生物复合物(Fe3O4@SiO2-CRP Ab1)作为捕获探针和HRP标记的抗体共同固定在金纳米颗粒,即形成(AuNPs-HRP-Ab2/HRP)作为标记物,用于构建一种超灵敏的CRP压电免疫传感器。SiO2包裹的磁珠(Fe3O4@SiO2)用于标记CRP抗体(Ab1),Fe3O4@SiO2相比Fe3O4纳米颗粒有更多的单分散尺寸大小均匀的粒子,便于形成生物复合物,并且可利用磁性进行分离。此外,压电传感器表面很容易再生和重复使用,该研究方法为其它生物标志物在心脏病的临床分析技术中提供潜在的运用方案。表1为C-反应蛋白免疫传感器检测方法及类型。
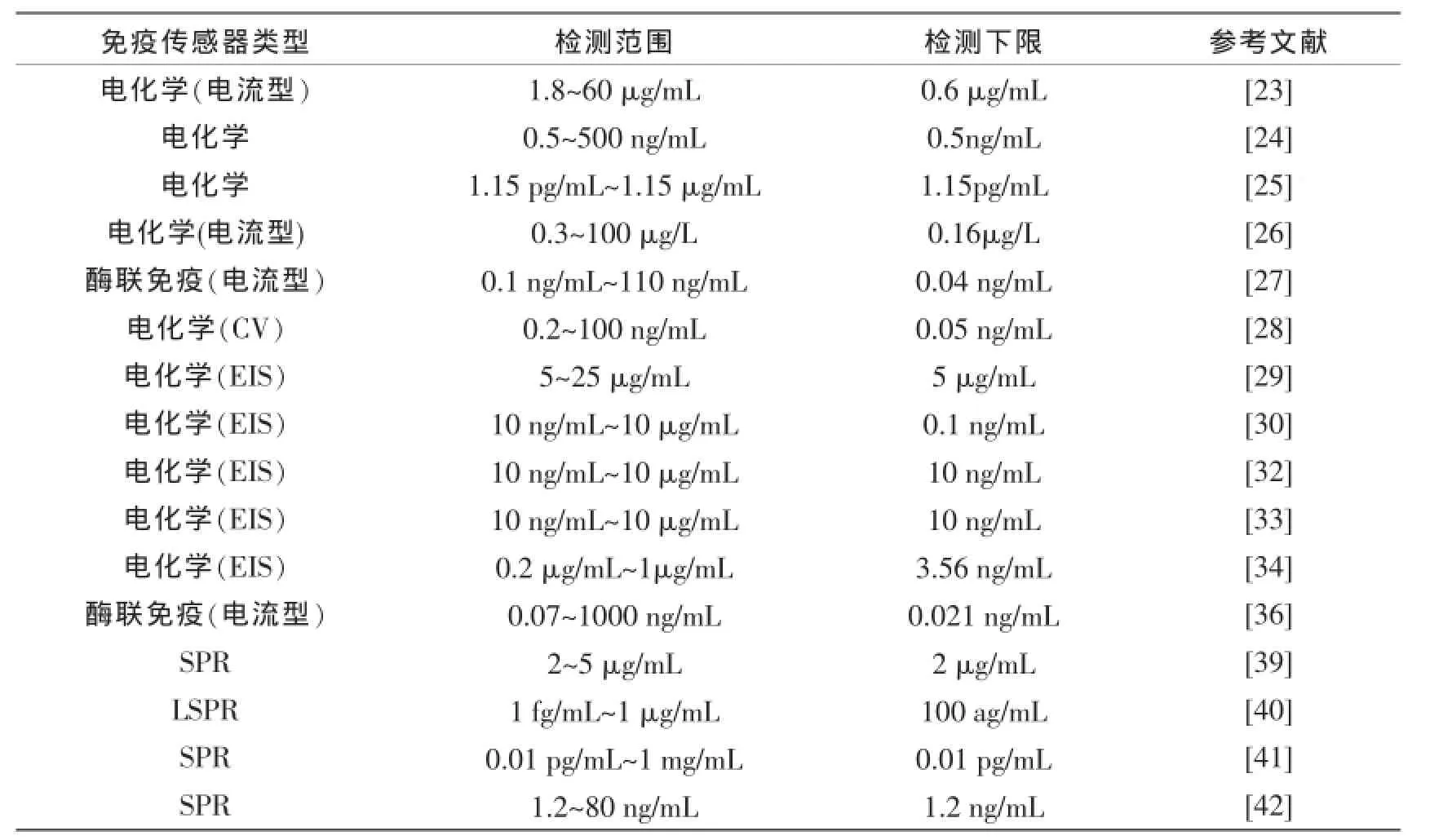
表1 C-反应蛋白免疫传感器检测方法及类型Tab.1The method and type of C-reactive protein immunosensors
2 总结
电化学免疫传感器由于具有操作简单方便、快速、灵敏度高等特点,在临床分析中的应用越来越广泛,现正朝着微型化(商品化、一次性)、并与其它分离技术(如毛细管电泳、高效液相色谱等自动化仪器联用)结合向智能型、自动化方向发展。SPR、QCM型传感器也被广泛用于免疫分析领域。但是,目前这些研究大多还停留在实验室阶段,原因之一是受制作工艺的限制,很多研究制备的传感器目前都没有进行大规模工业化生产;其二,这些传感器的再生使用不理想,在不破坏自组装单层膜的结构前提下,对已结合的抗原抗体进行有效地分离的方法还不成熟。如何进一步提高这些免疫传感器的性能,使得该类传感器能广泛的应用于常规分析检测,还需要解决电极稳定性、再生性等诸多问题。其三,如何降低成本,使得大型仪器微型化,是有关研究者在使免疫传感器能从实验室研究转向更多的实际领域所面临的主要挑战。
[1]Paul M,Ridker M D.Clinical application of C-reactive protein for cardiovascular disease detection and prevention[J].Circulation,2003,107(3):363-369.
[2]Thomas J,Wang M D,Philimon Gona,et al.Multiple biomarkers for the prediction of first major cardiovascular events and death[J].Digest of the World Core Medical Journals,2006,355(25):2631-2638.
[3]Ge Y,Wang T J.Identifying novel biomarkers for cardiovascular disease risk prediction[J].Journal of Internal Medicine,2012,272(5):430-439.
[4]李玉东,冯文化,毛绍芬.C反应蛋白水平在冠心病中的意义[J].中国心血管杂志,2002,7(3):198-199.
[5]潘高峰.C-反应蛋白、糖化血红蛋白与低密度脂蛋白水平在糖尿病并发冠心病中的意义[J].航天航空医药,2010,21(7):1088-1089.
[6]彭慧萍,庾永基,肖彩宏.超敏C反应蛋白在冠心病诊断中的临床意义[J].长江大学学报(自然科学版), 2011,8(11):159-163.
[7]宋荣海.超敏C反应蛋白与血脂检测在冠心病诊断中的临床价值[J].航天航空医药,2015,26(4):420-421.
[8]曾静.肌钙蛋白I与超敏C反应蛋白联合检测对冠心病的诊断意义[J].海峡药学,2015,27(2):123-124.
[9]盘荣棠.高敏C反应蛋白和脂蛋白(a)联合检测在冠心病诊断中的应用[J].国际医药卫生导报,2015,21(4): 528-529.
[10]张利国.C-反应蛋白测定在手足口病监测中的意义[J].检验医学与临床,2014,11(A02):81-83.
[11]Cui R J,Pan H C,Zhu J J,et al.Versatile immunosensor using CdTe quantum dots as electrochemical and fluorescent labels[J].Analytical Chemistry,2007,79(22): 8494-8501.
[12]Vashist S K,Czilwik G,Oordt T V,et al.One-step kinetics-based immunoassay for the highly sensitive detection of C-reactive protein in less than 30 min[J].Analytical Biochemistry,2014,456(7):32-37.
[13]Liu R P,Liu J T,Xie L,et al.A fast and sensitive enzyme immunoassay for brain natriuretic peptide based on micro-magnetic probes strategy[J].Talanta,2010,81(3): 1016-1021.
[14]Stefan R I,Staden J Q,Hassan Y,et al.Immunosensors in clinical analysis[J].Fresenius Journal of Analytical Chemistry,2000,366(6-7):659-668.
[15]Chikkaveeraiah B V,Bhirde A,Morgan N Y,et al.Electrochemical immunosensors for detection of cancer protein biomarkers[J].ACS Nano,2012,6(8):6546-6561.
[16]严枫,胡效亚.免疫传感器在肿瘤标志物检测中的应用[J].分析测试学报,2006,25(2):132-136.
[17]汤俊琪,庞广昌.免疫传感器测定食品中黄曲霉毒素的研究进展[J].食品科学,2009,30(17):326-329.
[18]刘继超,姜铁民,陈历俊,等.电化学免疫传感器在食品安全检测中的研究进展[J].中国食品添加剂,2011, 18(1):216-222.
[19]陈向强.检测水中微囊藻毒素-LR电化学免疫传感器[D].北京:北京大学,2011.
[20]钟桐生,刘国东,沈国励,等.电化学免疫传感器研究进展[J].化学传感器,2001,22(1):7-14.
[21]陈慧连,陈伟锐.电化学免疫传感器的发展概述[J].广州化工,2013,41(11):56-58.
[22]王珂,江德臣,刘宝红,等.无标记型免疫传感器的原理及其应用[J].分析化学评述与进展,2005,33(3): 411-416.
[23]林朝晖,沈国励,詹萃芳,等.C反应蛋白免疫电极的研究[J].分析化学,1993,21(9):1013-1017.
[24]Buch M,Rishpon J.An electrochemical immunosensor for C-reactive protein based on multi-walled carbon nanotube-modified electrodes[J].Electroanalysis,2008, 23(20):2592-2594.
[25]Hennessey H,Afara A,Omanovic S,et al.Electrochemical investigations of the interaction of C-reactive protein (CRP)with a CRP antibody chemically immobilized on a gold surface[J].Analytica Chimica Acta,2009,643(1-2):45-53.
[26]Zeng S L,Zhou H K,Gan N,et al.A renewable C reactive protein amperometric immunosensor based on magnetic multiwalled carbon nanotubes probles modified electrode [J].Applied Mechanics and Materials,2011,80-81(5): 452-456.
[27]侯建国,曹玉廷,周汉坤,等.可再生使用的磁性纳米修饰C反应蛋白电流型免疫传感器[J].传感技术学报, 2011,24(10):1371-1378.
[28]Kokkinos C,Prodromidis M,Economou A,et al.Disposable integrated bismuth citrate-modified screen-printed immunosensor for ultrasensitive quantum dot-based electrochemical assay of C-reactive protein in human serum[J].Analytica Chimica Acta,2015,886(3):29-36. [29]Zhu J J,Xu J Z,He J T,et al.An Electrochemical immunosensor for assays of C-reactive protein[J].Analytical Letters,2003,36(8):1547-1556.
[30]Chen X J,Wang Y Y,Zhou J J,et al.Electrochemical impedance immunosensor based on three-dimensionally ordered macroporous gold film[J].Analytical Chemistry, 2008,80(6):2133-2140.
[31]Hafaiedh I,Chammem H,Abdelghani A,et al.Supported protein G on gold electrode:characterization and immunosensor application[J].Talanta,2013,116(22):84-90.
[32]Singal S,Biradar A M,Mulchandani A,et al.Ultrasensitive electrochemical immunosensor based on Pt nanoparticle-graphene composite[J].Applied Biochemistry Biotechnology,2014,174(3):971-983.
[33]Mishra S K,Sharma V,Kumar D,et al.,Biofunctionalizedgold nanoparticle-conducting polymer nanocomposite based bioelectrode for CRP detection[J].Applied Biochemistry Biotechnology,2014,174(3):984-997.
[34]Liu Z,Li W,Han G C,et al.Towards label-free impedance biosensors:CRP probe based on thiol schiffnickel complex modified gold nNanoparticles[J].Journal of the Electrochemical Society,2014,161(5):B75-B80.
[35]Babakhanian A,Ehzari H,Kaki S,et al.A novel modified electrode as GC/PPy-AuNPs-rGO/L-Cys/Ag@MUA nanostructure configuration for determination of CCP and CRP antibodies in human blood serum samples[J]. Biosensors and Bioelectronics,2015,63(70):490-498.
[36]Fernándezdeávila B E,Gómez V E,SusanaCampuzano. Ultrasensitive amperometric magnetoimmunosensor for human C-reactive protein quantification in serum[J]. Sensors&Actuators B Chemical,2013,188(11):212-220.
[37]Perumal P,Hashim U.Advances in biosensors:Principle, architecture and applications[J].Journal of Applied Biomedicine,2014,12(1):1-15.
[38]徐霞,叶尊忠,吴坚,等.表面等离子体共振免疫传感器在蛋白质检测中的应用及其研究进展[J].分析化学评述与进展,2010,38(7):1052-1059.
[39]Martin H F,Meyer,Hartmann M,et al.SPR-based immunosensor for the CRP detection-a new method to detect a well known protein[J].Biosensors and Bioelectronics,2006,21(10):1987-1990.
[40]Yeom S H,Han M E,Kang B H,et al.Enhancement of the sensitivity of LSPR-based CRP immunosensors by Au nanoparticle antibody conjugation[J].Sensors& Actuators B Chemical,2013,177(2):376-383.
[41]Kim G W,Zheng S,Kim M S,et al.Development of specific immobilization method on gold surface and its application for determining cardiac risk[J].Biochip Journal, 2014,8(4):295-302.
[42]Vashist S K,Schneider E M,Luong J H.Surface plasmon resonance-based immunoassay for human C-reactive protein[J].Analyst,2015,140(13):4445-4452.
[43]崔学晨,封雷,崔实.石英晶体微天平传感器在生物和化学领域的应用[J].现代科学仪器,2013,(4):68-79.
[44]Park J,Kurosawa S,Takai M,et al.Antibody immobilization to phospholipid polymer layer on gold substrate of quartz crystal microbalance immunosensor[J].Colloids Surf B Biointerfaces,2007,55(2):164-172.
[45]Kim N,Kim D K,Cho Y J.Development of indirectcompetitive quartz crystal microbalance immunosensor for C-reactive protein[J].Sensors&Actuators B Chemical,2009,143(1):444-448.
[46]Ogi H,Yanagida T,Hirao M,et al.Replacement-free mass-amplified sandwich assay with 180-MHz electrodeless quartz-crystal microbalance biosensor[J]. Biosensors and Bioelectronics,2011,26(12):4819-4822.
[47]Zhou J,Gan N,Li T H,et al.Ultratrace detection of C-reactive protein by a piezoelectric immunosensor based on Fe3O4@SiO2magnetic capture nanoprobes and HRP-antibody co-immobilized nano gold as signal tags[J]. Sensors&Actuators B Chemical,2013,178(3):494-500.
Research progress of C-reactive protein immunosensor
Liu Yi1,2,Liu Ting-zhi1,Zhang Kun-lei1,Bai Ru-yan1,Li De-lei1,Zhang Xi1,Hu Rong1*,Yang Yun-hui1*
(1.Chemistry and Chemical Engineering College,Yunnan Normal University,Kunming 650500,China) (2.Zhaotong Center for Disease Control and Prevention,Zhaotong 657008,China)
C-reactive protein(CRP)is an acute phase protein,which is synthesized in liver and fat cells.C-protein can be used as a marker of coronary heart disease,cardiovascular disease and other diseases.Therefore,the detection of CRP is of great significance to the clinical diagnosis.The immunosensor has been widely used in clinical diagnosis,environmental monitoring,pharmaceutical engineering,food analysis.In this review,the research progress of electrochemical immunosensor,surface plasmon resonance(SPR)immunosensor,quartz crystal microbalance (QCM)for the detection of CRP were summarized.
C-reactive protein;electrochemical immunosensor;surface plasmon resonance(SPR)immunosensor; quartz crystal microbalance(QCM)immunosensor;immunosensor
国家自然科学基金项目(No.21465026,21165023)
*通信联系人,Tel:0871-65941087,E-mail:yyhui2002@aliyun.com,hudierong_168@163.com

